颈动脉斑块形态学与血浆炎症介质的关系研究
李 华 方嘉阳
解放军第四七六医院神经内科,福建福州 350002
颈动脉粥样硬化作为引发脑缺血的重要影响因素之一,对患者的健康有严重的影响。动脉粥样硬化中斑块表现出了由稳定转变为易损的过程,在此过程中,包含了炎症、免疫、代谢、凝血等不同环节,而上述影响环节中较为关键的是炎症反应,该反应极易引发患者动脉粥样硬化斑块的易损[1-2]。通常的评估方式是采取单纯显示动脉管腔或斑块形态的影像技术,但其作为常规技术,不能合理有效地完成斑块的形态及功能评价。本次研究应用超声检查的方式,诊断和评估急性脑梗死患者颈动脉斑块的形态学改变情况,同时,综合评价斑块的易损指标,包含测定血浆炎症介质高敏C-反应蛋白(hs-CRP)、基质金属蛋白酶(matrix metalloproteinase,MMP,including MMP-2 and MMP-9)、CD40 配体(CD40L)水平,现总结报道如下:
1 资料与方法
1.1 一般资料
本次研究的对象包括:①选择2008年8月~2009年10月在我院神经内科接受治疗的68例首次发病的前循环型脑梗死患者(A组),24 h内发病入院,其中,男35例,女32例,年龄42~81岁,平均(61.2±10.9)岁,经过诊断上述患者均符合1995年全国第四届脑血管病学术会议制订的有关标准,且经头颅CT和(或)MRI的查实;②选取同时期治疗的颈动脉硬化无症状患者62例(B组),其中,男32例,女30例,年龄43~78岁,平均(61.1±10.7)岁,通过超声检查,确有颈动脉斑块,1年内没有发生短暂性脑缺血症状,且经头颅CT和(或)MRI查实,无脑梗死;③选取同时期健康对照者56例(C组),其中,男 31 例,女 25 例,年龄 44~77 岁,平均(60.7±10.8)岁。经过统计学分析,三组患者性别、年龄相差异无统计学意义(P>0.05),且A组和B组患者在吸烟、高血脂、高血压、糖尿病等有关因子上差异无统计学意义(P>0.05),具有可比性。上述所有患者均签署知情同意书。
1.2 方法
1.2.1 颈动脉超声检查 仪器采用彩色多普勒超声诊断仪,要求探头频率7~12 MHz,对患者双侧颈动脉给予检查。检查步骤为从颈动脉开始,经过胸锁乳突肌内侧缘上行给予纵向的扫描检查,获得颈总动脉、颈动脉球部、颈内动脉和颈外动脉的数据,之后给予横行扫描检查。测量的指标包括:①颈动脉内膜中层厚度(IMT):正常范围为<1.0 mm,内膜增厚范围在1.0~1.2 mm之间,而≥1.2 mm表示具有斑块;②斑块类型:稳定斑块(扁平斑和硬斑)、易损斑块(混合斑和软斑),斑块分类主要参考斑块形态和回声特点给予区分。所有脑梗死患者均于入院1周内完成检查。
1.2.2 血浆炎症介质测定 要求给予入院次日晨时空腹静脉抽血5 mL,离心后取上清液,-70℃低温储存。血清hs-CRP、MMP-2、MMP-9、CD40L水平的测定采用酶联免疫吸附(ELISA)法完成。
1.2.3 神经功能评价 对A组患者给予神经功能评价,首先在患者入院后给予神经功能打分,参考的标准为中国脑卒中临床神经功能缺损程度评分量表,分为3个层次,轻型:0~15分,中型:16~30 分,重型:31~45 分[3]。
1.3 统计学方法
采用SPSS 13.0统计学软件进行数据分析,计量资料数据用均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析;计数资料用率表示,组间比较采用χ2检验,并结合Pearson和Spearman秩对正态分布和非正态分布数据给予相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 两组颈动脉超声斑块类型比较
超声检查显示,A组IMT值高于B组(P=0.024),A组颈动脉斑块组成以易损斑块 (60.3%)为主,B组以稳定斑块(77.4%)为主。见表1。
表1 两组颈动脉超声斑块类型比较(±s)

表1 两组颈动脉超声斑块类型比较(±s)
指标 A组(n=68)B组(n=62) t值 P值IMT(mm)无斑块[n(%)]稳定斑块[n(%)]易损斑块[n(%)]2.14±1.25 7(10.3)20(29.4)41(60.3)1.63±0.82 0(0)48(77.4)14(22.6)5.411 7.514 3.144 4.113 0.024 0.001 0.016 0.012
2.2 血浆炎症介质水平及相关性分析
如表 2所示,易损斑块患者血浆 hs-CRP、MMP-2、MMP-9、CD40L水平均高于无斑块和稳定斑块患者 (P<0.05)。 A 组血浆 hs-CRP、MMP-2、MMP-9、CD40L 水平均高于 B、C 两组(P < 0.05)。
相关分析显示,易损斑块组血浆hs-CRP水平与MMP-2、MMP-9 均 呈 正相关 (r=0.718,P=0.001;r=0.647,P=0.001);MMP-2 与 MMP-9 及 CD40L 均呈正相关 (r=0.724,P=0.001;r=0.503,P=0.010);MMP-9 与 CD40L 呈正相关(r=0.539,P=0.012)。 且 A 组 患 者 血 浆 hs-CRP、MMP-2、MMP-9、CD40L与神经功能缺损程度评分均呈正相关 (r=0.728,P=0.001;r=0.714,P=0.001;r=0.742,P=0.001;r=0.536,P=0.010)。
表2 各组血浆炎性介质水平比较(±s)
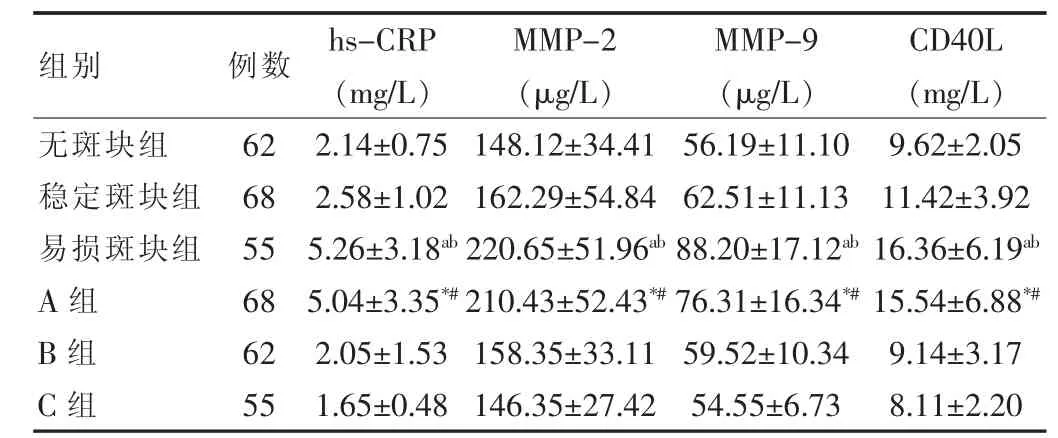
表2 各组血浆炎性介质水平比较(±s)
注:与无斑块组比较,aP<0.05;与稳定斑块组比较,bP<0.05;与C组比较,*P<0.05;与 B 组比较,#P<0.05
组别 例数 hs-CRP(mg/L)MMP-2(μg/L)MMP-9(μg/L)CD40L(mg/L)无斑块组稳定斑块组易损斑块组A组B组C组62 68 55 68 62 55 2.14±0.75 2.58±1.02 5.26±3.18ab 5.04±3.35*#2.05±1.53 1.65±0.48 148.12±34.41 162.29±54.84 220.65±51.96ab 210.43±52.43*#158.35±33.11 146.35±27.42 56.19±11.10 62.51±11.13 88.20±17.12ab 76.31±16.34*#59.52±10.34 54.55±6.73 9.62±2.05 11.42±3.92 16.36±6.19ab 15.54±6.88*#9.14±3.17 8.11±2.20
3 讨论
常规认为脑缺血事件发生的主要原因是颈动脉粥样硬化病症中出现了动脉狭窄性血栓所引发的。当前,研究发现,大部分患者出现脑缺血事件,在很大程度是因为易损斑块多导致的[4]。在病理上,易损斑块主要呈现斑块破裂、斑块表面溃疡及血栓形成、纤维帽变薄、斑块出血、新生血管变大无规则,有炎症细胞浸润的问题,均显示出了内部病理变化中的特征,上述的变化是因为斑块内炎症细胞、平滑肌细胞、血管内皮细胞及血管外基质全面影响作用的结果[5-6]。本次研究的评价方式是通过无创性超声技术来获得数据,该技术在国际上运用成熟。本研究显示,A组颈动脉斑块以易损斑块(60.3%)为主,B组以稳定斑块(77.4%)为主,出现脑梗死的病理基础是支持颈动脉斑块的类型。
斑块内炎症作为引发斑块易损的重要影响因素,炎症的反应程度与斑块破裂存在明显关系[7]。CRP是一种反映机体炎症状态的敏感指标。相关研究表明,患者的CRP水平与冠状动脉、脑动脉和周围动脉粥样硬化之间存在显著相关性。本研究显示,颈动脉易损斑块者血浆 hs-CRP、MMP-2、MMP-9水平均高于无斑块和稳定斑块者,并且血浆hs-CRP与MMP-2、MMP-9均呈正相关,表明hs-CRP与MMP-2、MMP-9可能一起参与了斑块的炎症过程。经过病理学查实,MMP过度表达发生位于斑块肩部与纤维帽等易破裂之处,其通过降解纤维帽的胶原组织和细胞外基质,在斑块破裂中起着重要作用。已有学者证实,检测血浆MMP水平在预测斑块易损性中,无法取代。本研究结果表明,易损斑块者血浆CD40L水平高于无斑块和稳定斑块者,CD40L与MMP-2、MMP-9均呈正相关。CD40/CD40L过度表达可激发免疫及炎症的急性反应,经过上调斑块内MMP的表达而引起斑块破裂及血栓症状[8]。本研究通过检测发现,易损斑块患者血浆 hs-CRP、MMP-2、MMP-9、CD40L 水平均显著升高, 提示超声检查结合检测血浆炎症介质水平可能更有助于判断颈动脉硬化斑块的易损性。
斑块内炎症作为引发斑块易损的重要影响因素,表现出了结构性不稳定、转向功能性不稳定的特征。本研究通过超声检查显示,B组患者的易损斑块所占比例为22.6%,没有出现脑缺血事件,原因可能与斑块内炎症反应不强有关。A组脑梗死患者血浆 hs-CRP、MMP-2、MMP-9、CD40L 水平均显著提升,并与神经功能缺损程度评分呈正相关,提示血浆炎症介质水平对脑梗死急性期相关炎症的反应程度有重要预示作用,这有利于更好地分析脑梗死急性期问题。
[1]Matfin G.Review:biomarkers in clinical trials and drug development:measurement of cardiometabolic risk [J].Br J Diabetes Vasc Dis,2007,7:101-106.
[2]高晶,郭玉璞,赵庆杰,等.颅内动脉粥样硬化的分布及炎性因素探讨[J].中华神经科杂志,2006,39(6):459-462.
[3]饶明俐.中国脑血管病防治指南[M].北京:人民卫生出版社,2007:134-135.
[4]陈今,李晓彦,杨显国.彩色超声观察低血压患者血流剪切应力对颈动脉粥样硬化的影响[J].中国医药导刊,2011,13(9):1531-1532.
[5]Fishbein MC.The vulnerable and unstable atherotic plaque[J].Cardiovasc Pathol,2010,19(1):6-11.
[6]王彦永,时军,马晓伟.动脉粥样硬化斑块中CD40-CD40配体介导的炎性反应及他汀类药物的抑制作用[J].临床误诊误治,2011,24(1):85-87.
[7]Ridker PM.Testing the inflammatory hypothesis of atherothrombosis:scientific rationale for the cardiovascular inflammation reduction trial(CIRT) [J].J Thromb Haemost,2009,7(1):332-339.
[8]Davì G,Tuttolomondo A,Santilli F,et al.CD40 ligand and MCP-1 as predictors of cardiovascular events in diabetic patients with stroke[J].J Atheroscler Thromb,2009,16:707-713.

