玉米芯中木聚糖提取方法的研究
赵灵希,郭仁杰,熊海容
玉米芯中木聚糖提取方法的研究
赵灵希,郭仁杰,熊海容*
(中南民族大学 生命科学学院,湖北 武汉 430074)
采用碱解玉米芯粉末后,玉米芯碱解液用30%(w:v)过氧化氢溶液脱色并且用10%(w:v)三氯乙酸溶液脱蛋白来提取木聚糖,收得率分别为24.4%。并用真菌DSM10635菌株产的木聚糖酶对以三种不同来源的木聚糖以及自提玉米芯木聚糖为底物测得的米氏常数进行比较,还检测比较了DSM 10635木聚糖酶以桦树和自提木聚糖作为底物的最佳酶促反应温度。结果表明,从玉米芯自提木聚糖的Km值7.5303与燕麦木聚糖的Km值5.6044相近,桦树和自提的木聚糖的最佳酶促反应温度也都在65-70℃左右,具有一定的取代性。方法简单,收得率较高的木聚糖提取方法对工业上大量生产具有重要的意义。
玉米芯;木聚糖;木聚糖酶产物
自然界中最广泛的存在于硬木植物和其他一些植物(如禾本种,谷类和草本植物等)中的木聚糖即为半纤维素木聚糖[1]。通过共价键和非共价键的连接而形成的木聚糖、纤维素和木质素是构成植物细胞壁的主要结构[2],木聚糖在被子植物来源的硬木质中,占植物细胞壁总量的15~30%[3]。木聚糖是一种通过β-1,4-糖苷键连接β-D-吡喃型木糖单元而构成主链的异质多糖。大部分木聚糖是异型多糖,主链或侧链上带有多种不同的取代基。常见的取代基有葡萄糖醛酸、4-O-甲基-D-葡萄糖醛酸、α-L-阿拉伯呋喃醛酸、乙酰基、阿魏酰基和p-香豆酰基[4、5]。经酶水解可生产国际市场上急需的低聚木糖、木糖等疗效食品[6、7]。木聚糖作为生产木聚糖和木糖的原料是十分重要而必须的,但实际上商品木聚糖十分昂贵,无法作为生产原料,这时就需要探讨量足价廉的木聚糖的生产方法。此文通过碱解玉米芯这两种容易获得的原料而得到木聚糖,为后续酶解木聚糖得到木寡糖提供了基础。
近来,木聚糖被看成是最重要的可再生资源之一,是因为它对通过化学修饰反应而得到的新生物多聚体材料以及功能聚合物有着重要的基础作用[8、9]。木聚糖也因为其中功能分子的多样性的应用潜力无限而被看好,木聚糖及其衍生物最有可能产生的重要的应用便是药物载体、伤口敷料以及造纸业中的添加剂[10]。另外,木聚糖在食品中可用作乳化剂及膳食纤维,具有促进有丝分裂及免疫调节等功能[11、12]。
文中以玉米芯为原料,通过碱法抽提获得木聚糖,由玉米芯所得的木聚糖经过过氧化氢脱色,三氯乙酸脱蛋白,得到进一步的纯化,收得率较高,为后续用自提木聚糖酶解得到木寡糖提供了很好的原材料,简化了为木寡糖的提取而需要的的纯化步骤。并且通过对不同来源的木聚糖的米氏常数比较以及最适酶促反应温度的对比,表明从玉米芯提取所获得的木聚糖具有一定的取代性。这一研究在可再生半纤维素资源的开发利用中具有重要意义。
1 材料与方法
1.1 材料与试剂
原料: 玉米芯:河南,粉碎成直径0.2mm及以下的颗粒。
菌种:嗜热真菌DSM10635从德国微生物菌种保藏中心(www.dsmz.de)DSMZ购买。
木聚糖酶液:发酵液8000×离心10min除去沉淀,上清液为木聚糖酶液。
桦树木聚糖(Sigma,X0502),山毛榉木聚糖(Sigma,X4252),燕麦木聚糖(Sigma),盐酸,3,5—二硝基水杨酸(DNS)溶液,乙酸,次氯酸钠,氨水,氢氧化钠,过氧化氢,三氯乙酸,乙醇。
1.2 仪器与设备:
SB-10A粉碎机 速邦500g多功能粉碎机;SHZ-D(Ⅲ)型循环水真空泵 上海东玺制冷仪器设备有限公司;HH-2恒温水浴锅 金坛市科兴仪器厂;152型紫外可见分光光度计 上海光谱仪器有限公司;85-2恒温磁力搅拌器 金坛市科兴仪器厂;FD-1D-50冷冻干燥机 北京博医康实验仪器有限公司。
1.3 方法
1.3.1 从玉米芯中提取木聚糖
将玉米芯烘干后粉碎成0.2mm大小左右的颗粒,称取40g玉米芯加入400ml蒸馏水,120℃高温预处理30min,过滤取滤渣[19],将滤渣烘干后,加入400ml 15%(w:v)的氢氧化钠溶液,110℃高温蒸煮30min,过滤取滤液,将滤液用30%(w:v)的氢氧化钠做脱色处理,脱色后加入10%(w:v)的三氯乙酸溶液(10:1)脱蛋白,10000r/min 离心20min,取上清液,加入浓盐酸调pH值至中性。加入三倍体积的无水乙醇溶液过夜醇沉,8000r/min离心20min得到沉淀即为粗提木聚糖,-20℃冷冻过夜后冷冻干燥得到较纯的木聚糖 。玉米芯木聚糖收得率%=所得玉米芯木聚糖(g)/原始玉米芯质量(g)×100%。
1.3.2 测不同来源的木聚糖和自提木聚糖的米氏常数
测试米氏常数的方法以燕麦木聚糖为例,其他木聚糖米氏常数的测定方法与其一样(其中自提玉米芯木聚糖中使用的浓度是0.1%、0.2%、0.3%、0.4%、0.5%、0.6%、0.7%):
样品测定:用移液器吸取1.8ml的0.2%、0.4%、0.6%、0.8%和1%的燕麦木聚糖-磷酸缓冲液,分别打入1支干净的具塞试管,置于电控恒温水箱中, 60℃恒温下预热两分钟,加入0.2ml粗酶液,充分混匀,准确反应10分钟,再加入3mlDNS,充分混合,置沸水中煮沸5分钟,然后迅速用冷水将其冷却至室温,在540nm下以空白样对照测定吸光值。每种浓度的燕麦木聚糖-磷酸缓冲液做3个平行实验。结果取其平均值。
1.3.3 将sigma的桦树木聚糖和自提玉米芯木聚糖作为底物检测DSM10635木聚糖酶的最佳酶促反应温度的确定试验
样品测定:用移液器吸取1.8ml的0.5%桦树和自提玉米芯木聚糖—磷酸缓冲液,分别打入1支干净的具塞试管置于电控恒温水箱中,加入0.2ml粗酶液充分混匀,分别在50℃、55℃、60℃、65℃、70℃、75℃、80℃和90℃准确反应15分钟后,拿出再加入3mlDNS,充分混合,置沸水中煮沸5分钟,然后迅速用冷水将其冷却至室温,在540nm下以空白样对照测定吸光值。每种温度做3个平行实验。结果取其平均值。
2 结果与分析
2.1玉米芯提取木聚糖的收得率
40g玉米芯最后得到木聚糖的总量是9.77g,所以自提玉米芯木聚糖的收得率为24.4%,较高的收得率对以后工业上大量的获得木聚糖有着重要的意义。
2.2不同来源和处理方法得到的木聚糖比较
未脱色未脱蛋白得到的自提玉米芯木聚糖颜色相对要深一些,而且后来在配制木聚糖溶液时,未经任何处理的木聚糖基本不能完全溶解,在溶液中有细小的悬浮颗粒,而经脱蛋白脱色后的可以完全溶解成乳白色的木聚糖溶液,和从sigma购买的桦树木聚糖配制出来的溶液就外观上看基本一致。由后续实验结果也可知性质上也是相似的,具有可替代性。
2.3木聚糖酶对四种不同木聚糖底物所得的Km
木聚糖酶对以燕麦木聚糖为底物测得的Km是5.6044,以山毛榉木聚糖为底物测得的Km是4.1737,以桦树木聚糖为底物测得的Km是3.6273,以自提玉米芯木聚糖为底物测得的Km是7.5302。可以看出自提玉米芯木聚糖米氏常数7.5312与燕麦木聚糖的5.6044比较相近。说明自提木聚糖虽然有杂质,但是依然具有一定的取代性,对那些只是用来做酶的性质比较的实验,可以用其替代需要购买的比较昂贵的木聚糖。
2.4试验结果
对比用sigma的桦树木聚糖和自提玉米芯木聚糖检测DSM10635木聚糖酶的最佳酶促反应温度的试验,见图1。
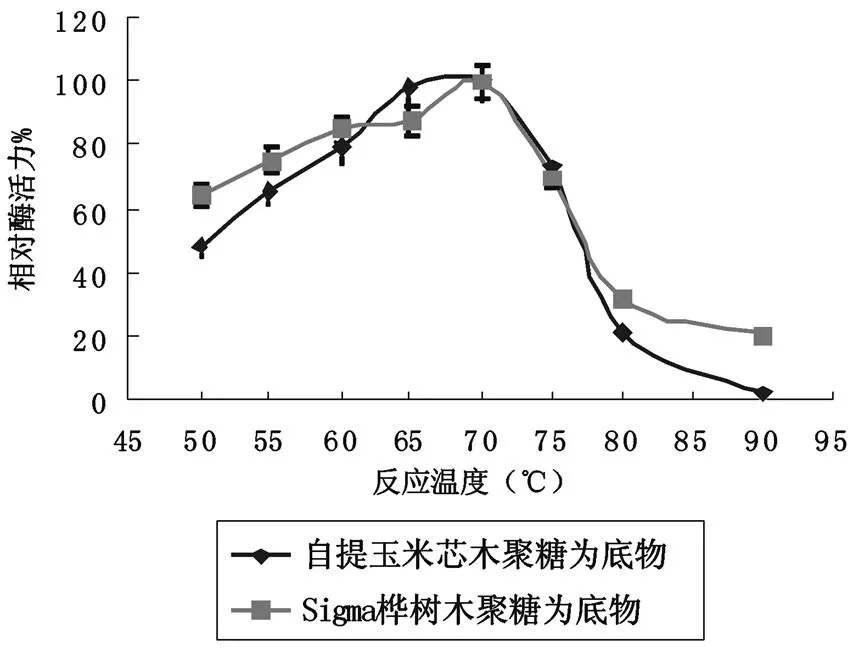
图1 以自提玉米芯木聚糖和sigma桦树木聚糖为底物的DSM10635木聚糖酶的最佳酶促反应温度图
从图1可以看出自提玉米芯木聚糖对于DSM10635木聚糖酶的最佳酶促反应温度和桦树木聚糖的是一致的,在65-70℃左右,而且两条曲线的趋势基本是一致的,更进一步说明了自提木聚糖是具有可替代性的,可以替代昂贵的sigma桦树木聚糖作为检测木聚糖酶的基本性质的木聚糖底物。
[1] Ebringerova.A., Heinze, T. Xylan and xylan derivatives-biopolymers with valuable properties, 1.Naturally occuring xylans; Structures isolation, procedures and propcrties[J]. Macromolecular Rapid Cpmmunications, 2000, 542-556.
[2] Beg,Q.,K.,Kapuora,M.,Mahajan,L.,eta1.Microbial xylanases and their industrial applications[J]. A review.Appl.Microbiol. Biotechnol., 2001,56:326-338.
[3] Singh,S.,Madlala,A.M.Prior,B.A.Thermomyces lanuginosus:properties of strains and their hemicellulases [J]. FEMS Microbiol. Rev.,2003,27:3-16.
[4] Li.K.,Azadi,P.,Collins,R,et a1.Relationships between activities of xylanases and xylan structures[J]. Enzyme Microb Technol., 2000,27:89-94.
[5] Kulkami,N.,Shendye,A.,M.Molecularand biotechnological aspects of xylanases [J]. FEMS Microbiol Rev.,1999,23:411-456.
[6] 邵佩兰,徐明,李海峰,等.碱法提取玉米芯木聚糖的研究[J].宁夏农学院学报, 2000, 21(4):47-49.
[7] 杨瑞金,许时婴,王璋.用于低聚木糖生产的玉米芯 木聚糖的蒸煮法提取[J]. 无锡轻工大学学报,1998,17(4):50-53.
[8] Heinze,T.,Koschella,A.,& Ebringerov,A.Chemical functionalization of xylan: A short review[M]. In P.Gatenholm & M.Tenkanen (Eds.),Hemicelluloses:Science and technology,ACS Symposium Series,2004,864:312-325.
[9] Lindblad,M.S.,&Albertsson.,A.-C.Chemical modification of hemicelluloses and gums[M]. In S.Dumitriu (Ed.), Polysaccharides: Structural diversity and functional versatility (2nd ed.,pp.491–508).New York,Basel,Hong Kong:Marcel Dekker.
[10]Ebringerova,A.Structural diversty and application potential of hemicelluloses[J]. Macromolecular Symposia,2006,232:1-12.
[11]Ebringerove A,Hromadkova Z,Hribalova V.Structureand mitogenic activity of corn cob heteroxylans[J].Int J Biol. Macromo, 1995,17:327-331.
[12]Ebringerove A,Hromadkova Z,Hribalova V.Effect of ultrasound on the immunogenic corn cob xylan[J].Ul- trasonic Sonochemistry, 1997,(4):311-315.
Experimental Study on Production of Xylan from Corncob
ZHAO Ling-xi, GUO Ren-jie, XIONG Hai-rong
(College of Life Science,South-central University for Nationalities, Wuhan Hubei 430074, China)
In this study xylan was obtained from corncob by base-hydrolysis,30% hydrogenperoxide and 10% trichloroacetic acid and the extraction rate was 24.4%.Comparing with the Michaelis constant of the same xylanase produced by Thermomyces lanuginosus DSM10635,which separately used three different kinds of xylan and xylan extracted by us as substrates, Km 7.5303 of xylan extracted by us is similar with Km 5.6044 of oak xylan.Then comparing with the optimatemparature of DSM10635 xylanase which used brich xylan and the extacted-xylan as substrates,the optimal temperature was about 65-70℃.This induced that it can substitute for brich xylan.The method of extraction was simple and the high yield have the significance to the mass-produce of xylan in industry.
Corncob; Xylan; Xylanase Production
Q814
A
1009-5160(2012)03-0060-03
熊海容(1966-),男,博士,教授,研究方向:生物工艺学.

