2-氯苯酚与取代苯酚及苯胺类化合物对鲫鱼联合毒性效应的定量构效关系
李志华,朱正丽,陆光华,赵海洲
(1.河海大学浅水湖泊综合治理与资源开发教育部重点实验室,江苏南京 210098;2.河海大学环境学院,江苏 南京 210098;3.中国人民解放军4812工厂,安徽 安庆 246001)
苯胺类化合物广泛应用于生产聚氨酯、橡胶、化妆品、染料和农药等[1].取代苯酚类化合物被较多地用作农药、除草剂、染料和杀虫剂等.其中,2-氯苯酚是一种重要的工业原材料,主要用于染料和有机合成[2].这些化合物不易降解[3],进入水体后对水生生物的生长、发育和繁殖构成了一定的危害[4],同时破坏了水生生态系统,对人体健康有潜在的危害.
越来越多的污染物,尤其是人工合成的有机污染物通过各种途径进入水体且并存于环境中,将引起与各种污染物单独作用时完全不同的毒性效应,只用单一毒物的含量去判断水体污染后的毒性危害无法真实反映环境质量要求,还应从联合毒性的角度对水质污染做出综合评价.研究化合物在联合体系中的交互作用与毒性效应,对制定环境化学物质的卫生标准、探讨其毒性作用机理和采取防治对策等具有重要的意义.近年来,对于联合毒性效应及其定量构效关系的研究也逐渐开展[5-8].笔者测定了2-氯苯酚与其他取代苯酚及苯胺类混合物对鲫鱼的联合毒性效应,采用毒性单位法、相加指数法和混合毒性指数法对化合物的联合毒性效应进行了定性评价,并建立了联合毒性效应的定量构效关系(QSAR)模型,对联合毒性效应进行了定量预测.
1 实验材料与研究方法
1.1 受试生物与化合物
受试生物采用鲫鱼(Carassius auratus),属鲤科,购自南京市胜利圩养殖场.幼鱼买来后,经5%食盐水消毒,选取健康个体,在实验室中驯养7d以上.实验用鱼体长(13±0.2)cm,体质量(35±0.5)g.
10种取代苯酚及苯胺类化合物购自上海化学试剂公司(分析纯).
1.2 单一毒性的测定
养鱼用水为曝气除氯3d后的自来水,总硬度为50~250mg/L(以碳酸钙计),pH为6.5~7.5,溶解氧为(5.0±0.5)mg/L,水温为(20±2)℃.采用自然光照.驯养期间鱼的死亡率低于1%.实验前每2d换1次水.隔天喂食1次,每天投喂2~3次的投喂率约为体质量的3%,实验前一天禁食.
将受试化合物溶解在95%的乙醇溶液中,作为储备液.采用每天更换1/2实验液的半静水式实验方式进行暴露实验.根据受试化合物预实验结果,按浓度的等对数间距设置5个浓度梯度,每个浓度梯度暴露10条鲫鱼,设置空白对照,每个浓度梯度设2个平行,周期96h,每24h记录1次鱼体死亡率.死亡的鱼体立即移出容器,以免影响水质.
1.3 联合毒性效应的测定
在获得化合物单一毒性数据的基础上,根据公式(1)计算混合物的毒性单位值之和M,以此为基础设置混合物暴露的浓度梯度:

式中:UTi——混合物中组分 i的毒性单位;Ci——混合物中组分 i的质量浓度;CL50i——组分 i对鲫鱼的半致死浓度.
2-氯苯酚与其他化合物按照等毒性配比组成二元及多元混合物.同时还研究了2-氯苯酚与2-氯苯胺按照不同配比(1∶3,1∶1,3∶1)组成的二元混合物的联合毒性.联合毒性的实验方法与单一毒性实验相同.
1.4 联合毒性的评价
2种或多种化学物质同时作用于生物体时,往往会引起与单一毒物作用完全不同的毒性反应,然而由于联合毒性的复杂性,其研究进展较为缓慢.本文采用毒性单位法、相加指数法和混合毒性指数法对12组混合物的联合毒性效应进行评价.
a.毒性单位法[9]:对于一个 n组分的混合物来说,按照公式M0=M/(UTi)max及公式(1)计算得M0和M,式中(UTi)max为混合物中各组分毒性单位的最大值.当M=1时,联合效应为简单相加作用;当1<M<M0时为部分相加作用;M<1时,联合效应为协同作用;M=M0时为独立作用;当M>M 0时为拮抗作用.
b.相加指数法[10]:相加指数法的评价指数(IA)定义为IA=M-1(M=1时);IA=1/M-1(M<1时);IA=-M+1(M>1时).当IA<0时,联合效应为拮抗作用,IA=0时为简单相加作用,IA>0时为协同作用.
c.混合毒性指数法[11]:混合毒性指数IMT=1-lg M/lg M0.当IMT<0时,联合效应为拮抗作用;IMT=0时为独立作用;0<IMT<1时为部分相加作用;IMT=1时,联合效应为简单相加作用;IMT>1时为协同作用.
1.5 结构参数及统计分析
本文中10种单一化合物的辛醇/水分配系数的对数值(lg P)从Biobyte软件(ver.355,Biobyte company,Claremont,CA,USA)中查得,见表1.使用ChemOffice 2004软件中MOPAC法对化合物分子进行量能最小化及结构最优化处理,计算了分子最低空轨道能E LUMO(eV)、分子最高占有轨道能E HOMO(eV)以及前沿轨道能距ΔE(eV).化合物的参数值见表1.使用SPSS17.0(Ver.17.0 SPSSCompany,USA)统计软件对实验数据进行线性回归分析.
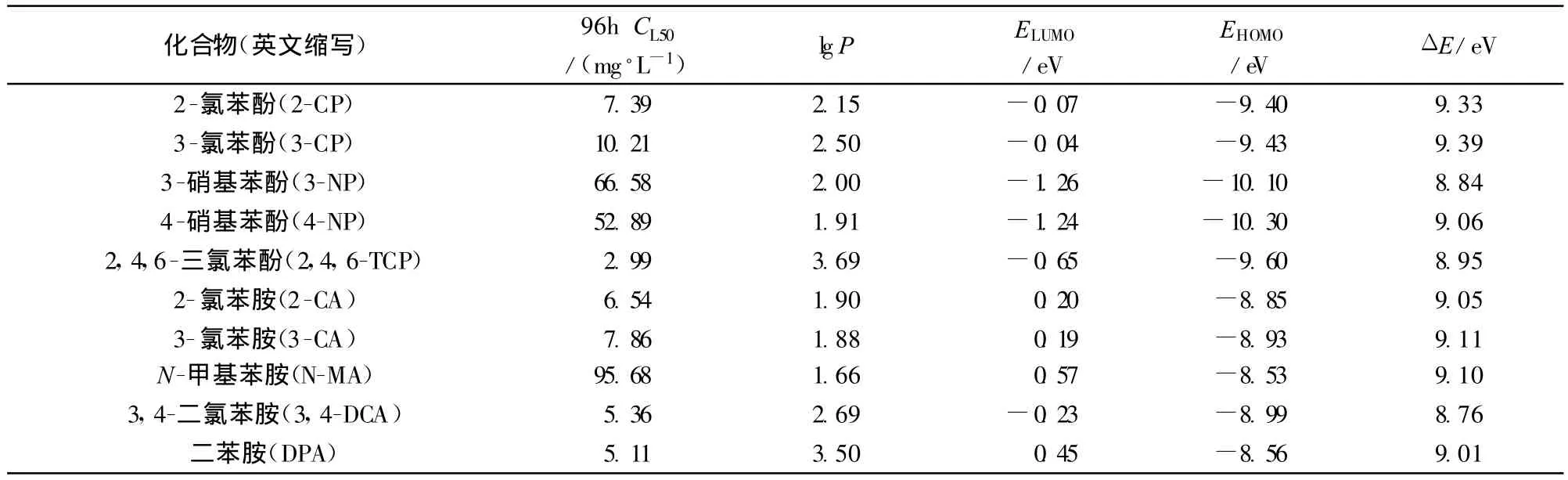
表1 取代苯酚及苯胺类化合物对鲫鱼的单一毒性数据及结构参数Table 1 Single toxicity to Carassius auratus and structural parameters of substituted phenols and anilines
2 结果与讨论
2.1 单一化合物对鲫鱼的急性毒性
化合物对鲫鱼96h单一毒性数据见表1.5种酚类的毒性从高到低的顺序为:2,4,6-TCP,2-CP,3-CP,4-NP,3-NP,5种胺类的毒性从高到低的顺序为:DPA,3,4-DCA,2-CA,3-CA,N-MA.同种类化合物中具有相同取代基,在相同实验条件下,毒性高低顺序为:2-CP,3-CP,4-NP,3-NP,2-CA,3-CA,在10种化合物中,可以看出2,4,6-TCP毒性高于2-CP和3-CP,3,4-DCA毒性高于2-CA和3-CA.由毒性高低比较可知,同种化合物相同取代基团在邻位和对位时的毒性比在间位的毒性要高,并随着相同取代基团数目的增加毒性也随之增加.
2.2 2-氯苯酚与其他化合物的联合毒性及其评价
本文采用毒性单位法、相加指数法和混合毒性指数法对联合毒性作用方式进行评价.用相加指数法评价联合毒性时,发现2-CP+2-CA等几组的评价指数(IA)在-0.09~0.06之间,由于IA=0是一种理想的相加作用,而实验中存在误差,即使是相加作用也很难得到 IA=0的结果,所以认为联合作用为部分相加[12].混合物的联合毒性效应及毒性评价结果见表2.

表2 混合物的联合毒性数据及毒性评价结果Table2 Assessment of joint toxicity to Carassius auratus of mixtures
可见,毒性单位法和混合指数法评价取代苯酚与苯胺类混合物等毒性联合时结果较一致,等毒性联合主要表现为部分相加或协同作用,这表明,等毒性二元联合时混合物的毒性都不同程度地增加,可能是因为混合物组分中均含有2-氯苯酚,其组分中化合物的结构都具有一定的相似性,这与杨永滨等[13-14]所得结果相同.毒性单位法和相加指数法评价二元不等毒性的联合作用时结果较一致,二元不等毒性联合作用时结果主要表现为拮抗作用,可能是因为混合物组分的毒性不同,并随着毒性配比的不同,其毒性随之改变,互相有不同程度的抑制作用.
2.3 联合毒性的QSAR研究
根据独立作用的假设,即混合物的分配作用是各组分分配作用的加和,而忽略组分间的相互作用,Lu等[15]采用方程(2)预测了混合物的辛醇/水分配系数的对数(lg Pmix),并依据方程(2)类似地计算了混合物的前沿轨道能距 ΔEmix.

式中:lg Pa,lg Pb,lg Pi——混合物中组分 a,b和i的辛醇/水分配系数的对数;Ca,Cb,Ci——组分 a,b和i在混合物中的质量浓度.
笔者根据式(2)计算了12组混合物的lg Pmix和ΔEmix,结果见表3.

表3 混合物的联合毒性及结构参数Table 3 Joint toxicity to Carassius auratus and structural parameters of mixtures
曾鸣等[16]测定了以卤代苯为代表的非极性麻醉型混合物对湛江叉鞭金藻的联合毒性效应,建立了基于混合物疏水性参数lg Pmix的QSAR模型:

Lu等[17]测定了27种酚类和胺类混合物对藻类的48h半数有效抑制浓度(CE50mix),以混合物的疏水性参数lg Pmix和电性参数ΔEmix为结构描述符,建立了双变量QSAR模型:

Wang等[18]测定了酚类和苯胺类混合物对斜生栅藻的半数有效抑制浓度(CE50mix),建立了基于混合物疏水性参数lg Pmix和电性参数ΔEmix的QSAR模型:

本文以混合物的lg Pmix和ΔEmix为描述符,建立了2-氯苯酚与取代苯酚、苯胺类混合物对鲫鱼联合毒性的QSAR模型:
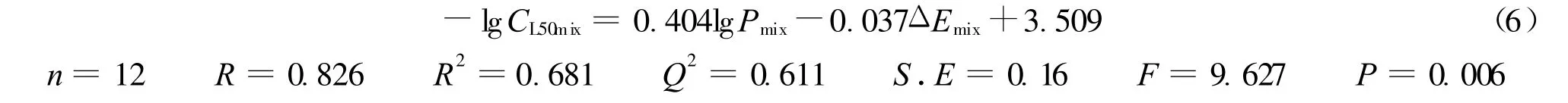
式中:n——用于建模的混合物数目;R2——复相关系数;Q2——交互式验证的相关系数;S.E——标准误差;F——方差比;P——显著性水平.
为检验模型的共线性,按式(7)计算了变异膨胀因子(VIF):

VIF在1~5之间表示相关方程可以接受.方程(6)的VIF为3.1,表明方程(6)是可以接受的.该模型具有较为显著的相关性,较小的估测误差以及较好的预测能力(Q2=0.611).-lg CL50mix与分子结构描述符lg Pmix呈正相关,与 ΔEmix呈负相关.从表3可见残差最大的是0.28,占实测毒性的6.5%.由于Q2只有0.611,表明模型对未测试混合物的毒性预测能力不太理想.这可能是由于联合样本比较复杂,既含有二元联合混合物,又含有三元混合物,同时二元联合混合物还设定了不同毒性配比.为提高模型的预测能力可以考虑增加不同化合物不同浓度暴露下联合毒性的样本数量,同时添加预测模型的验证基.
本文建立的QSAR模型表明,2-氯苯酚与取代苯酚及苯胺类混合物对鲫鱼的联合毒性效应主要与混合物的疏水性参数和电性参数有关.-lg CL50mix与lg Pmix呈正相关,表明混合物的脂溶性越强,化合物分子越容易透过细胞膜分配到生物体内,因而毒性越强.ΔE是表示分子相对硬度的指数,常作为确定芳香系统稳定性的标准.化合物的ΔE值高表明其分子的稳定性好,反应性差;相反,ΔE值越低,表明电子从最高占有轨道迁移所需的能量越少,因此分子的反应性越强.而-lg C L50mix与ΔE mix呈负相关,表明前沿轨道能距越小,电子越容易从最高占有轨道能跃迁到最低空轨道,混合物的反应性越强,毒性越大,这与Lu等[15,17]和Yan等[19]的研究结果相一致.
3 结 论
a.笔者测定了取代芳烃混合物对鲫鱼的联合毒性效应,采用毒性单位法、相加指数法和混合指数法评价联合毒性的作用类型.2-氯苯酚与取代苯酚、苯胺类化合物等毒性联合作用时毒性单位法和混合指数法的评价结果比较一致,联合后主要表现为部分相加和协同作用.2-氯苯酚与2-氯苯胺不等毒性联合时毒性单位法和相加指数法评价结果较一致,联合后表现为拮抗作用.
b.以混合物的疏水性和亲电性为结构描述符,建立了联合毒性效应的定量构效关系(QSAR)模型.所得模型能较好地预测2-氯苯酚与取代苯酚及苯胺类混合物的联合毒性,对取代苯酚和苯胺类二元及三元混合物的联合毒性有一定的预测能力.
[1]DOM N,KNAPEN D,BENOOT D,et al.Aquatic multi-species acute toxicity of(chlorinated)anilines:experimental versus predicted data[J].Chemosphere,2010,81(2):177-186.
[2]GULAY B,IHSANG,YAGMURT,et al.Biosorption of phenol and 2-chlorophenol by Funaliatrogii pellets[J].Bioresource Technology,2009,100(10):2685-2691.
[3]BAJAJM,GALLERT C,WINTERJ,et al.Anaerobic biodegradation of high strength 2-chlorophenol-containing synthetic wastewater in a fixed bed reactor[J].Chemosphere,2008,73(5):705-710.
[4]LUO Yi,SUI Yun-xia,WANG Xiao-rong,et al.2-chlorophenol induced hydroxyl radical production in mitochondria in Carassius auratus and oxidative stress:an electron paramagnetic resonance study[J].Chemosphere,2008,71(7):1260-1268.
[5]黄伟英,陈鸿汉,刘菲.低浓度下4个取代苯污染物与硝酸铅的混合对发光菌的联合毒性[J].生态环境学报,2010,19(1):57-62.(HUANG Wei-ying,CHENHong-han,LIUFei.Combined toxicity of four substituted benzene pollutants and lead nitrate at low concentrations on photobacteria[J].Ecology and Environmental Sciences,2010,19(1):57-62.(in Chinese))
[6]LU Guang-hua,WANG Chao,GUO Xiao-ling.Prediction of toxicity of phenols and anilines to algae by quantitative structure-activity relationship[J].Biomedical and Environmental Sciences,2008,21(3):193-196.
[7]陆光华,吴昊,陈志永,等.3,4-二氯苯胺与取代芳烃联合毒性的定量构效关系研究[J].环境科学,2009,30(10):3104-3109.(LU Guang-hua,WU Hao,CHEN Zhi-yong,et al.Quantitative structure-activity relationships of Joint toxicity of 3,4-dichloroaniline and substituted aromatics[J].Environmental Science,2009,30(10):3104-3109.(in Chinese))
[8]CHENJing-wen,LI Xue-hua,YU Hai-ying,et al.Progress and perspectives of quantitative structure-activity relationships used for ecological risk assessment of toxic organic compounds[J].Science in China:Series B,Chemistry,2008,51(7):593-606.
[9]HODGESG,ROBERTSD W,MARSHALL S J,et al.Defining the toxic mode of action of ester sulphonates using the joint toxicity of mixtures[J].Chemosphere,2006,64(1):17-25.
[10]MARKING L L.Method for assessing additive toxicity of chemical mixtures[J].Aquatic Toxicology and Hazard Evaluation,1977,634:99-108.
[11]KÖNEMANNH.Fish toxicity tests with mixtures of more than two chemicals:a proposal for a quantitative approach and experimental results[J].Toxicology,1981,19:229-238.
[12]邓铁柱,苏丽敏,袁星,等.乙草胺与Cu,Zn对发光菌和斑马鱼胚胎的联合毒性效应[J].环境化学,2007,26(6):741-744.(DENGTie-zhu,SU Li-min,YUAN Xing,et al.Joint toxicity of acetochlor and Cu,Zn to photobac terium phosphoreum and zebrafish(b.rerio)embryos[J].Environmental Chemistry,2007,26(6):741-744.(in Chinese))
[13]杨永滨,刘征涛,郑明辉,等.卤代酚对斑马鱼的急性联合毒性效应研究[J].环境科学研究,2007,20(2):5-8.(YANG Yongbin,LIUZheng-tao,ZHENG Ming-hui,et al.Study on the effects of joint acute toxicities of halophenols in zebrafish[J].Research of Environmental Sciences,2007,20(2):5-8.(in Chinese))
[14]杨霓云,刘征涛,王宏,等.五氯苯酚与邻氯苯酚和2,4-二氯苯酚对斑马鱼的联合毒性[J].环境科学研究,2006,19(6):145-148.(YANG Ni-yun,LIU Zheng-tao,WANG Hong,et al.Joint toxicity effects of PCP,2-CP and 2,4-DCP to zebrafish[J].Research of Environmental Sciences,2006,19(6):145-148.(in Chinese))
[15]LU Guang-hua,WANG Chao,WANG Pei-fang,et al.Predicting toxicity of aromatic ternary mixtures to algae[J].Chinese Science Bulletin,2009,54:3521-3527.
[16]曾鸣,林志芬,尹大强,等.卤代苯对湛江叉鞭金藻联合毒性的QSAR研究[J].环境科学与技术,2008,31(10):1-4.(ZENG Ming,LING Zhi-fen,YING Da,et al.QSAR for predict ion of joint toxicity of halogenated benzenes to dicrateria zhanjiangensis[J].Environmental Science&Technology,2008,31(10):1-4.(in Chinese))
[17]LUGuang-hua,WANG Chao,TANG Zhu-yun.Joint toxicity of aromatic compounds to algae and QSAR study[J].Ecotoxicology,2007,16:485-490.
[18]WANG Chao,LU Guang-hua,TANG Zhu-yun,et al.Quantitative structure-activity relationships for joint toxicity of substituted phenols and anilines to Scenedesmus obliquus[J].Journal of Environmental Sciences,2008,20:115-119.
[19]YAN Xiu-fen,XIAO He-min,GONG Xue-dong,et al.A comparison of semiempirical and first principle methods for establishing toxicological QSARs of nitroaromatics[J].Journal of Molecular Structure(Theochem),2006,764:141-148.

