镁离子浓度对氧化亚铁硫杆菌生长动力学的影响
刘欣伟,冯雅丽,李浩然,蔡震雷,杨志超
(1. 北京科技大学 土木与环境工程学院, 北京 100083;2. 中国科学院 过程工程研究所生化工程国家重点实验室,北京 100190)
镁离子浓度对氧化亚铁硫杆菌生长动力学的影响
刘欣伟1,冯雅丽1,李浩然2,蔡震雷1,杨志超1
(1. 北京科技大学 土木与环境工程学院, 北京 100083;2. 中国科学院 过程工程研究所生化工程国家重点实验室,北京 100190)
在氧化亚铁硫杆菌(T. f)培养过程中其他营养物质足量的情况下,通过考察不同初始Mg2+浓度对氧化亚铁硫杆菌(T. f)生长活性的影响,得到在不同Mg2+浓度下细菌的生长曲线。结果表明:T. f对Mg2+具有一定的耐受能力;当培养基中ρ(Mg2+)≤10 g/L时,Mg2+对细菌生长活性影响很小;其ρ(Mg2+)为15 g/L时,Mg2+开始产生延迟效应,抑制细菌生长;ρ(Mg2+)为20 g/L时,细菌生长完全受到抑制。同时利用基于存在非竞争性抑制的Monod方程,建立了T. f在高Mg2+浓度下的生长动力学方程模型,确定在不同条件下细菌生长动力学参数,包括最大比生长速率μmax、Monod常数Km及镁离子抑制常数KI。利用correl系数工具分析细菌比生长速率的实验值和模拟值之间的相关系数为 0.973,表明该动力学方程能较好地描述Mg2+浓度对氧化亚铁硫杆菌生长的影响。
氧化亚铁硫杆菌;生长动力学;非竞争性抑制;比生长速率
Abstract:When the other nutrients were sufficient in the culture ofThiobacillus ferrooxidans, the impact of the different initial Mg2+concentration on the activity of the growth ofThiobacillus ferrooxidanswas studied, and the bacterial growth curves were obtained at different magnesium ion concentrations. The results of the experiment show thatThiobacillus ferrooxidansis tolerant to Mg2+some extent. No bad effect on the growth and activity ofThiobacillus ferrooxidansby Mg2+is brought when cultured in 9K medium containingρ(Mg2+)≤10 g/L. The growth and activity ofThiobacillus ferrooxidansare obviously influenced by Mg2+whenρ(Mg2+) is 15 g/L. When the concentration of Mg2+is around 20 g/L,the growth and activity ofThiobacillus ferrooxidansare completely inhibited. Simultaneously the kinetic model for the growth ofThiobacillus ferrooxidansat high magnesium ion concentrations is deduced on the basis of the non-competitive inhibition of the Monod equation. The values of kinetic parameters (i.e. maximum growth rateμmax, Monod constantKmand magnesium ion inhibition constantKI) under different initial experiment conditions are determined. The correlation coefficient between the simulated and experiment specific growth rates is 0.973, which shows that the kinetics equation can well describe the effect of magnesium ion concentration on the growth ofThiobacillus ferrooxidans.
Key words:Thiobacillus ferrooxidans; growth kinetics; non-competitive inhibition; specific growth rate
随着高品位镍矿资源的减少, 低品位镍矿资源目前进入开发回收阶段[1]。从低品位矿中回收镍是我国保证镍资源供应的基础保证[2−3]。我国金川公司(JNMC)拥有约400 Mt低品位硫化镍矿,平均镍品位为 0.60%,是典型的高镁型低品位硫化镍矿。由于高昂的成本和日趋严紧的环保要求,采用处理富矿的生产工艺处理这些贫矿是不可行的。本文作者针对金川高镁型低品位硫化镍矿的氧化亚铁硫杆菌(T. f)浸出工艺进行研究,由于该矿的主要脉石矿物为含镁高的蛇纹石及绿泥石,在细菌浸出过程中部分Mg2+进入溶液中。Mg2+对于细菌生长是必需的,但是当Mg2+超过细菌生长耐受范围时,过高的渗透压会导致细菌死亡。Mg2+对T. f生长活性的影响,国内外已有文献报道[4−6],但从动力学[7−10]方面考察Mg2+浓度对T. f生长动力学的影响尚未见文献报道。
在此,本文作者旨在通过监测高Mg2+浓度培养条件下的T. f菌生长过程,利用存在非竞争性抑制的Monod模型[11],得到高镁浓度培养条件下的T. f菌生长动力学方程,以期对利用T. f浸出高镁型低品位硫化镍矿的生产实践起到一定的指导作用。
1 实验
1.1 培养条件
实验用菌种氧化亚铁硫杆菌(T. f),实验室保藏。在高镁离子浓度下经驯化后,用于实验。
培养基为9K培养基,Mg2+采用MgSO4·7H2O(化学纯)配置,培养温度为30~32 ℃,培养时间为120 h,接种浓度为1×107/mL,接种量为10%,显微镜记数。
培养方式如下:在250 mL锥形瓶中装入按上述条件配置的100 mL培养液,置于SZX−B型恒温水浴振荡摇床内,用DZS−707型多参数分析仪测定溶液氧化还原电位(φ),定期补加蒸馏水弥补损耗的水分。
1.2 不同 Mg2+浓度下氧化亚铁硫杆菌生长曲线的测定
测定细菌的生长曲线对掌握高镁离子浓度下细菌生长规律很重要。实验将转代培养后的细菌分别接入初始ρ(Mg2+)=0.004 9~20 g/L、初始pH=1.8的培养基中,菌种浓度为1×107/mL,接种量为10%。定期测定培养基中的细菌数、亚铁离子浓度ρ(Fe2+)及三价铁离子浓度ρ(Fe3+)。
1.3 主要仪器及分析方法
主要仪器如下:722型光栅分光光度计;pHS−29A型酸度计;DZS−707型多参数分析仪;SZX−B型恒温水浴振荡摇床;XS−18电子显微镜。
分析方法如下:Fe2+和总铁分析采用邻菲啰啉分光光度法测定,Fe3+的量由总铁和Fe2+的量之差确定;细菌活体数采用血球计数法测定;溶液的氧化还原电位用DZS−707型多参数分析仪测定。
1.4 生长动力学模型
综合氧化亚铁硫杆菌的生长动力学模型,本文作者选择一种存在非竞争性抑制的 Monod方程[11]。该方程表达形式简单,有利于工业应用,其公式如下:


2 实验结果与讨论
2.1 氧化亚铁硫杆菌生长过程中代谢变化
通过改变培养基中Mg2+浓度(0.004 9 g/L(基础培养基),5,10,15和20 g/L),对T. f菌生长过程的代谢变化进行研究,得到细胞浓度,亚铁浓度ρ(Fe2+)及三价铁浓度ρ(Fe3+)随时间的变化曲线如图1所示。
研究结果表明,适当增加培养基中Mg2+含量有利于细菌生长;当ρ(Mg2+)≤10 g/L时,Mg2+对细菌生长活性影响很小,不影响细菌的生长繁殖;但当溶液中Mg2+浓度升至15 g/L时,开始产生延迟效应,抑制细菌生长;当溶液中Mg2+浓度升至20 g/L时,细菌的生长繁殖完全停止,菌体开始死亡。MgSO4是细菌培养基的主要成分,它对细菌细胞的结构如核糖体、细胞膜等的稳定性起重要作用。但随着 Mg2+质量浓度的升高,体系的渗透压增大,会影响细菌正常的生理功能。细菌调节体内Mg2+浓度的能力是有限的,因此,Mg2+浓度过高会造成细菌生长停滞甚至死亡。在已有文献所得T. f菌的生长动力学方程中,普遍认同金属离子对T. f菌生长的非竞争性抑制[12−13],在本实验中以此为基础建立动力学方程。
2.2 不同Mg2+浓度对溶液氧化还原电位(φ)的影响
试验在Mg2+浓度为0.004 9~20 g/L范围内考察了溶液氧化还原电位φ的变化情况,结果如图2所示。
细菌生长过程中,溶液中主要发生的反应如下:
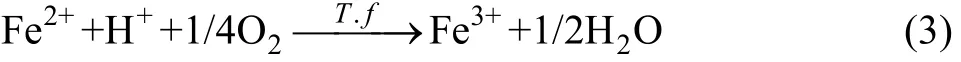
根据能斯特方程和反应式中各物质的热力学数据,计算溶液中的氧化还原电位如式(4)
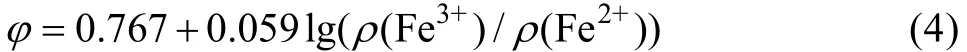
式(4)表明随着T. f菌将溶液中的Fe2+氧化为Fe3+,Fe3+浓度增加,ρ(Fe3+)/ρ(Fe2+)比值增加,导致溶液氧化还原电位φ上升。由图2可知,当ρ(Mg2+)≤10 g/L时,溶液中最大氧化还原电位φ基本不变,为610 mV,表明细菌活性受 Mg2+影响很小,菌体生长旺盛;当Mg2+浓度从10 g/L增加到20 g/L时,溶液中最大氧化还原电位φ由610 mV降低至392 mV,这也可由图1结果得到解释,随着Mg2+浓度增加,抑制了T. f菌的生长,导致对铁的氧化能力降低,溶液中ρ(Fe3+)/ρ(Fe2+)
比值随Mg2+浓度的增加而降低,根据式(4)进行计算,φ值减小,实验结果与此相符。
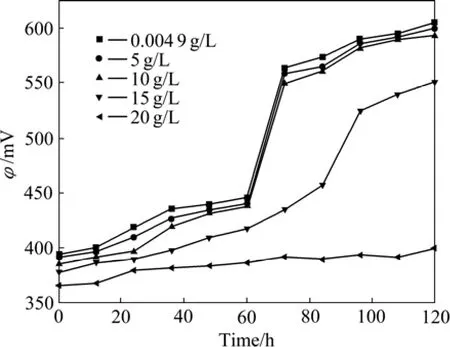
图2 Mg2+浓度对培养液氧化还原电位的影响Fig.2 Impact of Mg2+concentration on culture solution redox potential
2.3T. f菌生长动力学参数的确定
为确定不同 Mg2+浓度下细菌生长的最大比生长速率μmax、Monod饱和常数KM、Mg2+抑制常数KI的值,参考 GABRIEL[14]和 LIU[15]求解动力学方程的方法进行了相关参数的求解。
细菌比生长速率μ利用两点法[16]求解,其满足如下方程:

式中:X为溶液中细胞的数目;t为时间。
实验采用等间隔取点分析,综合式(5)可简化为
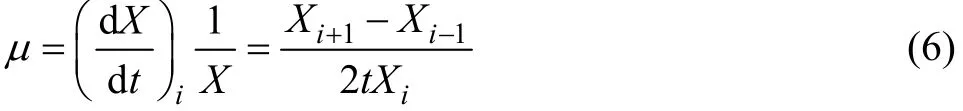
动力学模型(2)可变形为
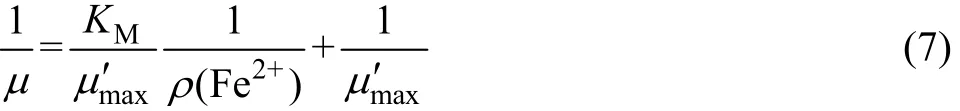
不同Mg2+浓度下T. f菌比生长速率和动力学参数的求解曲线如图3所示。
通过1/μ−1/ρ(Fe2+)作图,曲线y截距为1/μ′max,x截距为−1/KM,从而求得μ′max、KM。从曲线求解所得动力学模型(2)中细菌生长的动力学参数值见表1。
在T. f菌最常用的9K培养基中,MgSO4是不可缺少的主要成分之一,一般含Mg2+0.005 g/L左右,
因此可认为μmax=μ′max=0.192 h−1。
(1)的各动力学参数如表2。

表1 细菌生长动力学参数值Table 1 Kinetic parameters for growth of bacterium
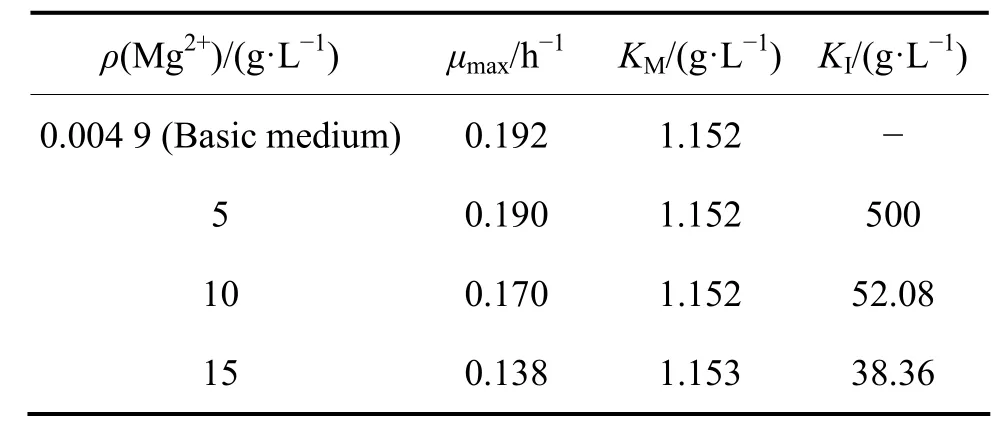
表2 氧化亚铁硫杆菌生长动力学参数Table 2 Kinetic parameters for growth of Thiobacillus ferrooxidans
图3中各曲线的相关性较好,R2都大于0.97,证明所得动力学参数较好地符合了实验结果。由表2可知,KM值基本不变,这与抑制剂对酶催化反应速率的非竞争性抑制中KM值保持恒定的结论相符[11]。而KI和μmax均有不同程度的变化,这一结果与实验选择的高Mg2+浓度条件有关。KI值的大小表示细菌对Mg2+的吸收亲和力的大小,随着Mg2+浓度的增加,细菌对Mg2+的亲和力增大,导致Mg2+的非竞争性抑制作用也相应增加,KI值减小。μmax表示T. f菌的最大比生长速率,随着Mg2+浓度的增加,Mg2+逐渐与酶活性中心以外的基团结合,故Mg2+与底物Fe2+两者没有竞争作用,但是由于Mg2+的结合可导致酶活性中心的结构发生改变(见图 4),消弱了底物 Fe2+和酶活性中心的结合,导致最大反应速率μmax的减小。
Mg2+浓度越高,形成不能转化为产物的EI或IES越多,KI值越小,μmax降低的程度也越显著,非竞争性抑制的反应机理可用式(8)表示。由于μmax降低,酶的反应速率也相应减小。非竞争性抑制作用的强弱取决于抑制物的绝对浓度,因而不能用增大底物浓度的办法来消除此种抑制作用。
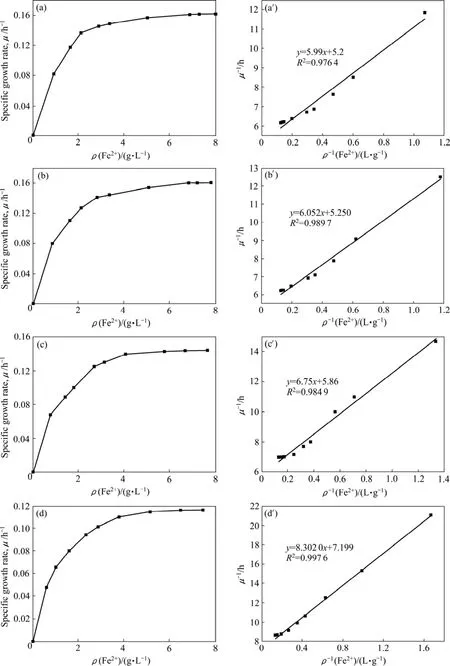
图3 不同Mg2+浓度下T. f菌的比生长速率和动力学求解曲线Fig.3 Specific growth rate of T. f ((a),(b), (c), (d)) and dynamic processing curves ((a′), (b′), (c′), (d′)) at different Mg2+concentrations: (a), (a′) 0.004 9 g/L (basic medium); (b), (b′) 5 g/L; (c), (c′) 10 g/L; (d), (d′) 15 g/L
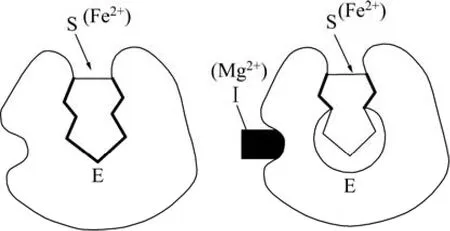
图4 非竞争性抑制示意图Fig.4 Schematic diagram of non-competitive inhibition

为了描述镁离子浓度对氧化亚铁硫杆菌生长动力学的影响,在动力学模型中引入初始镁离子浓度项ρ0和初始饱和常数KI0,动力学方程(1)可变形为
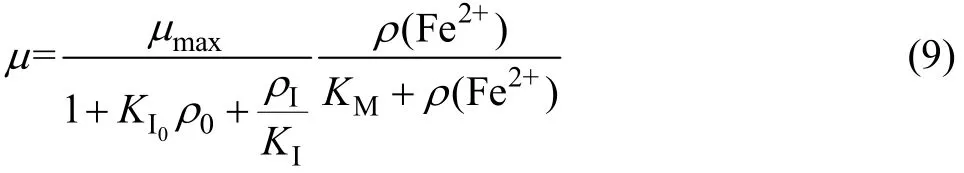
根据上述实验数据,通过对μmax与KI的试差,得到氧化亚铁硫杆菌在Mg2+浓度为0~15 g/L范围内的生长动力学方程,如式(10)所示:
利用correl系数工具分析理论值与实验室的相关系数为0.973,见图5。该值表明以上动力学方程能较好地描述镁离子浓度对氧化亚铁硫杆菌生长的影响。
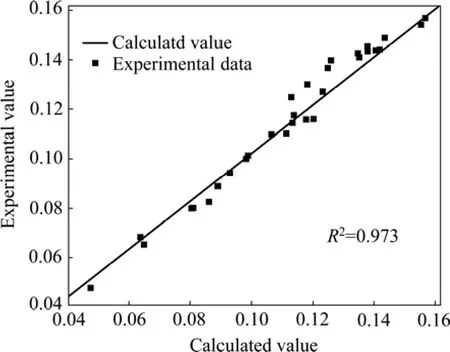
图5 比生长速率实验室与模拟值的比较Fig.5 Comparison of laboratory and simulated values about specific growth rate
3 结论
1) 考察了在不同 Mg2+浓度下,氧化亚铁硫杆菌的细菌浓度、ρ(Fe2+)、ρ(Fe3+)和溶液氧化还原电位φ随时间的变化,结果表明氧化亚铁硫杆菌(T. f)对Mg2+具有一定的耐受能力;当培养基中ρ(Mg2+)≤10 g/L时,Mg2+对细菌的生长活性影响很小;ρ(Mg2+)为 15 g/L时,开始产生延迟效应,抑制细菌生长;ρ(Mg2+)为20 g/L时,细菌生长完全受到抑制,并且随着Mg2+浓度的增加,溶液氧化还原电位φ逐渐减小。
2) 利用基于存在非竞争性抑制的 Monod方程,建立了T. f菌在高镁浓度下的生长动力学方程模型,得到了4个Mg2+浓度下细菌生长的动力学参数值,结果表明,随着Mg2+浓度的增加,非竞争性抑制作用增加,消弱了底物Fe2+与酶活性中心的结合,KI和μmax逐渐减小,这也说明在一定Mg2+浓度下,氧化亚铁硫杆菌才能正常生长。
3) 对实验数据进行数学推导,得出该菌种在Mg2+浓度为0~15 g/L范围内的生长动力学方程:
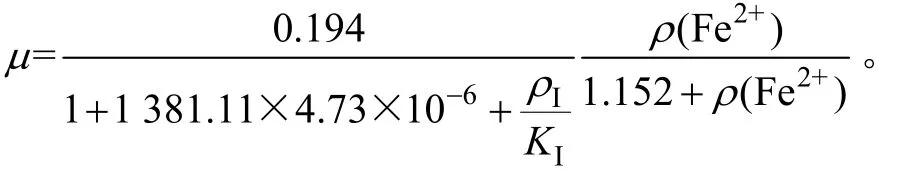
利用该方程得到的比生长速率理论值与实验值的相关系数为 0.973,表明该方程能较好地描述Mg2+浓度对氧化亚铁硫杆菌生长情况的影响。
REFERENCES
[1] ZHEN Shi-jie, QIN Wen-qing, YAN Zhong-qiang, ZHANG Yan-sheng, WANG Jun, REN Liu-yi. Bioleaching of low grade nickel sulfide mineral in column reactor[J]. Transactions of Nonferrous Metals Society of China, 2008, 18: 1480−1484.
[2] 孙彦峰. 氧化亚铁硫杆菌浸出金川低品位镍黄铁矿的研究[D].兰州: 兰州大学, 2007: 15−18.SUN Yan-feng. Study on bioleaching of low-grade nicopyrite in Jinchuan byThiobacillus ferrooxidans[D]. Lanzhou: Lanzhou University, 2007: 15−18.
[3] 甄世杰. 金川高镁型低品位硫化镍矿生物浸出的应用基础与技术研究[D]. 长沙: 中南大学, 2010: 6−12.ZHEN Shi-jie. Application basis and technology research on the bioleaching of Jinchuan low grade nickel-bearing sulfide ore containing high magnesium[D]. Changsha: Central South University, 2010: 6−12.
[4] LI Hong-mei, KE Jia-jun. Influence of Cu2+and Mg2+on the growth and activity of Ni2+adaptedThiobacillus ferrooxidans[J].Minerals Engineering, 2001, 14(1): 113−116.
[5] 李洪梅, 柯家骏. Mg2+对氧化亚铁硫杆菌生长活性的影响[J].中国有色金属学报, 2000, 10(4): 577−578.LI Hong-mei, KE Jia-jun. Effect of Mg2+on growth and activity ofThiobacillus ferrooxidans[J].The Chinese Journal of Nonferrous Metals, 2000, 10(4): 577−578.
[6] LI Hong-mei, KE Jia-jun. Influence of Ni2+and Mg2+on the growth and activity of Cu2+adaptedThiobacillus ferrooxidans[J].Hydrometallurgy, 2001, 61: 151−156.
[7] DE JAGER D, SHELDON M S, EDWARDS W. Modelling growth kinetics of Streptomyces coelicolor A3(2) in a pressurized membrane gradostat reactor (MGR)[J]. Enzyme and Microbial Technology, 2009, 45: 449−456.
[8] SHELDON M S, MOHAMMED K, NTWAMPE S. An investigation of biphasic growth kinetics for Phanerochaete chrysosporium (BKMF-1767) immobilised in membrane gradostat reactor using flow cells[J]. Enzyme and Microbial Technology 2008, 42: 353−361.
[9] LI Yi, LI Jing, WANG Chao, WANG Pei-fang. Growth kinetics and phenol biodegradation of psychrotrophic Pseudomonas putida LY1[J]. Bioresource Technology, 2010, 101(17):6740−6744.
[10] SGOUNTZOS I N, PAVLOU S, PARASKEVA C A,PAYTAKES A C. Growth kinetics ofPseudomonas fluorescensin sand beds during biodegradation of phenol[J]. Biochemical Engineering Journal, 2006, 30: 164−173.
[11] 李再资, 黄肖容, 谢逢春. 生物化学工程基础[M]. 北京: 化学工业出版社, 2006: 119−123.LI Zai-zi, HUANG Xiao-rong, XIE Feng-chun. Biochemical engineering fundamentals[M]. Beijing: Chemical Industry Press,2006: 119−123.
[12] NURMI P, ÖZKAYA B, KAKSONEN A H, TUOVINEN OH,PUHAKKA J A. Inhibition kinetics of iron oxidation byLeptospirillum ferriphilumin the presence of ferric, nickel and zinc ions[J]. Hydrometallurgy, 2009, 97: 137−145.
[13] CABRERA G, G´OMEZ J M, CANTERO D. Kinetic study of ferrous sulphate oxidation ofAcidithiobacillus ferrooxidansin the presence of heavy metal ions[J]. Enzyme and Microbial Technology, 2005, 36: 301−306.
[14] GABRIEL M. Bacterial oxidation of ferrous iron byAcidithiobacillus ferrooxidansin the pH range 2.5−7.0[J].Hydrometallurgy, 2003, 71: 149−158.
[15] LIU Jian-she, ZHANG Yan-hua, LI Bang-mei, XIE Xue-hui. The study kinetic for growth ofAcidithiobacillus ferrooxidans[J].Journal of Microbiology, 2006, 26(2): 9−13.
[16] 李庆扬, 王能超, 易大义. 数值分析[M]. 北京: 清华大学出版社, 2001: 119.LI Qing-yang, WANG Neng-chao, YI Da-yi. Numerical analysis[M]. Beijing: Tsinghua University Press, 2008: 119.
(编辑 龙怀中)
Effect of magnesium ion concentration on growth kinetics of Thiobacillus ferroxidans
LIU Xin-wei1, FENG Ya-li1, LI Hao-ran2, CAI Zhen-lei1, YANG Zhi-chao1
(1. School of Civil and Environmental Engineering, University of Science and Technology Beijing,Beijing 100083, China;2. State Key Laboratory of Biochemical Engineering, Institute of Process Engineering,Chinese Academy of Sciences, Beijing 100190, China)
Q935
A
1004-0609(2012)08-2353-07
国家自然科学基金资助项目(20876160)
2011-07-20;
2011-11-20
冯雅丽, 教授,博士;电话:010-62311181;E-mail: ylfeng126@126.com

