草鱼肠道细菌素的分离纯化及活性研究
俞春红,彭 宽,史玉婷,孙科军,陈 韬*
(1.湖南农业大学动物医学院,湖南长沙410128;2.中南林业科技大学生物技术开放性中心实验室,湖南长沙410004)
目前细菌耐药性已成为全球关注重点问题,随着抗生素的滥用,细菌耐药性日趋严重。国内外许多研究者通过寻找到一些新型的抗菌物质来替代抗生素的应用,最近几年研究最多的是抗菌肽,已有大量的研究表明抗菌肽具有较广的生物学活性,如具有抗真菌、病毒及原虫的活性,广谱的抗细菌活性,并且与传统抗生素合用起到协同作用。另外,在抗肿瘤,先天性免疫及获得免疫调节方面具有其特有的作用[1]。抗菌肽的种类繁多,其作用机制也各有不同。已从昆虫、海洋无脊椎动物、各种细菌分泌的细菌素、动物肠道及生殖道等都已分离到了抗菌肽类物质。早在1981年瑞典科学家Steiner H等从惜古比天蚕蛹中发现了新的抗菌类物质并命名为杀菌肽[2]。随后研究者们在海洋无脊椎动物中发现有甲壳动物、贝类及海鞘类抗菌肽,在食品保鲜方面有很好的应用前景[3]。对于细菌素研究最多的是乳酸菌细菌素,其大致分为四类蛋白或者小分子肽类[4]。Klaenhammer T R[5]认为,99%的细菌可以产生至少一种细菌素。乳酸菌产生的细菌素能广泛存在于乳酸菌代谢产物中,能抑制病原菌及食品腐败菌[6]。肖静等[7]从健康鸡、鼠、兔的肠道及胃内分离到6株乳酸菌,并筛选出3株能分泌具有抑菌活性物质的乳酸菌。
由于自然水体环境的不断恶化及抗生素的滥用,水产养殖中的致病菌的耐药性也不断增大,导致抗菌药物失效。研究发现肠道菌群内90%以上是厌氧菌,并且具有对抗外来菌群及寄生虫的作用[8]。其优势菌在体外也能表现出不同程度的抗菌效果,依鱼种类不同其抗菌活力也不一致,而且还发现它们分泌的抗菌物质对肠道菌群的组成也有一定的影响[9]。孙建明等[10]从草鱼肠道内分离到了具有对大肠埃希菌、金黄色葡萄球菌和嗜产水气单胞菌均表现出较强的抗菌活性的抗菌肽类物质。黄平等[11]研究发现草鱼肠道抗菌肽具有很好的热稳定性及耐胰蛋白酶的特性。本研究通过分离草鱼肠道的菌群,然后分离纯化得到肠道菌群分泌的细菌素,进一步探究草鱼肠道内固有抵抗外来菌群的机理。
1 材料与方法
1.1 材料
1.1.1 试验用动物与菌株 成年健康草鱼,由湖南农业大学水产养殖基地提供。致病性大肠埃希菌(pathogenic Escherichia coli)湖南农业大学鱼类微生物研究室提供。
1.1.2 主要试剂和仪器 乙酸铵(上海生工BBI AR)、硫酸铵,氨水,氯化钡,磷酸二氢钾,磷酸氢二钾,冰醋酸(天津恒星AR)、胰蛋白胨、酵母提取物、Agar、NaCl(上海生工BBI AR)、琼脂粉(上海生工BBI Micro-bio)、HPLC级乙腈,HPLC级三氟乙酸(日本岛津)、Sephadex LH20(Phamacia)。
1.1.3 主要仪器 超声波破碎仪(美国必能信Branson S-450D),冷冻真空干燥机(美国热电Thermo Scientific Modulyo-D230 &SPD111V),台式冷冻离心机(美国热电 Thermo Scientific Sorvall Legend Mach 1.6 R),高效液相色谱仪(日本岛津Shimadzu LC-20A)。
1.2 方法
1.2.1 草鱼肠道微生物培养条件的选择
1.2.1.1 草鱼肠道微生物LB液体培养基厌氧及有氧培养 采取新鲜草鱼肠道,去掉脂肪后解剖肠道,无菌收集肠道黏膜附着物。分别取100μL内容物于10 mL的LB液体培养基内,进行有氧和厌氧培养(用抽气换气法制造厌氧环境)。37℃培养24 h之后,将有氧及厌氧培养的培养液经4 500 r/min离心10 min,收集上清并用冷冻离心机离心冻干。然后分别用400μL无菌水溶解冻干样品。将溶解所得的样品分别用0.22μm孔径的微孔滤膜过滤除菌,即获得无菌的有氧及厌氧培养液浓缩样品。
挑取E.coli单菌落,接种到LB液体培养基中,200 r/min振荡培养至菌液OD600 nm=0.8,取100 μL菌液均匀涂于LB固体培养基平板上,然后用滤纸片法检测浓缩样品对E.coli的抑菌活性。将等比例浓缩的培养基及无菌水做为对照,每张纸片加20μL溶液。37℃培养过夜,隔日观察结果。
1.2.1.2 草鱼肠道厌氧菌分离培养 采用划线法将肠道内容物的菌液接种于LB固体培养基平板。37℃厌氧培养过夜,次日观察单个菌落的形态,并挑取不同形态的单个菌落于LB液体培养基厌氧培养24 h。然后将各单个菌落培养液浓缩并过滤除菌,滤纸片法检测其对E.coli抑菌活性。
1.2.2 草鱼肠道微生物扩大培养及其细菌素的分离纯化
1.2.2.1 乙醇分级沉淀法初步分离纯化扩大培养物 将收集的肠道内容物用M9培养基厌氧扩大培养,并获得较多的培养液浓缩样品。用少量的无菌水溶解冻干样品,然后用乙醇分级沉淀法进行初步分离样品,其中样品:无水乙醇的比例分别为1∶2,2∶3,3∶4,4∶5,在-20℃静置30 min后13 000 r/min离心10 min。将沉淀保存,收集上清并使乙醇浓度从1/2增加到2/3,2/3到3/4,3/4到4/5,-20℃静置过夜,次日13 000 r/min离心10 min。沉淀保存,收集上清于冷冻离心机冻干。滤纸片法检测各沉淀和上清对E.coli的抑菌活性。
1.2.2.2 乙醇分离所得抑菌活性成分的凝胶过滤层析 收集500 mL/L~900 mL/L乙醇之间的沉淀冷冻干燥除去乙醇,无菌水溶解并经12 000 r/min离心10 min。所得上清以凝胶过滤方法(分子筛柱为日本东曹达TSK-2500PW)分离,流动相为1.0 g/L TFA dd H2O,0.4 mL/min流速洗脱,280 nm紫外吸收检测,按峰收集。将每管样品经冷冻离心机冻干后用滤纸片法检测各洗脱组分对E.coli的抗菌活性。
1.2.2.3 RP-HPLC纯化 使用C-18分析型色谱柱(Thermo HYPERSIL GOLD 3μm 150×4.6 mm),日本岛津高效液相色谱仪(Shimadazu Prominence LC-20A)对具有抑菌活性的2号和3号峰样品进一步分离纯化。色谱条件:20 min内乙腈浓度由50 mL/L升至850 mL/L,流速0.8 mL/min,检测波长为280 nm,按峰收集,各组分经冷冻离心机冻干后,纸片法检测各个吸收峰对E.coli的抗菌活性。
2 结果
2.1 草鱼肠道微生物不同条件培养物的抑菌活性检测
通过滤纸片法检测体外草鱼肠道菌群有氧及厌氧培养物对E.coli的抑菌活性。结果表明,厌氧混合培养液浓缩样品具有较好的抗E.coli的活性,而有氧混合培养液浓缩样品及厌氧划线法分离的单个菌落的培养浓缩样品的抑菌效果不明显(图1)。

2.2 乙醇分级沉淀法初步分离所得样品的抑菌活性检测
由于厌氧混合培养液浓缩样品具有较好的抑菌活性,所以通过用M9培养基大量培养获得足够量的浓缩样品。然后用乙醇分级沉淀法将样品进行初步的分离纯化,纸片法检测各分离组抗E.coli的活性。500 mL/L以下乙醇沉淀物及900 mL/L以上的上清没有抑菌活性。依据活性检测结果,收集500 mL/L~900 mL/L乙醇之间的沉淀,做进一步分离纯化(图2)。
2.3 粗提样品柱层析分离纯化及抑菌活性检测
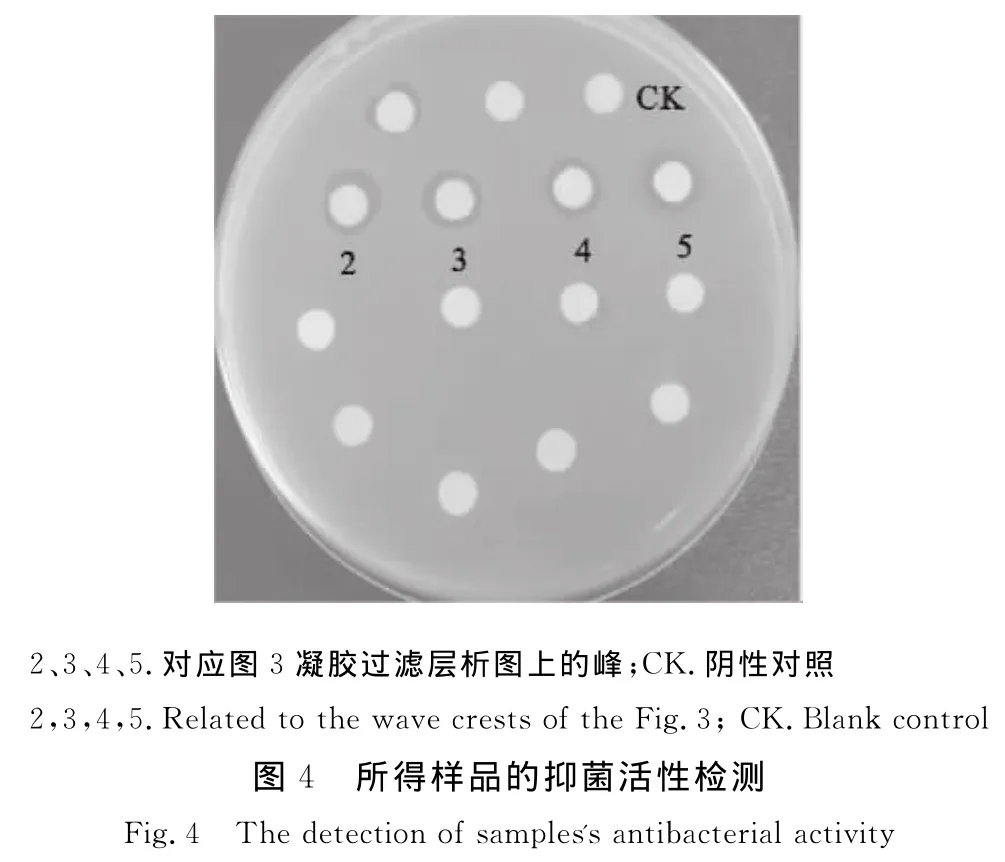
取50μL上述粗分离样品上样于TSK柱,分离得到7个明显的洗脱峰(图3)。将收集的7管样品浓缩后用无菌水溶解,然后再通过纸片法进行抑菌活性检测。如图4所示,2、3、4、5号峰组分具有较明显的抑菌圈。选取2号和3号峰浓缩样品做进一步分离纯化。
2.4 RP-HPLC进一步纯化及抑菌活性检测
将分子筛2号和3号峰浓缩样品分别经RPHPLC做进一步分离,如图5和图6所示,2号和3号经高相液相色谱分离后得明显的3个峰,3个峰之后继续收集2管。即每个峰各收集5管。抑菌活性检测如图7所示,3号的前3个峰具有明显的抑菌圈。峰型分析3-1,3-2,3-3都可以进行质谱检测其成分。

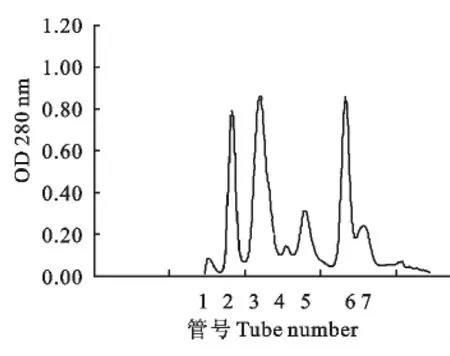
图3 凝胶过滤层析Fig.3 Gel filtration chromatography



3 讨论
近年来,国内外对细菌素的研究越来越多,并且广泛应用于食品中。目前细菌素在畜牧业生产中应用还比较少,在饲料添加剂中可以有两方面的作用,一方面是防止饲料本身被沙门菌等致病菌污染,另一方面是防止致病菌对动物肠道的影响[12]。但对于细菌素的定义至今仍然没有明确,公认为是由某些细菌核糖体产生的非确定性的蛋白类或者肽类抗菌物质,其分子质量小,无抗原性,无毒副作用,选择性地抑制或杀伤敏感菌[13]。目前有很多关于从不同动物体或者食物中分离出各种乳酸菌,并研究其发酵产生的抑菌活性物质的理化性质及抑菌活性。陈新练等[14]从虎皮鹦鹉的粪便中分离出了产细菌素的菌株,并发现产生的细菌素对革兰阴性和阳性细菌均具有较强的抑制作用。田召芳等[15]从健康鸡、兔及猪的肠道内容物内分离到了能分泌抑菌活性物质的乳酸菌,并证明分泌物中具有蛋白质类细菌素存在。但只是初步研究了细菌素的一些特性,而并没有分离纯化。
本文先分别通过不同环境下培养草鱼肠道微生物,通过抑菌活性检测选择具有能分泌具有抑菌活性物质的厌氧培养法,然后扩大培养获得足够的抗菌物质。采用乙醇分级沉淀、凝胶过滤层析及高效液相色谱等方法对草鱼肠道优势菌的体外培养分泌物进行分离纯化,获得了比较纯的具有抑菌活性的物质。试验结果表明,在厌氧条件下,草鱼肠道微生物能分泌具有较好抑菌活性的抗菌物质;并且混合培养比单个菌落培养所产生的抗菌物质更多。可能各种优势菌之间相互诱导作用才能产生或产生更多的活性物质,其具体原因以及产生细菌素的微生物类群特性需要做进一步研究。通过质谱分析纯化所得的具有抗E.coli活性的物质,显示该物质是一组亲水性极强、分子质量为300 ku左右的小分子混合物(质谱图未列于本文)。虽然是混合物,但是通过凝胶过滤层析,RP-HPLC的分离纯化,说明该组物质的亲水性、分子大小、结构等都是极相似的。如何进一步分离纯化得到单一物质,单一成分是否具有抑菌活性,这类物质是否具有协同效应,该成分的抑菌谱及理化性质如何等都需要进一步研究。
[1]黎观红,洪智敏,贾永杰,等.抗菌肽的抗菌作用及其机制[J].动物营养学报,2011,23(4):546-555.
[2]Steiner H,Hultmark D,Engstr M,et al.Sequence and specificity of two antibacterial proteins involved in insect immunity[J].Nature,1982,292:246-248.
[3]宫晓静,吴燕燕.海洋无脊椎动物抗茵肽研究进展及其在食品保鲜中的应用[J].生物技术通报,2011(3):27-32.
[4]朱文淼,刘 稳.乳酸菌细菌素的分子生物学研究进展[J].中国微生态学杂志 ,2000,12(2):113-115.
[5]Klaenhammer T R.Bacteriocins of lactic acid bactic bacteria[J].Biochimie,1988,70(3):337-349.
[6]易西华,张兰威,杜 明,等.乳酸菌细菌素抗菌潜力挖掘研究进展[J].中国食品添加剂,2010(1):73-76.
[7]肖 静,薛春梅,梁秀娟,等.动物源乳酸菌的筛选与特性研究[J].高师理科学刊,2010,30(6):60-62.
[8]葛莉莉.鱼类肠道菌群的研究概况[J].水利渔业,2006,26(4):17-20.
[9]Sugita H K,Shibuya H,Deguchi S Y.Antibacterial fish[J].Aquaculture,1997,145(1-4):195-203.
[10]苏建明,雷红宇,黄平,等.草鱼肠道抗菌肽的提取及体外抑菌效果初步研究[J].湖南农业大学学报:自然科学版,2009,35(2):162-165.
[11]黄 平,陈 韬,彭 宽,等.草鱼肠道抗菌肽对细菌形态结构的影响及理化性质研究[J].湖南农业大学学报:自然科学版,2010,36(1):69-72.
[12]李巧贤,张建飞,哈 斯,等.畜牧业生产中细菌素取代抗生素的发展趋势[J].畜牧与饲料科学,2010,31(6-7):233-234.
[13]尚雅婧,张日俊.细菌素应用的理论与实践[J].中国畜牧兽医,2010,37(5):26-29.
[14]陈新练,陈仪本.从虎皮鹦鹉粪便中分离产细菌素菌株及其细菌素特性分析[J].生物技术通报,2010(9):185-190.
[15]田召芳,常维山,唐珂心,等.产细菌素乳酸菌的筛选及体外抑菌试验[J].中国微生态学杂志,2003,15(2):87-88.

