哈维氏弧菌硫氧还蛋白还原酶在大肠杆菌中的表达及对大菱鲆的免疫保护作用
陶然,刘瑞, 王晴, 陈吉祥、2
(1.中国海洋大学 海洋生命学院,山东 青岛 266003;2.兰州理工大学 石油化工学院,甘肃 兰州 730050)
哈维氏弧菌Vibrioharveyi是一种革兰氏阴性的细菌,广泛分布于海洋环境及海洋生物中[1], 能引起海水鱼类及其它养殖动物发病,是世界上许多国家和地区养殖对虾和鱼类的致病菌[2-3],也是中国海产经济鱼类弧菌病的主要病原菌之一,该致病菌给海水养殖业造成了巨大的经济损失[4-5]。哈维氏弧菌的胞外蛋白酶、磷脂酶、溶血素、Ⅲ型分泌系统、密度感应系统等与其致病性密切相关[6-9]。目前,国内对细菌病防治仍然主要依靠化学药物及抗生素,由此带来的环境污染、药物残留及细菌耐药性现象日趋严重。免疫预防技术既安全又无污染,是水产养殖病害防控最为有效的措施之一。关于对哈维氏弧菌全菌灭活疫苗的研究已有成功的报道,哈维氏弧菌的溶血素、胞外蛋白酶、外膜蛋白等也已用于疾病的免疫防治试验,并表现出较好的免疫效果[10-12]。
微生物在环境中常受到较多的活性氧自由基的损害。硫氧还蛋白系统包括硫氧还蛋白、硫氧还蛋白还原酶和烟酰胺腺嘌呤二核苷酸磷酸(NADPH),是一个NADPH依赖性的二硫化物还原酶系统,广泛存在于真核生物和原核生物中[13-14]。硫氧还蛋白系统与体内细胞的氧化还原反应、核酸代谢和细胞生长密切相关。硫氧还蛋白还原酶(thioredoxin reductase,TrxR)是一种NADPH依赖性的包含FAD结构域的二聚体硒酶,主要功能是催化NADPH将小分子蛋白硫氧还蛋白上的二硫键(-S-S)还原成(-SH)2的反应,维持trx的还原型,可以维持细胞自由基的产生和被清除之间的平衡,对微生物在不良环境中的生存及病原菌的致病作用有重要作用[15]。
本试验中,作者从致病性哈维氏弧菌中克隆和表达了硫氧还蛋白还原酶基因,研究了表达蛋白对大菱鲆Scophthalmusmaximus的免疫作用,以期探索其作为亚单位疫苗用于哈维氏弧菌病防治的可行性。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 哈维氏弧菌VibrioharveyiSF1分离自患病的花鲈Lateolabraxjaponicus,经过常规生理生化及16S rDNA序列分析鉴定后由中国海洋大学海洋生命学院微生物实验室保存[8]。连接质粒pMD19-T购自大连TaKaRa公司,大肠杆菌DH5α和BL21(DE3)购自Tiangen 公司,表达质粒pET28a(+)购自Novagen公司。
1.1.2 主要试剂和仪器 Taq DNA聚合酶、dNTP、IPTG、各种限制性内切酶、DL2000 DNA Marker和DNA凝胶回收纯化试剂盒购自大连TaKaRa公司,Ni琼脂糖亲和层析柱购自Novagen公司,预染蛋白标准分子量购自Tiangen公司。兔抗大菱鲆免疫球蛋白为中国海洋大学海洋生命学院微生物实验室保存,辣根过氧化物酶HRP标记羊抗兔IgG购自武汉博士德生物工程有限公司。兔抗大菱鲆免疫球蛋白血清由中国海洋大学海洋生命学院微生物实验室制备[16]。主要仪器包括PCR仪(BIO-RAD)、UV-2100 PC分光光度计(Unico)、凝胶成像仪(BIO-BEST)、MIKRO 22R离心机(Hittich,Germany)和蛋白电泳仪(BIO-RAD)。
1.2 方法
1.2.1 哈维氏弧菌trxR基因克隆及序列分析 根据GenBank中已发表的哈维氏弧菌全基因组序列及其它弧菌trxR基因序列,利用Primer 5.0 软件设计引物,上游引物5′-CGCGAATTCCGGGAGAAATGTTCAGCCCTCTA-3′(加下划线处为EcoRⅠ酶切位点),下游引物5′-CCGCTCGAGGCCACTTATTCAA GCTGCTTTGC-3′ (加下划线处为XhoⅠ酶切位点)。用酚-氯仿法提取哈维氏弧菌SF1基因组DNA,PCR反应体系为50 μL,PCR反应条件为:95 ℃下预变性5 min;95 ℃下变性1 min,55 ℃下退火1 min,72 ℃下延伸1.5 min,共进行30个循环;最后在72 ℃下延伸10 min。PCR 扩增产物用10 g/L的琼脂糖凝胶电泳检测,并用DNA凝胶回收试剂盒纯化。将PCR扩增产物与pMD19-T Simple质粒分别用EcoRⅠ 和XhoⅠ进行双酶切,回收片段连接pMD19-T Simple,用T4DNA连接酶连接后转化至大肠杆菌DH5α中,重组质粒命名为pMD19-T Simple/TrxR。挑取阳性克隆进行酶切,送上海生物工程公司进行序列测定,在NCBI( http://blast.ncbi.nlm.nih.gov/Blast. cgi)进行序列分析,用Mega 3.1软件构建系统发育树。
1.2.2 哈维氏弧菌trxR基因原核表达载体的构建及在大肠杆菌中的表达 根据已克隆的哈维氏弧菌SF1trxR基因序列分析结果,使用上述特异性引物,以重组克隆质粒pMD19-T Simple/TrxR为模板,扩增trxR基因。PCR反应条件如前。将PCR扩增产物和质粒pET28a(+)分别用EcoRⅠ和XhoⅠ酶切。回收酶切trxR基因片段和质粒pET28a(+),用T4DNA连接酶连接,构建表达质粒pET28a(+)/TrxR,转化至DH5α中。挑取阳性克隆接种于5 mL LB培养液(含30 μg/ mL卡那霉素)中,37 ℃下振荡培养过夜,用PCR扩增及酶切鉴定阳性克隆。将重组表达质粒转化至BL21(DE3)中,即得到重组菌BL21(DE3)/pET28a(+)/TrxR。
将重组菌BL21(DE3)/pET28a(+)/TrxR接种于5 mL的LB液体培养基(含30 μg/mL卡那霉素)中,37 ℃下过夜培养;取50 μL接种于5 mL相同的培养基中,于37 ℃下振荡培养3 h,加入终浓度为0.8 mmol/L的IPTG进行诱导表达;继续培养6 h后,吸取1 mL菌液,在4 ℃下以12 000 r/min离心20 min,分别收集菌体和上清液。在收集的菌体中加入20 μL生理盐水和5 μL 5×SDS-PAGE Loading buffer,混匀后煮沸变性5 min,离心,取上清液后用SDS-PAGE(质量分数为12%的分离胶和5%的浓缩胶)分析表达的蛋白。
1.2.3 用Ni琼脂糖亲和层析柱分离纯化TrxR蛋白 将5 mL Ni琼脂糖装层析柱用10 mmol/L咪唑结合缓冲液(含20 mmol/ L Tris-HCl, pH为8.0,10 mmol/L 咪唑, 0.5 mmol/L NaCl) 平衡。用10 mmol/L 咪唑结合缓冲液重悬收集的诱导表达菌体BL21(DE3)/pET28a(+)/TrxR,在低温环境中超声破碎,在4 ℃下以12 000 r/min离心10 min,上清液经0.22 μm滤膜抽滤后上柱,分别用2倍体积的10 mmol/L的咪唑结合缓冲液和10倍体积的20 mmol/L咪唑洗涤缓冲液(含20 mmol/L Tris-HCl, pH为8.0,20 mmol/L 咪唑, 0.5 mmol/L NaCl)洗涤。最后用150 mmol/L的咪唑洗脱缓冲液(20 mmol/L Tris-HCl, pH为8.0, 150 mmol/L咪唑, 0.5 mmol/L NaCl)洗脱,收集洗脱液。将纯化的蛋白置于透析袋中,于4 ℃下透析24 h。
1.2.4 大菱鲆的免疫和人工感染 将体质量约15 g的大菱鲆105 尾随机分成3组,在海水中饲养。饲养期间,每天换水两次,水温为20 ℃,充气培养。正常饲养48 h后,进行免疫试验,其中两个对照组分别注射100 μL生理盐水和100 μL枯草芽孢杆菌(1×107CFU/mL);试验组注射100 μL TrxR蛋白(500 μg/mL,含1×107CFU/mL 枯草芽孢杆菌 )。在首次免疫后第3周,对试验组大菱鲆进行第2次免疫,方法同第1次。首次免疫后,每周取一次样,每组取3尾鱼,从尾静脉采血0.5 mL, 室温下静置2 h后移入冰箱(4 ℃)中过夜。次日,以12 000 r/min离心10 min,分离血清,于-80 ℃下保存,用ELISA方法测定抗体效价。免疫后第4周,对每组鱼分别肌肉注射0.1 mL哈维氏弧菌SF1 (3.9×108CFU/mL),进行攻毒试验。每天观察鱼的动态,记录死亡情况,对部分发病及死亡鱼进行病理检查和病原菌分离,并计算其相对免疫保护力(RPS):
RPS= 免疫组死亡率对照组死亡率×100%。
1.2.5 特异性抗体的ELISA检测 ELISA检测按照常规方法进行。在预备试验中以方阵法测定抗原的包被浓度为15 μg/mL。抗原为纯化的哈维氏弧菌SF1的TrxR蛋白,用PBS稀释至15 μg/mL。将96孔酶标板分别以上述抗原包被过夜, 将大菱鲆抗血清以2倍系列稀释度加到各孔中, 初始稀释度为1∶64,每个稀释度并排3孔作为重复,最后加入100 μL PBS作为空白对照。以兔抗大菱鲆免疫球蛋白血清(稀释度为1∶1 000) 和HRP标记的羊抗兔IgG (稀释度为1∶2 000)作为一抗和二抗,以TMB显色缓冲液显色15 min后, 加入2 mol/L H2SO4终止反应。在酶标仪450 nm波长处读取OD值。试验血清吸光度值(P)=待检血清OD值-空白OD值, 对照血清吸光度值(N)=对照血清OD值-空白OD值,当两者比值P/N>2.1时, 则判断为阳性,阳性孔的最大稀释度即为抗体效价。用t检验分析其显著性,置信度水平为95%(P<0.05)。
2 结果
2.1 哈维氏弧菌trxR基因克隆及序列分析
从哈维氏弧菌SF1基因组中扩增出1 133 bp特异性片段(图1)。DNA序列分析结果表明,含有960 bptrxR的开放阅读框(ORF),编码为319个氨基酸残基的蛋白质。Blast结果显示,该基因编码的蛋白序列与哈维氏弧菌(ZP_01987461.1)、溶藻胶弧菌(ZP_01261254.1)、副溶血弧菌(NP_797630.1)、 灿烂弧菌(EAP93161.1)、弗氏弧菌(ADT87340.1)的TrxR蛋白序列相似性分别为99%、98%、96%、94%、92%。
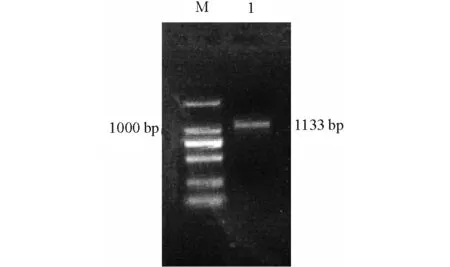
注:M为 DL 2000 DNA Marker;1为哈维氏弧菌SF1的 PCR 扩增产物。Note:M, DL 2000 DNA Marker;1,PCR product from Vibrio harveyi SF1.图1 哈维氏弧菌SF1 trxR基因的PCR 扩增Fig.1 PCR amplification of trxR gene in Vibrio harveyi SF1
将其氨基酸序列与不同种属TrxR及相似性蛋白的氨基酸序列通过Clustal 软件(Clustalw multiple alignment) 进行多序列比对,采用Mega 3.1 邻接法(Neighbor-Joining) 构建系统进化树(图2)。从进化树可以看出,该蛋白与哈维氏弧菌HY01的TrxR( ZP_01987461.1)聚为同一类群,并与溶藻胶弧菌、副溶血弧菌的TrxR在进化上相近。
2.2 哈维氏弧菌trxR基因在大肠杆菌中的表达及纯化
将哈维氏弧菌trxR基因克隆至原核表达载体pET28a(+),转化至大肠杆菌BL21(DE3)中得到阳性克隆菌株BL21(DE3)/pET28a(+)/TrxR。将重组菌在含卡那霉素的LB液体培养基中培养,用IPTG诱导表达。经SDS-PAGE凝胶电泳显示,诱导后含重组质粒BL21(DE3)在相对分子质量为34 000位置上出现了1条明显的表达蛋白带,而不含重组质粒的对照BL21(DE3)菌体中没有此蛋白条带(图3); 将菌体裂解液用Ni琼脂糖亲和层析柱分离纯化,经SDS-PAGE分析显示,此蛋白条带相对分子质量约为34 000 (图4), 与理论值一致。
2.3 重组蛋白TrxR对大菱鲆的免疫保护效果
用纯化的TrxR蛋白免疫大菱鲆,免疫后第4周,试验组和对照组用哈维氏弧菌SF1进行攻毒试验。

图2 哈维氏弧菌TrxR的系统进化树Fig.2 Phylogenetic tree of TrxR from Vibrio harveyi
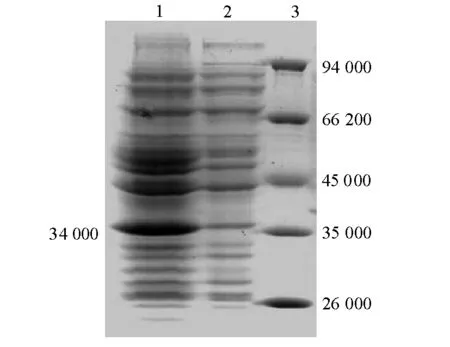
注:1为 重组菌BL21(DE3)/ pET28a(+)/TrxR;2为 BL21/(DE3);3为标准相对分子质量蛋白。Note:1,BL21(DE3)/pET28a(+)/TrxR; 2,Negative control; 3,Protein molecular weight marker.图3 重组菌BL21(DE3)/pET28a(+)/TrxR表达蛋白的SDS-PAGEFig.3 SDS-PAGE analysis of protein in the combinant expressed by BL21(DE3)/pET28a(+)/TrxR
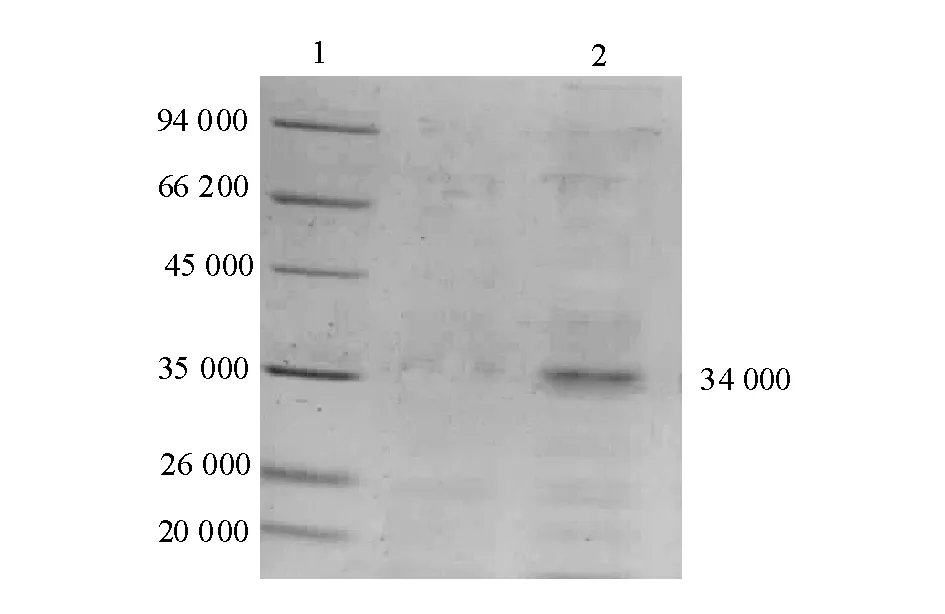
注:1为标准相对分子质量蛋白;2为纯化的TrxR。Note:1,Protein molecular weight marker; 2,The purified TrxR.图4 纯化的重组蛋白TrxR 的SDS-PAGEFig.4 SDS-PAGE analysis of the purified recombinant TrxR
结果表明,对照组鱼在感染第3天开始死亡,并且出现了明显症状,如运动和摄食能力下降,出现腹水和体表溃疡等。在感染后2周内,对照组的大菱鲆全部死亡;TrxR免疫组的死亡率为25%,相对免疫保护力为75% (表1)。

表1 TrxR蛋白对大菱鲆的免疫保护作用
2.4 TrxR免疫对大菱鲆特异性抗体变化规律的影响
在免疫后的不同时期分别取各组鱼的血清,用直接ELISA 法检测特异性抗体。结果表明:免疫组在免疫后第1周血清中就出现了特异性抗体,在第3~4周内鱼血清中特异性抗体维持在较高水平,第2周抗体效价达到1∶128;而对照组没有检测到特异性抗体的存在(图5)。
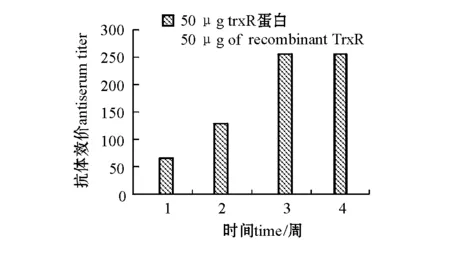
图5 经TrxR免疫后大菱鲆血清中特异性抗体的ELISA检测结果Fig.5 Serum antibody responses in the turbot vaccinated with the recombinant TrxR by ELISA
3 讨论
免疫预防技术是水产养殖病害预防的首选措施。关于哈维氏弧菌全菌灭活疫苗及亚单位疫苗的研究已有较多报道。如Zhang等[17]用纯化的重组丝氨酸蛋白酶Vhp1免疫牙鲆Paralichthysolivaceus,结果对牙鲆的免疫保护率可达70 %;Li等[18]报道了从哈维氏弧菌EcGS020802克隆到相对分子质量为28 000的外膜蛋白OmpK,该蛋白对斜带石斑鱼Epinepheluscoioides免疫后能产生特异性抗体,免疫保护率为100%;Zhang等[19]构建了哈维氏弧菌的外膜蛋白和甘油醛脱氢酶的融合蛋白,分别用r-OmpK-GAPDH、r-Omp和r-GAPDH以及OmpK与GAPDH的混合物对大黄鱼Pseudosciaenacrocea进行免疫,结果发现,单体蛋白和融合蛋白对鱼都有一定的保护作用,单体蛋白r-Omp和r-GAPDH的免疫保护率为37.7% 和40.0%, 而融合蛋白r-OmpK-GAPDH的免疫保护率为70%;与单体蛋白相比,融合蛋白中的OmpK和GAPDH产生了协同作用。黄辉等[20]从哈维氏弧菌致病菌株基因组中克隆了ompU基因,表达的蛋白相对分子质量为41 000,以50 μg/mL的剂量注射免疫大黄鱼幼鱼,用间接ELISA法检测特异性抗体的效价,结果表明,4~8 周内特异性抗体效价持续升高,其log2的值为8.0以上,4周时对大黄鱼幼鱼的相对免疫保护率为85%。Sun等[21]从哈维氏弧菌T4基因组中克隆到相对分子质量为22 500的外膜蛋白VhhP2,该蛋白在不同来源的致病菌中都存在,纯化的VhhP2能有效保护日本牙鲆抵抗哈维氏弧菌的攻毒感染,免疫鱼的死亡率为10%,而对照组的死亡率为93.3%;该蛋白还能有效诱导一些免疫相关基因的表达,尤其是IgM和MHC IIα,Mx、IFN、IFN-γ和MHC Iα。免疫试验中,使用枯草芽孢杆菌作为免疫佐剂,可以促进蛋白更好的发挥免疫作用。
硫氧还蛋白系统广泛存在于生物体内,与细胞的氧化还原反应、细胞生长等生理活动相关,有助于微生物适应环境,而且在抵抗细菌致病性方面可能发挥重要作用。有关弧菌硫氧还蛋白还原酶功能研究的报道较少。本研究中,在哈维氏弧菌SF1基因组克隆的trxR基因序列与溶藻胶弧菌、副溶血弧菌、灿烂弧菌、弗氏弧菌等的TrxR蛋白序列相似性较高,在大肠杆菌中表达的重组蛋白的相对分子质量为34 000,与大肠杆菌及其它原核生物种的TrxR 蛋白相对分子质量一致[22]。这表明TrxR是一个相对保守的蛋白。
本研究中采用在大肠杆菌表达并纯化的TrxR免疫大菱鲆,结果发现,免疫大菱鲆血清中产生了较高水平的特异性抗体,4周后对致病性哈维氏弧菌攻毒感染的免疫保护率为75%。这表明TrxR可以作为一个有效候选亚单位疫苗抗原。今后的工作重点将集中于硫氧还蛋白还原酶基因缺失突变株的构建及生理特性研究上,以探讨其在哈维氏弧菌生理代谢及环境适应过程中的作用,同时进一步研究硫氧还蛋白还原酶对海水鱼类的免疫保护作用机制及其有效免疫途径,并将其作为亚单位疫苗用于弧菌病的防治。
参考文献:
[1] Alvarez J D,Austin B,Alvarez A M.Vibrioharveyi: a pathogen of penaeid shrimps and fish in Venezuela[J].Journal of Fish Diseases,1998,21:313-316.
[2] Austin B,Austin D A.Bacterial Fish Pathogens,Disease of Farmed and Wild Fish.4th ed[M].Chichester,UK:Praxis Publishing Ltd,2007.
[3] Saeed M O.Association ofVibrioharveyiwith mortalities in cultured marine fish in Kuwait[J].Aquaculture,1995,136: 21-29.
[4] 毛芝娟,刘国勇,陈昌福.大黄鱼溃疡病致病菌的初步分离[J].安徽农业大学学报,2002,29 (2): 178-181.
[5] 王保坤,余俊红,李筠,等.花鲈弧菌病原菌(哈维氏弧菌)的分离与鉴定[J].中国水产科学,2002,9(1):52-55.
[6] Liu P C,Lee K K,Tu C C,et al.Purification and characterization of a cysteine protease produced by pathogenic luminousVibrioharveyi[J].Curr Microbial,1997,35:32-39.
[7] Sun B G,Zhang X H,Tang X X,et al.A single residue change inVibrioharveyihemolysin results in the loss of phospholipase and hemolytic activities and pathogenicity for turbot (Scophthalmusmaximus)[J].J Bacteriol,2007,189:2575-2579.
[8] Zhang X H,Meaden P G,Austin B.Duplication of hemolysin genes in a virulent isolate ofVibrioharveyi[J].Applied Environmental Microbiology, 2001, 67:3161-3167.
[9] Henke J M,Bassler B L.Quorum sensing regulates type III secretion inVibrioharveyiandVibrioparahaemolyticus[J].Bacteriol,2004,186:3794-3805.
[10] Arijo S,Rico R,Chabrillon M,et al. Effectiveness of a divalent vaccine for sole,Soleasenegalensis(Kaup),againstVibrioharveyiandPhotobacteriumdamselaesubsp[J].Piscicida Fish Dis, 2005,28:33-38.
[11] Crosbie P B,Nowak B F.Immune responses of barramundi,Latescalcarifer(Bloch) after administration of an experimentalVibrioharveyibacterin by intraperitoneal injection,anal intubation and immersion [J].Fish Dis,2004, 27: 623-632.
[12] Zhu K,Chi Z,Li J,et al.The surface display of haemolysin fromVibrioharveyion yeast cells and their potential applications as live vaccine in marine fish[J].Vaccine,2006, 24: 6046-6052.
[13] Ritz D,Beckwith J.Roles of thiolredox pathways in bacteria[J].Annu Rev Microbiol,2001,55:21-48.
[14] Penninckx M. A short review on the role of glutathione in the response of yeasts to nutritional,environmental and oxidative stresses [J].Enzyme Microb Technol, 2000,26:737-742.
[15] Grant C M,MacIver F H,Dawes I W.Glutathione is an essential metabolite required for resistance to oxidative stress in the yeastSaccharomycescerevisiae[J].Curr Genet,1996,29:511-515.
[16] 魏鉴腾,陈吉祥,王淑娴,等.大菱鲆血清免疫球蛋白IgM的纯化及应用研究[J].中国海洋大学学报,2008,38(6):932-935.
[17] Zhang Weiwei,Sun Kai,Cheng S,et al. Characterization of DegQVh,a serine protease and a protective immunogen from a pathogenicVibrioharveyistrain[J].Appl Environ Microbiol, 2008,74:6254-6262.
[18] Li N Q, Bai J J,Wu S Q, et al.An outer membrane protein,OmpK,is an effective vaccine candidate forVibrioharveyiin orange-spotted grouper (Epinepheluscoioides)[J].Fish & Shellfish Immunol, 2008,25: 829-833.
[19] Zhang C,Yu L,Qian R.Cloning and expression ofVibrioharveyiOmpK* and GAPDH* genes and their potential application as vaccines in large yellow croakersPseudosciaenacrocea[J].Aquat Anim Health,2008,20:1-11.
[20] 黄辉,毛芝娟,陈吉刚.哈维氏弧菌外膜蛋白OmpU的克隆、表达与免疫原性研究[J].华中农业大学学报,2010, 29(3):346-350.
[21] Sun K,Zhang W,Hou J,et al.Immunoprotective analysis of VhhP2,aVibrioharveyivaccine candidate[J].Vaccine,2009,27:33-40.
[22] Ruocco A A,Ruggiero B L,Masullo A P,et al.A 35 kDa NAD(P)H oxidase previously isolated from the archaeonSulfolobussolfataricusis instead a thioredoxin reductase[J].Biochimie,2004, 86:883-892.

