普洱生茶快速发酵法制备茶褐素
房 贤 坤, 陈 杰, 姜 吉, 张 春 枝
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034; 2.蒙顿茶制品(大连)有限公司, 辽宁 大连 116001 )
0 引 言
茶色素[1]作为一种天然食用色素,是由茶叶中以儿茶素为主的多酚类化合物氧化聚合衍生而来的一类水溶性色素混合物[2-3],根据颜色又可分为茶黄素(TFs)、茶红素(TRs)、茶褐素(TBs)三类[4]。现代药理学研究表明,茶色素具有较强的抗氧化和清除自由基功能[6],在食品和医药领域存在潜在的开发价值。茶色素的研究主要集中在茶黄素和茶红素上,而茶褐素是一类分子差异极大的化合物,由于其结构复杂,对茶褐素的研究进展缓慢,迄今为止,茶褐素的制备仍停留在过去单纯地从普洱熟茶中提取,不仅含量低,而且由于普洱熟茶价格昂贵,对茶褐素的制备和应用造成了极大限制。
普洱茶渥堆发酵是茶褐素形成的关键工序,在微生物分泌的胞外酶的作用下,普洱茶中以茶多酚为主体的多种成分发生一系列复杂而剧烈的化学变化,形成了普洱茶特有的色香味品质,同时伴有茶褐素的大量生成[5-6]。作者从普洱茶渥堆发酵众多微生物中筛选到一株霉菌fxk-01,并对其发酵条件进行了研究,重点研究了发酵后普洱生茶中茶褐素的提取条件,测定了茶褐素样品的抗氧化能力,以期为茶褐素的实际生产和利用提供必要的理论参考。
1 试 验
1.1 材料与菌种
普洱生茶,产地云南普洱;霉菌fxk-01,普洱茶渥堆发酵样品中筛选得到。
1.2 方 法
1.2.1 种子液的制备
培养基的制备:硝酸钠2 g,磷酸氢二钾1 g,氯化钾0.5 g,硫酸镁0.5 g,硫酸铁0.01 g,蔗糖30 g,水1 000 mL,将上述各成分依次溶解,待完全溶化后,补足水分到所需体积,将培养基分装于250 mL烧瓶内,在121 ℃、0.1 MPa高温高压灭菌20 min。
在无菌条件下,将已灭过菌的培养基中接入霉菌fxk-01,在28~30 ℃、160 r/min摇床培养7 d。
1.2.2 发酵条件的选择
分别考察发酵时间、发酵温度对茶褐素产量的影响。发酵时间分别为5、6、7、8、9、10、11 d,发酵温度为25、30、35、40、45、50 ℃,发酵完成后测其中茶褐素含量[9],确定最适发酵条件。
1.2.3 提取条件的优化
以最优发酵后茶叶为对象,以茶褐素相对含量为测量指标,对茶褐素进行有机溶剂萃取,对提取过程中提取次数、提取温度、料液比、提取时间分别进行单因素试验和正交试验,确定最优提取条件,提高茶褐素得率。
1.2.4 茶褐素抗氧化活性的测定
对制得的茶褐素样品进行清除DPPH自由基能力的测定[10],确定茶褐素样品的抗氧化活性。
2 结果与讨论
2.1 最适发酵时间的选择
称取普洱生茶10 g,加去离子水10 mL润湿,经100 ℃沸水灭菌30 min,冷却后在无菌室接种霉菌fxk-01,在30 ℃培养箱中培养发酵,每天摇瓶1次,从第5天开始测其中茶褐素的含量,确定最优发酵时间。结果如图1所示,发酵到第8天后茶褐素含量最大并基本不变,因此最佳发酵时间为8 d。
2.2 最适发酵温度的选择
称取普洱生茶10 g,加去离子水10 mL润湿,经100 ℃沸水灭菌30 min,冷却后在无菌室接种霉菌fxk-01,分别在25、30、35、40、45、50 ℃培养箱下发酵8 d,测定茶褐素质量分数,确定最优发酵温度。结果如图2所示,35 ℃发酵条件下能生成最高含量的茶褐素,故最佳发酵温度为35 ℃。
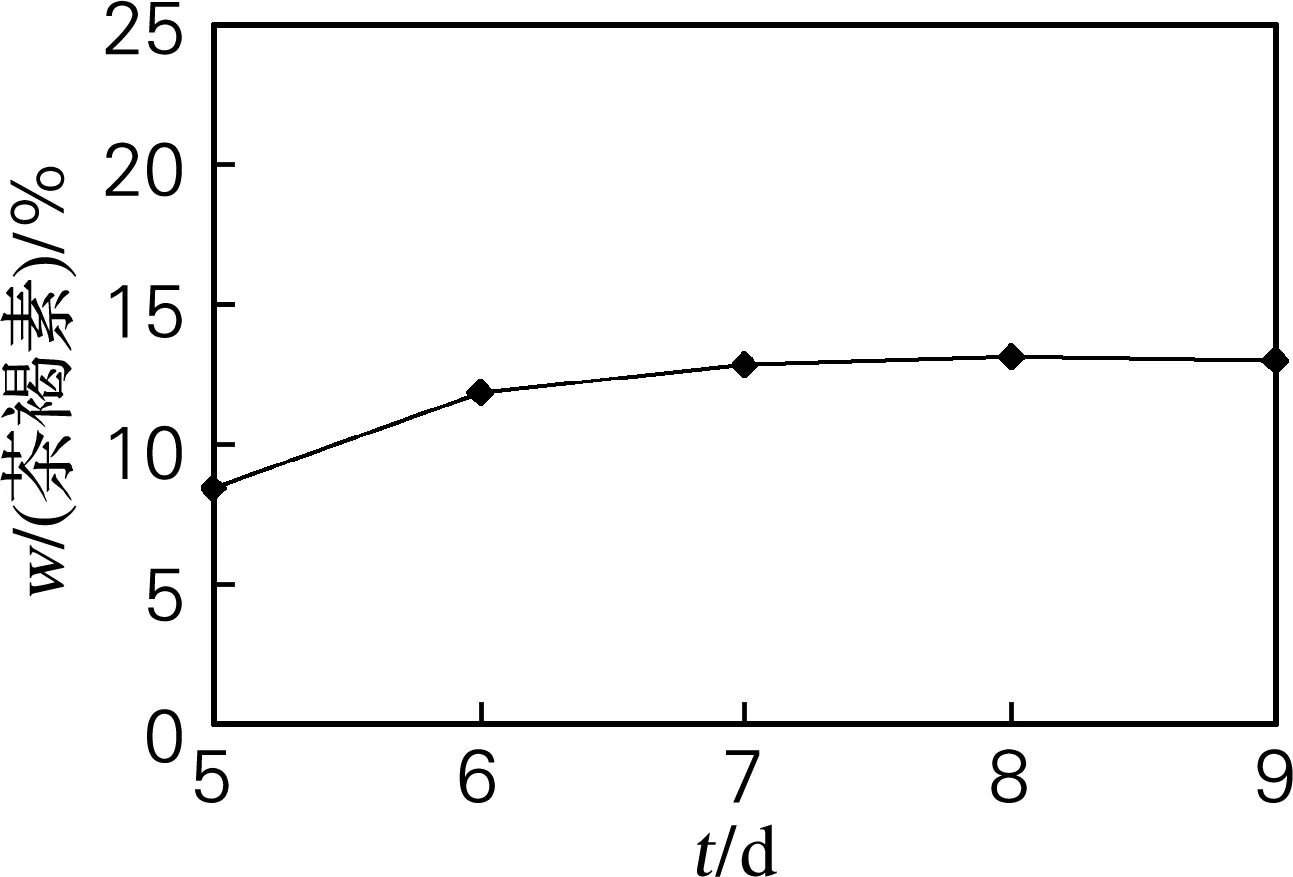
图1 不同发酵时间的发酵结果
Fig.1 Result of fermentation on different fermentation time

图2 不同发酵温度的发酵结果
Fig.2 Result of fermentation on different fermentation temperature
2.3 发酵前后茶色素含量的变化
根据发酵条件优化的结果,称取普洱生茶10 g,加10 mL去离子水润湿,经100 ℃沸水灭菌30 min后,于无菌室接种霉菌fxk-01,接种量为5%,在35 ℃培养箱中培养发酵8 d后测茶色素质量分数。结果见表1,普洱生茶发酵前后茶红素和茶黄素质量分数分别降低了73.35%和66.84%,茶褐素含量提高了8.23倍,原因是茶红素和茶黄素包括其前体茶多酚在微生物分泌的酶的作用下进一步氧化缩合生成了茶褐素,造成茶褐素含量大幅升高。

表1 茶叶发酵前后茶色素质量分数的变化
2.4 提取条件的单因素试验
2.4.1 提取次数的优化
选用水为提取溶剂,称取发酵后普洱生茶10 g,按料液比1∶10,100 ℃沸水提取20 min,茶汤经过滤、冷却至室温后用等体积正丁醇萃取3 min,取下层水溶液稀释80倍,以水做空白,于380 nm处测OD值,共提取3次。试验结果如图3所示,普洱生茶在提取2次后茶褐素含量下降明显,考虑试验原料和后续的处理工作,合理的提取次数为2次。

图3 普洱生茶不同提取次数提取的结果
Fig.3 Result of extraction of pu′er tea with different extracting times
2.4.2 提取温度的优化
称取发酵后普洱生茶10 g,提取溶剂为水,料液比1∶10,提取时间20 min,提取2次,仅改变提取温度,分别为70、80、90、100 ℃。茶汤减压浓缩干燥后茶粉用100 mL去离子水溶解,等体积正丁醇萃取3 min,取下层水溶液1 mL稀释80倍,以水做空白,在380 nm处测OD值。结果如图4所示,80 ℃以后茶褐素提取率相差不大,因此考虑到生产成本和生产安全,最优的提取温度为80 ℃。
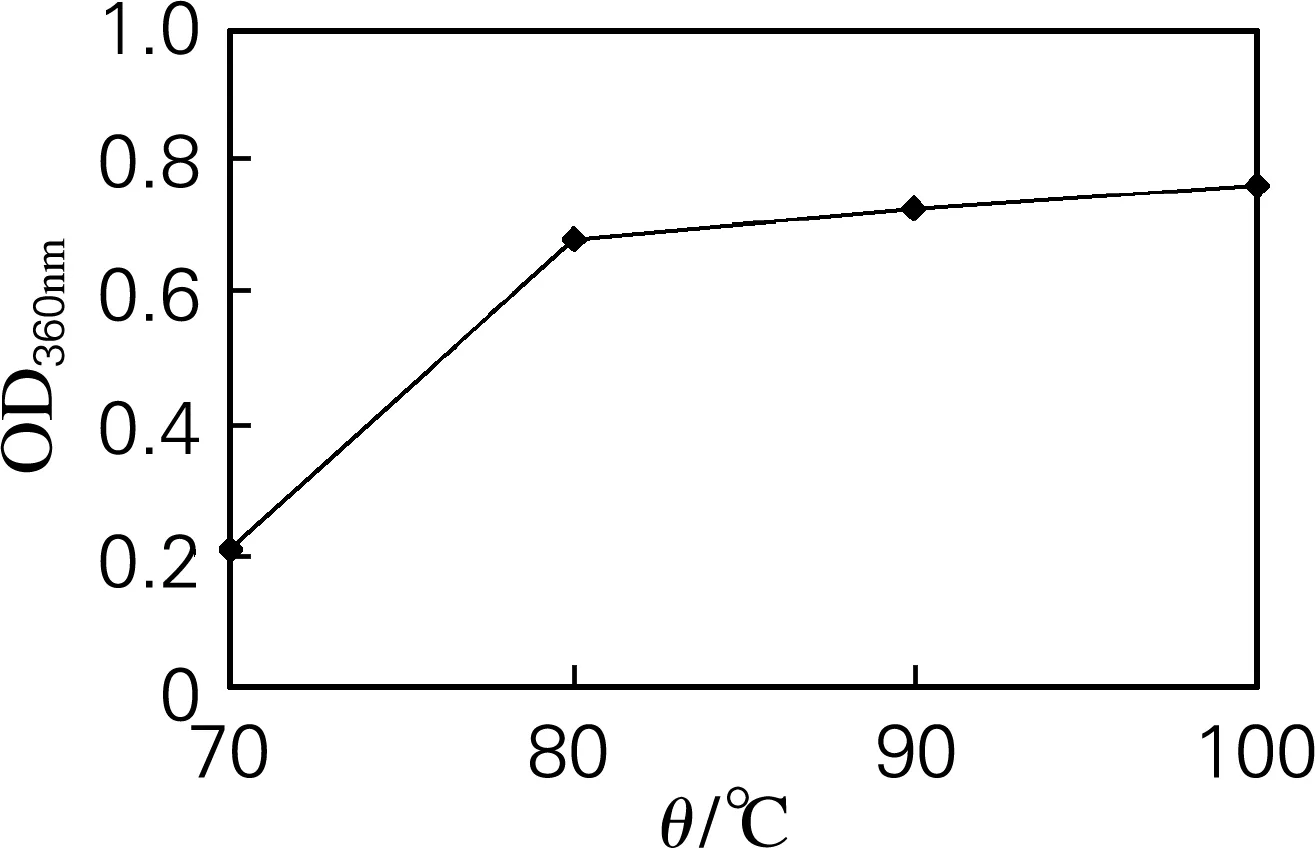
图4 不同提取温度的提取结果
2.4.3 提取时间的优化
称取发酵后普洱生茶10 g,提取溶剂为水,料液比1∶10,提取温度80 ℃,提取2次,仅改变提取时间,分别为10、20、30、40 min进行试验。茶汤减压浓缩干燥后茶粉用100 mL去离子水溶解,等体积正丁醇萃取3 min,取下层水溶液1 mL稀释80倍,以水做空白,在380 nm处测OD值。试验结果如图5所示,提取时间从10 min到30 min 时,茶褐素的提取率不断增大,超过30 min 继续提取,提取率基本不变。故采用提取时间为30 min。

图5 不同提取时间提取的结果
2.4.4 料液比的优化
称取发酵后普洱生茶10 g,提取溶剂为水,采用提取温度80 ℃提取30 min,共提取2次,仅改变料液比,分别为1∶10、1∶20、1∶30、1∶40。茶汤经减压浓缩干燥后茶粉用100 mL去离子水溶解,等体积正丁醇萃取3 min,取下层水溶液1 mL 稀释80倍,以水做空白,在380 nm处测OD值。试验结果如图6所示,当料液比低于1∶30时,随着料液比的增加,茶褐素的提取率明显增高,当料液比1∶40时增幅较小。又因为过高的料液比会给后续一些工作如过滤、浓缩等带来麻烦,故最佳的料液比选择1∶30。

图6 不同料液比提取的结果
Fig.6 Result of extraction with different ratio of material and liquid
在最优发酵条件下发酵普洱生茶,并在最佳提取条件下提取过滤后获得茶汤,将茶汤经乙酸乙酯萃取2次,每次萃取5 min,除掉茶黄素;取下层用氯仿萃取3次,每次5 min,除去咖啡碱;取水层再用正丁醇萃取2次,每次萃取3 min,除去茶黄素和茶红素,水层减压浓缩后烘干至固体,样品得率约为10%,分光光度法测得其中茶褐素质量分数为826.4 mg/g。
2.5 提取条件的正交试验
为进一步优化提取条件,在单因素试验的基础上,选取次数、温度、时间、料液比这4个因素做四因素三水平正交试验,结果见表2、3。
表2 茶褐素提取条件正交试验结果
Tab.2 Result of orthotropic test about extraction conditions of TBs

因素次数θ/℃t/min料液比OD值试验111(75)1(25)1(1∶25)0.71试验212(80)2(30)2(1∶30)0.84试验313(85)3(35)3(1∶35)0.82试验421(75)2(30)3(1∶35)0.89试验522(80)3(35)2(1∶30)0.98试验623(85)1(25)1(1∶25)0.91试验731(75)3(35)2(1∶30)0.78试验832(80)1(25)3(1∶35)0.86试验933(85)2(30)1(1∶25)0.88均值10.7900.7930.8270.857均值20.9270.8930.8700.843均值30.8400.8700.8600.857极差0.1370.1000.0430.014
表3 茶褐素提取条件方差分析
Tab.3 Analysis of variance aboat extraction conditions of TBs

因素偏差平方和自由度F比F临界值显著性次数0.02929.6679.000*温度0.01625.3339.000时间0.00321.0009.000料液比0209.000误差02注:F0.1(2,2)=9.00。
通过正交方差表分析可以看出,各因素影响的重要性为次数、温度、时间、料液比,且次数对结果影响显著,温度和时间影响不显著,所以普洱生茶茶褐素的最佳提取条件为:提取温度为80 ℃,提取时间35 min,提取次数为2次,料液比为1∶30。
2.6 DPPH自由基的清除能力
以VC为阳性对照,测定茶褐素对DPPH自由基的清除能力,结果如图7所示,在所测浓度范围内,相同浓度茶褐素的清除DPPH自由基能力强于VC。当质量浓度为50 μg/mL时,茶褐素提取物清除率达94.12%,并随着茶褐素提取物浓度的增加,清除能力增强。由此可见,茶褐素提取物对DPPH自由基有很强的清除能力。

图7 茶褐素与VC清除DPPH自由基能力的比较
Fig.7 Comparison on DPPH radical scavenging capacity of the extract from TBs and VC
3 结 论
(1)以普洱生茶为原料进行发酵的最优条件为:发酵温度35 ℃,发酵时间8 d,发酵完成后茶褐素含量较未发酵普洱生茶提高了8.23倍。
(2)普洱生茶茶褐素的最佳提取条件为:提取温度为80 ℃,提取时间35 min,提取次数为2次,料液比为1∶30。
(3)在所测浓度范围内,相同浓度茶褐素提取物的清除DPPH自由基的能力高于VC,且随着提取物浓度的增加而增强,这说明茶褐素提取物有很强的抗氧化活性。
[1] 吕虎,孔庆友,冷和平,等. 茶色素制取及化学组成[J]. 林产化学与工业, 2000, 20(4):63-66.
[2] 程启坤. 红茶色素的系统分析方法[J]. 中国茶叶, 1981(1):24-30.
[3] BAILEY R G, NURSTEN H E, DOWELL I. Isolation and analysis of a polymeric thearubigin fraction from tea[J]. Journal of the Science of Food and Agriculture, 1992, 59:365-375.
[4] SARKAR A, BHADURI A. Black tea is a powerful chemopreventor of reactive oxygen and nitrogen species: comparison with its individual catechin constituents and green tea[J]. Biochemical and Biophysical Research Communications, 2001, 284(1):173-178.
[5] 萧伟祥,钟瑾,萧慧,等. 茶色素形成机理与制取[J]. 茶叶科学, 1997, 17(1):1-8.
[6] 萧伟祥,钟瑾,萧慧,等. 制茶发酵中茶色素形成生化机理[J]. 福建茶叶, 1998(3):8-12.
[7] 黄意欢. 茶学实验技术[M]. 北京:中国农业出版社, 1995:51-53.
[8] 王会,郭立,谢文磊. 抗氧化剂抗氧化活性的测定方法[J]. 食品与发酵工业, 2006, 32(3):92-98.

