18F-FDG PET/CT对骨肉瘤新辅助化疗疗效评估的进展
李洪涛 沈赞
上海交通大学附属第六人民医院肿瘤内科,上海 200233
骨肉瘤是青少年原发性恶性骨肿瘤中发病率最高的肿瘤。由于新辅助化疗的治疗进展,使得原本<20%的5年生存率提高到60%~70%[1-2],而骨肉瘤在新辅助化疗后的原发灶肿瘤组织坏死率(以下简称坏死率)对于患者的预后具有决定性意义,根据Salzer-Kuntschik标准,当坏死率≥90%时预后较好,而坏死率<90%时,预后相对较差[3-5]。对于那些经标准化疗方案治疗后未达到较好坏死率的患者,需要增加化疗次数以取得较好的反应性。通过病理学检验坏死率是目前验证新辅助化疗疗效的主要手段,因病理评估多为术后回顾性评估,故有其局限性。因此,寻找有效的检测手段或检测指标在手术前预测化疗疗效,并在术前及时调整治疗显得尤为重要。
预测化疗效果的检测方法主要有:分子标志和核医学联合影像检查。在分子标志中,诸如P糖蛋白、热休克蛋白等均显示对化疗疗效有一定预测性,但其临床应用价值尚待进一步研究[6-7]。在核医学和影像检测方面,18氟脱氧葡萄糖正电子发射断层显像(18-f1uoro-2-deoxy-D-glucose positron emision tomography-computed tomography,18F-FDG PET/CT)、MRI或两者联合评估显示出了独特价值。
18F-FDG PET/CT结合了代谢现象(PET)和解剖现象(CT)两方面的特征,能同时反应肿瘤病灶的状况,由于18F-FDG能被肿瘤细胞吸收并标示肿瘤细胞对糖代谢的活跃程度,因而可从一定程度上反应肿瘤细胞的状态。基于此原理,18F-FDG PET/CT检测手段已应用于评估多种肿瘤对新辅助化疗的反应性。目前已有多项研究证明了18F-FDG PET/CT能够对骨肉瘤新辅助化疗进行疗效评估。本文根据PET检测的不同参数对这些研究进行综述。
1 肿瘤-本底比值(tumor to normal background activity ratio,TBR)
TBR反映肿瘤组织相对正常对照组织的代谢活性程度,通过计算兴趣区域(region of interest,ROI)与该部位相同的对侧摄取值之比而得到,TBR是衡量肿瘤葡萄糖代谢活性和评估化疗效果的有效指标。
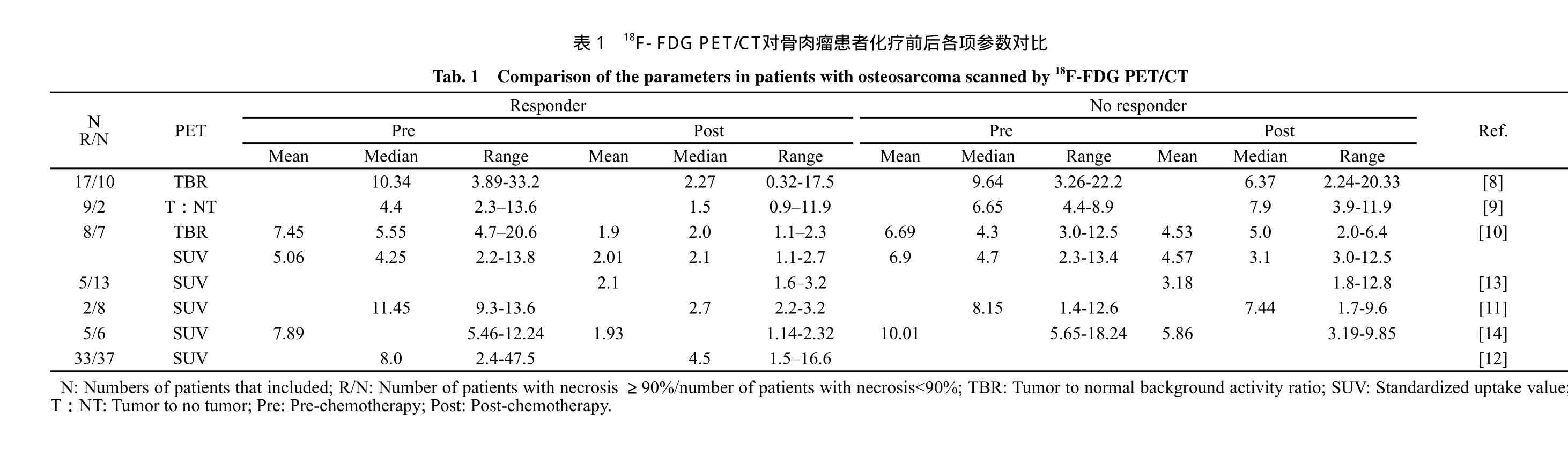
化疗后骨肉瘤患者的TBR较化疗前明显下降,这一点在化疗后坏死率高的患者中更为明显。Schulte等[8]成功地运用TBR的降低预测了骨肉瘤患者化疗后坏死率。根据Salzer-Kuntschik分级,27例患者经过COSS 86b 或COSS 96标准方案化疗后,有17例获得了良好的化疗效果,10例化疗效果不佳。通过比较化疗前及化疗后手术前患者的TBR发现,在化疗疗效好的患者中,TBR2(化疗后TBR)与TBRl(化疗前TBR)之差值下降约8个单位,而在坏死率较低的患者中,TBR2与TBR1之差值下降约3个单位,通过进一步分析,将TBR2与TBR1之比值等于0.6作为判断骨肉瘤坏死率高低的标准,所有化疗效果良好的患者以及10例化疗效果不理想患者中的8例都得到了准确的判断,其阳性预测值(positive predictive value,PPV)为89.5%,阴性预测值(negative predictive value,NPV)为100%。
Franzius等[9]运用类似指标T∶NT(tumor to no tumor)检测了11例骨肉瘤患者化疗前后T∶NT变化发现,在对化疗反应性好的患者中,其T∶NT在化疗后减少了约30%,而这一现象在化疗反应性差的患者中并未发现。因此将这一降低比例作为区分患者对化疗的反应性的临界值,即化疗后T∶NT降低比例>30%的患者化疗反应性较好。此项研究同时还发现,在接受放疗的患者中T∶NT亦能显著降低。
在国内的一项纳入15例骨肉瘤患者的研究中,通过对比化疗前后TBR比值和化疗后反应性发现,TBR2与TBR1比值与化疗反应性具有显著相关性,其中TBR2与TBR1比值<0.46的患者化疗反应性好,而比值>0.49的患者化疗反应性差[10]。
2 标准摄取值(standardized uptake value,SUV)
SUV是FDG PET衡量肿瘤细胞葡萄糖代谢的另一个重要参数,SUV是根据ROI的摄取值与FDG注射量及体重标准化而得到,SUV包括最大标准摄取值(SUVmax)和平均标准摄取值(SUVmean)。通常SUVmax值较SUVmean应用广泛,是鉴别肿瘤良恶性的有效指标,以SUVmax=2.0作为标准有着很好的灵敏性和特异性。
在对骨肉瘤化疗反应性比较中,SUV2(化疗后SUV)通常比SUV1(化疗前SUV)低,且SUV2与坏死率呈负相关,即SUV2越低,坏死率越高(表1)。Huang等[11]通过分析10例骨肉瘤患者化疗前后SUV值发现,平均SUV1为8.2,SUV2平均值为4.4。Choan等[12]对70例骨肉瘤患者分别在化疗前及手术前2周进行了PET扫描,经对比发现化疗后SUV2<2的患者在化疗反应性较好,对于SUV上限,研究发现SUV2>5的患者化疗反应性较差。
Hawkins等[13]在对18例骨肉瘤患者的治疗中发现,平均SUV1为8.2,平均SUV2则为3.3,同时发现SUV2与SUV1之比与化疗后坏死率差异有统计学意义(P<0.05),在坏死率高的患者中平均SUV2为2.1,坏死率低的患者则为3.3,而SUV2与SUV1之比则相应为0.47和0.59。Hamada等[14]对11例骨肉瘤患者化疗后SUV2进行比较后发现,在化疗后坏死率高的患者中,SUV2显著低于坏死率低的患者(1.93±0.50 vs 5.86±2.55),因而该作者将SUV2=2.5作为临界值来预测坏死率,其PPV与NPV均为100%。同时他们还发现在坏死率高的患者中,SUV2与SUV1之比显著高于坏死率低的患者(0.74±0.11 vs 0.26±0.39),故将SUV2与SUV1之比等于0.5作为临界值的PPV与NPV分别为80%和100%。
alue Ref.e v[10][8]][13][9[11][14][12]2.0-6.4tandardized uptak e0.33 3.0-12.5.9 1.8-12.8 1.7-9.6 3.9-11 3.19-9.85 Rang : SUV Median 5.0 Post 7.93.17.44 er Mean No respond 2.24-2 4.53 4.57 3.18 5.86 4.4-8.9 3.26-2-18.24 3.0-12.5 2.3-13.4 Range2.2 1.4-12.6 5.65 or to normal background activity ratio; S um: T Pre Median 9.64 6.654.34.78.15BR 90%; T Mean 6.696.9 10.01sis<e 6.37 ith necro 11 Rang 0.32-17.5.9 0.9-1.1-2.3 1.1-2.7 1.6-3.2 2.2-3.2 1.14-2.32 1.5-16.6 stPo Median 2.271.52.02.12.74.5 90%/number of patients w 1.92.012.11.93sis ≥onder Mean ith necro e Resp Rang 3.89-33.2 13.62.24 2.3-20.6otherapy.4.7-2.2-13.8 9.3-13.6 5.46-1 2.4-47.5 b er of patients wost: P ost-chem Pre Median4.3105.55 4.25 11.45 8.0um: N/N RNT4.4 Mean th erapy; P 7.45 5.06 7.89 bers of patients that includ ed; Rre: P re-chem oor; P TPE TB T∶TB RVVVVV SU SU SU SU SU o r to no tumum: T 17/10 33/37um NR/N 9/28/7 5/13 2/85/6 N: NNTT∶TC/TEP GDF-F81比y b对de数n n参acs项a各mo后cr前aso疗et化s o者ht患i w瘤 st肉ne骨ita对Tp C/ ni s TEre P te GD m a F-ra F p e 8 1ht 1 fo n表osirapmoC 1 .baT
上述研究中,SUV2与SUV1之比显示出了与坏死率的相关性及一定的预测价值,但与上述研究结论不同,Gaston等[15]研究发现,虽然将SUV2=2.5作为临界值显示出与坏死率的显著相关性(P<0.05),但SUV2与SUV1之比与坏死率的相关性差异无统计学意义(P=0.07)。同样,Ye等[10]也没有发现SUV2与SUV1的比值对坏死率的预测价值。Hawkins等[13]也将SUV2<2及SUV2与SUV1之比<0.5作为预测化疗疗效的预测因子,但效果并不理想。另外Huang等[11]通过对比PET摄取值计算平均坏死率为22%,这与组织学平均坏死率54.5%相比有一定差距。这些研究说明,SUV在检测肿瘤活性方面仍存在一定局限性,因此需要进一步探索其他参数与之联合或相互补充,完善评估系统。
3 其他参数
3.1 肿瘤代谢体积(metabolic tumor volume,MTV)和注射剂量比(percentage of injection dose,%ID)
由于Gaston等[15]研究发现SUV值在化疗前后的改变对于预测坏死率无显著相关性,提出可以通过MTV参数来进行补充,MTV是通过对ROI的三维像素计算而来,MTV在化疗后下降超过50%,即MTV2(化疗后MTV)与MTV1(化疗前MTV)之比<0.5则被视为反应良好,故将MTV2与MTV1之比<0.5作为判断坏死率的临界值(P<0.05),其PPV和NPV分别为100%和67%,然而MTV2与MTV1之比并非越低越好,当MTV2与MTV1之比<0.1时,则与坏死率的相关性差异无统计学意义(P=0.48)。Gaston等[15]同时引入了另外一个观察指标:%ID,这个指标是指在肿瘤内聚集的18F-FDG占总注射量的百分比,作者通过对比该参数前后比值发现,%ID2(化疗后%ID)与%ID1(化疗前%ID)之比<0.3(%ID化疗后下降70%)与坏死率显著相关,其PPV和NPV分别为90%和78%。
3.2 肿瘤代谢体积变化比(metabolic volume change ratio,MVCR)
Choan等[12]对70例骨肉瘤患者分别在化疗前及手术前2周进行了PET扫描,经对比发现,化疗后SUV2<2的患者化疗反应性较好,而SUV2>5的患者化疗反应性较差,对于那些2<SUV2<5的患者,该作者提出可以通过联合MRI检查计算出MVCR值来确定,即MVCR<0.65提示化疗反应性好,这一预测模型的PPV和NPV分别为97%和95%。
MVCR计算公式[12]:
SUV change ratio (SCR)=SUV2/SUV1;
Volume change ratio (VCR)=TVafterchemotherapy/TVbeforechemotherapy;
Metabolic volume change ratio (MVCR)=SCR×VCR。
4 总结
综上所述,在评价骨肉瘤新辅助化疗疗效方面,18F-FDG PET/CT是一项无创、安全的可选手段,相比检测分子标志物更加直观、可靠。在已知的18F-FDG PET/CT评估系统中,TBR2、SUV2的下降、TBR2与TBR1之比及SUV2与SUV1之比值与坏死率呈正相关,但其对坏死率的预测价值仍存在一定争议(表2)。
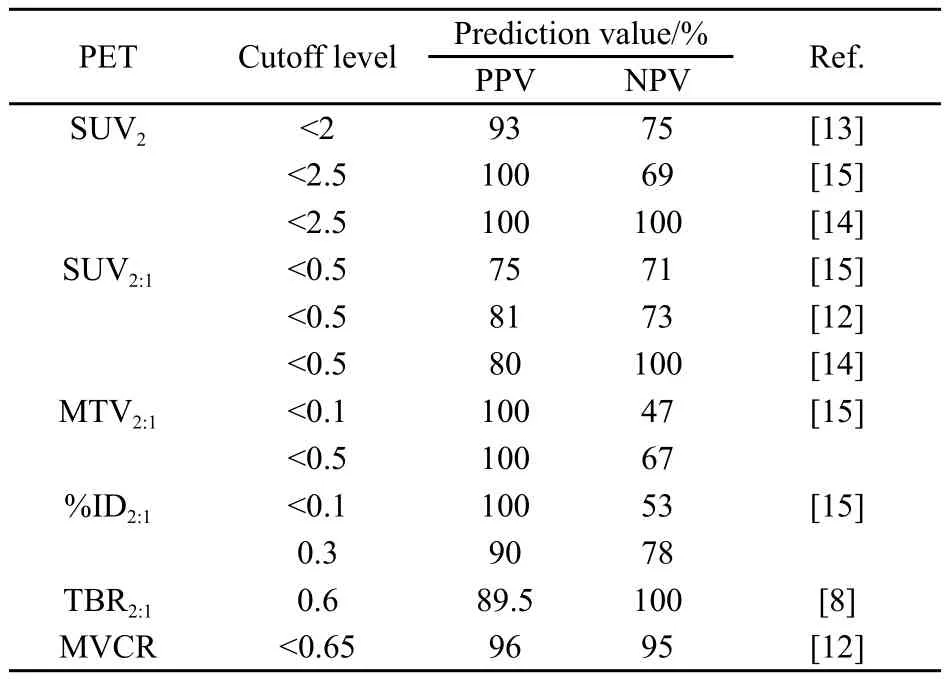
表2 18F-FDG PET/CT对骨肉瘤患者化疗前后各项参数预测值对比Tab.2 Comparison of the predictive value of 18F-FDG PET/CT parameters in patients with osteosarcoma
目前大多数研究者均发现,化疗后SUV2<2(或2.5)及SUV2与SUV1之比<0.5的患者提示化疗反应性较好,而对于处于灰区(2<SUV2<5)的患者可利用FDG PET的其他参数进行综合预测,MTV、MVCR及%ID似乎增强了18F-FDG的预测价值。然而,由于技术限制上述研究仍有不足之处:①TBR和SUV均为半定量指标,在衡量病灶代谢活性方面的定性分析上存有局限性[16],有待于新的分析方法或新的显像剂来弥补这一缺陷;②需要指出的是,这些研究中大部分由于样本量较小,故其统计学可信度尚待验证,因而未来需要大样本的对照研究进一步评估这一检测方法的有效性。
[1] WILKINS R M, CULLEN J W, CAMOZZI A B, et al.Improved survival in primary nonmetastatic pediatric osteosarcoma of the extremity[J].Clin Orthop Relat Res, 2005, 438: 128-136.
[2] BACCI G, FERRARI S, BERTONI F, et al.Long-term outcome for patients with nonmetastatic osteosarcoma of the extremity treated at the istituto ortopedico rizzoli according to the istituto ortopedico rizzoli/osteosarcoma-2 protocol: an updated report[J].J Clin Oncol, 2000, 18(24): 4016-4027.
[3] BIELACK S S, KEMPF-BIELACK B, DELLING G, et al.Prognostic factors in high-grade osteosarcoma of the extremities or trunk: an analysis of 1 702 patients treated on neoadjuvant cooperative osteosarcoma study group protocols[J].J Clin Oncol, 2002, 20(3): 776-790.
[4] RAYMOND A K, CHAWLA S P, CARRASCO C H, et al.Osteosarcoma chemotherapy effect: a prognostic factor[J].Semin Diagn Pathol, 1987, 4(3): 212-236.
[5] SALZER-KUNTSCHIK M, DELLING G, BERON G, et al.Morphological grades of regression in osteosarcoma after polychemotherapy-study COSS 80[J].J Cancer Res Clin Oncol, 1983, 106(Suppl): 21-24.
[6] TRIEB K, LECHLEITNER T, LANG S, et al.Heat shock protein 72 expression in osteosarcomas correlates with good response to neoadjuvant chemotherapy[J].Hum Pathol,1998, 29(10): 1050-1055.
[7] PAKOS E E, IOANNIDIS J P.The association of P-glycoprotein with response to chemotherapy and clinical outcome in patients with osteosarcoma.A meta-analysis[J].Cancer, 2003, 98(3): 581-589.
[8] SCHULTE M, BRECHT-KRAUSS D, WERNER M, et al.Evaluation of neoadjuvant therapy response of osteogenic sarcoma using FDG PET[J].J Nucl Med, 1999, 40(10):1637-1643.
[9] FRANZIUS C, SCIUK J, BRINKSCHMIDT C, et al.Evaluation of chemotherapy response in primary bone tumors with F-18 FDG positron emission tomography compared with histologically assessed tumor necrosis[J].Clin Nucl Med,2000, 25(11): 874-881.
[10] YE Z, ZHU J, TIAN M, et al.Response of osteogenic sarcoma to neoadjuvant therapy: evaluated by 18F-FDG-PET[J].Ann Nucl Med, 2008, 22(6): 475-480.
[11] HUANG T L, LIU R S, CHEN T H, et al.Comparison between F-18-FDG positron emission tomography and histology for the assessment of tumor necrosis rates in primary osteosarcoma[J].J Chin Med Assoc, 2006, 69(8): 372-376.
[12] Cheon G J, KIM M S, LEE J A, et al.Prediction model of chemotherapy response in osteosarcoma by 18F-FDG PET and MRI[J].J Nucl Med, 2009, 50(9): 1435-1440.
[13] HAWKINS D S, RAJENDRAN J G, CONRAD E U 3rd, et al.Evaluation of chemotherapy response in pediatric bone sarcomas by [F-18]-fluorodeoxy-D-glucose positron emission tomography[J].Cancer, 2002, 94(12): 3277-3284.
[14] HAMADA K, TOMITA Y, INOUE A, et al.Evaluation of chemotherapy response in osteosarcoma with FDG-PET[J].Ann Nucl Med, 2009, 23(1): 89-95.
[15] GASTON L L, DI BELLA C, SLAVIN J, et al.18F-FDG PET response to neoadjuvant chemotherapy for Ewing sarcoma and osteosarcoma are different[J].Skeletal Radiol, 2011.
[16] BOELLAARD R, KRAK N C, HOEKSTRA O S, et al.Effects of noise, image resolution, and ROI definition on the accuracy of standard uptake values: a simulation study[J].J Nucl Med, 2004, 45(9): 1519-1527.

