鹅细小病毒P C R检测方法的建立及初步应用
王 倩,鞠环宇,荆志强,李彦伟,王春媛,马 波,王君伟
(东北农业大学动物医学学院,哈尔滨 150030)
鹅细小病毒(Goose parvovirus,GPV)病是一种主要侵害雏鹅和雏番鸭的急性、亚急性、高度接触性传染病,其传染性强,死亡率高,部分病例在病鹅小肠段出现“香肠”状栓,是目前危害养鹅业的主要传染病之一[1]。一般认为,小鹅瘟根据流行病学、临床特征和剖检特点,可以做出初步诊断,但是,最急性型小鹅瘟、小鹅流感、鹅病毒性肠炎以及近年来新发现的鹅副粘病毒病等疾病均具有相似的临床和剖检特征[2-3]。为此,开展小鹅瘟的实验室诊断研究具有重要意义。
目前已建立了许多检测小鹅瘟病原的方法,如病毒分离试验、ELISA[4]、Dot-ELISA[5]、反向间接血凝抑制试验[6]、中和试验、核酸探针[7]等,其中ELISA对人员和试剂的要求较高,且需要特异性抗体,病毒分离和中和试验耗时较长,且鹅胚的不均一性对试验结果影响较大,总之这些方法在临床应用上都没有达到较满意的效果。PCR作为一种新的分子生物学实验技术,在疾病诊断中发挥着越来越重要的作用,该方法具有灵敏度高、快速特异、操作简便等优点。布日额[8]、姚笛[9]、刘家森[10]等建立了检测小鹅瘟的单重PCR方法,赵研[11]等建立了二重PCR方法,程安春建立了实时荧光定量PCR方法以及尚毅建立了LAMP方法,但这些方法都是以一株GPV为参考序列的[12-13]。本试验以NCBI上公布的7株为参考序列,旨在建立一种能够检测病料组织中所有GPV的特异性PCR方法,为临床诊断GPV感染和探索各组织器官中GPV的分布规律提供有效手段。
1 材料与方法
1.1 毒株和菌株
GPV-98E(毒价为 105.15ELD50/0.2 mL)、GPMV由本实验室保存,AIV-H5由中国农业科学院哈尔滨兽医研究所田国彬副研究员惠赠,DPV购自中国兽医药品监察所;感受态细胞TG1由本实验室制备。
1.2 仪器
PCR仪:Eppendorf公司;离心机5418型:Eppendorf公司;电泳仪Savant PS4000型:Promega公司产品;凝胶成像仪:Alpha Innotech Corporation产品;DK-8D型电热恒温水槽:上海一恒科技有限公司产品。
1.3 试剂
蛋白酶K(购自Merck公司);十二烷基磺酸钠(SDS)(购自Amresco公司);DNA Marker(购自北京全式金公司);PCR试剂、pMD18-T载体、鼠源反转录酶(M-MLVRT)(购自宝生物工程(大连)有限公司);组织/细胞总RNA快速抽提试剂盒(购自哈尔滨海基生物科技有限公司);多功能DNA纯化回收试剂盒(购自北京百泰克生物技术有限公司);其他试剂均为分析纯。
1.4 引物
1.4.1 GPV引物设计
根据Genbank发表的7株GPV的全序列,在相对保守的NS区设计了一对引物,引物完全落在7个全序列的保守区,引物之间为变异区。引物由上海生工生物工程有限公司合成。
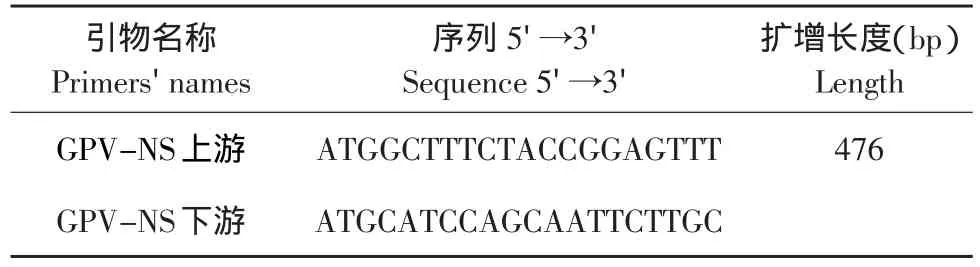
表1 GPV-NS基因所需引物Table1 Primers for amplifying GPV-NS gene
1.4.2 DPV、AIV和GPMV特异性引物
实验室保存。
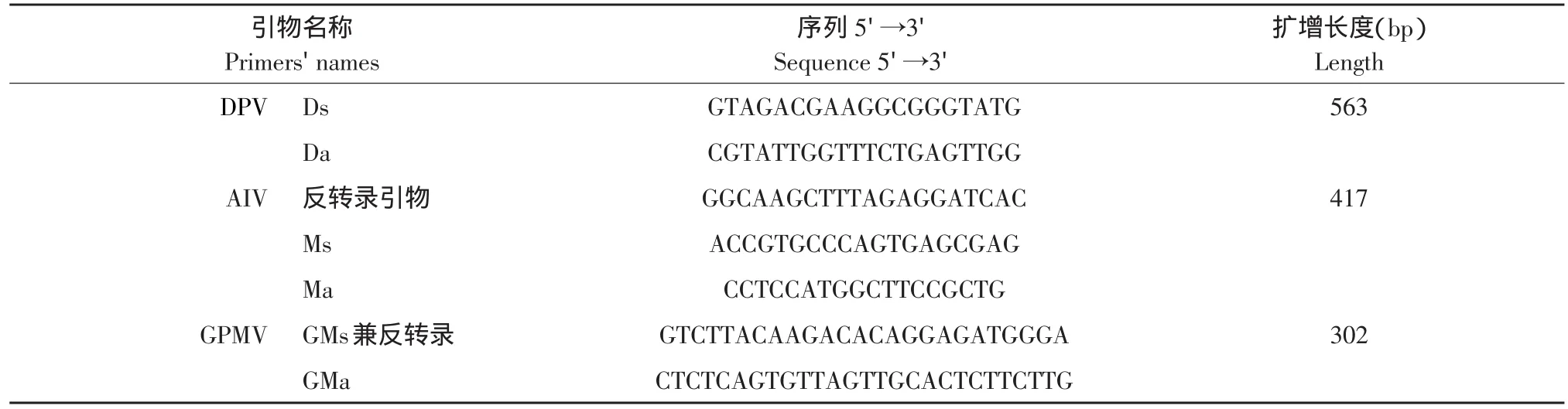
表2 特异性试验所需引物Table2 Primers for specificity assay
1.5 病毒核酸的提取
1.5.1 GPV和DPV DNA的提取
取尿囊液425 μL,加入蛋白酶K(10 mg·mL-1)25 μL,10%SDS 50 μL,56 ℃水浴1 h,分别用酚/氯仿/异戊醇、氯仿各抽提一次,取上清加入1/10终体积的NaAc(3 mol·L-1,pH 5.2)和2倍体积的无水乙醇沉淀DNA,70%乙醇洗涤一次,干燥后溶于20 μL灭菌去离子水中,-20℃保存备用。
1.5.2 AIV和GPMV RNA的提取
参考试剂盒说明书进行。
1.6 反转录合成cDNA
以AIV和GPMV基因组RNA为模板,分别以GMs和AIV通用下游引物作为反转录引物,反转录体系为25 μL,过程如下:RNA模板11.0 μL,引物(50 pmol·μL-1)2.0 μL,70 ℃水浴 5 min,冰浴5 min,再加入 5×M-MLVRT Buffer 5.0 μL,dNTP(2.5 mmol·L-1)5.0 μL,RNAase抑制剂 1.0 μL,鼠源反转录酶(M-MLVRT)1.0 μL,42 ℃水浴 90 min,70℃水浴15 min,-20℃保存备用。
1.7 PCR扩增及产物检测
反应体系 25 μL:10×PCR Buffer 2.5 μL,2.5 mmol·L-1dNTP 2.0 μL,上下游引物(10 pmol·μL-1)各0.5 μL,模板1.0 μL,5 U·μL-1rTaq 0.2 μL,灭菌去离子水补足。反应条件:95℃预变性5 min;94℃变性30 s,55.2℃退火30 s,72℃延伸30 s,30个循环;72℃终延伸7 min,4℃终止反应。
取5 μL PCR产物与1 μL上样缓冲液混匀,以95 V恒定电压在0.8%琼脂糖凝胶中电泳15 min,以Trans 2K plusⅡ分析并扫描记录结果。
1.8 PCR产物的纯化、克隆及序列测定
将PCR产物在0.8%琼脂糖凝胶上进行电泳,切下目的条带按多功能DNA纯化回收试剂盒的使用说明回收目的DNA,将纯化的目的DNA 4.5 μL、pMD18-T载体0.5 μL和SolutionⅠ5 μL混匀,16℃连接过夜,转化TG1感受态细胞,挑取白色菌落接种含终浓度为50 μg·mL-1Amp+的5 mL LB液体培养基,37℃摇振培养12 h,经碱裂解法提取质粒,Bam HⅠ/HindⅢ双切鉴定为阳性质粒,送往上海生工测序。
1.9 PCR的敏感性试验
将原倍尿囊液用生理盐水做10倍倍比稀释(100~10-8),提取核酸后,用已建立的PCR方法进行扩增,以确定其敏感性。将提好的DNA测核酸浓度,用生理盐水做10倍倍比稀释,用已建立的PCR方法进行扩增,以确定其最小检出量。
1.10 PCR的特异性试验
用GPV-NS引物同时对GPV、DPV和AIV、GPMV的cDNA进行PCR扩增。
1.11 重复性试验
以上试验在相同的条件下重复3次以上,以验证结果的可靠性。
1.12 适应性试验
在不同地理位置对已知样品进行PCR检测,以验证此方法的可靠性。
1.13 临床应用
利用本试验所建立的PCR方法检测52份雏鹅病料,包括心、肝、肠等。具体步骤如下:将病料放于安瓶中,加3倍体积的PBS,用小剪子剪碎,转移到研磨器中研磨,上清转移到1.5 mL离心管中,反复冻融3次,离心取上清,按1.5.1步骤进行。
2 结果与分析
2.1 PCR扩增结果
PCR产物与DNA Marker比较,证实GPV DNA扩增大小为476 bp,与预期大小相符。

图1 PCR扩增PCV2-ORF2基因Fig.1 Result of PCR product
2.2 序列测定
结果表明克隆得到GPV-NS基因特异性引物扩增片段基因序列全长476 bp,与7株参考毒株相应区域相似性为98.42%。
2.3 PCR的敏感性试验
结果表明将尿囊液作105倍稀释,即0.2 mL含有100.15个ELD50,其最低能检出0.15个ELD50。
核酸浓度=OD260×50×稀释倍数/1 000=0.4196 μg·μL-1,最小检出4.194 pg核酸。
2.4 PCR的特异性试验
用NS引物同时对GPV和已知对照病毒的核酸进行扩增,除GPV核酸,其他均未扩增出任何条带,而对照病毒均已扩增出已知大小的特异性目的条带(特异性引物见表2)。
各特异性条带均已测序,与参考序列的同源性均高于94%以上。

图2 GPV-NS基因片段序列Fig.2 Sequence of GPV-NS gene

图3 敏感性试验结果Fig.3 Sensitive result of PCR detection
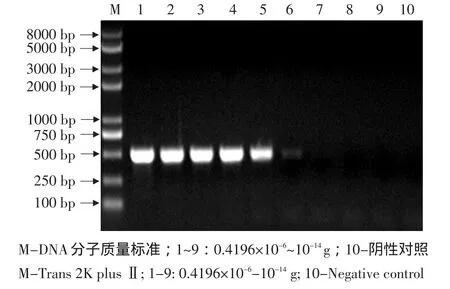
图4 核酸最低检出限量Fig.4 Result of minimum detectability of nucleinic acid
2.5 重复性试验
相同条件下重复以上试验3次,结果均一致。
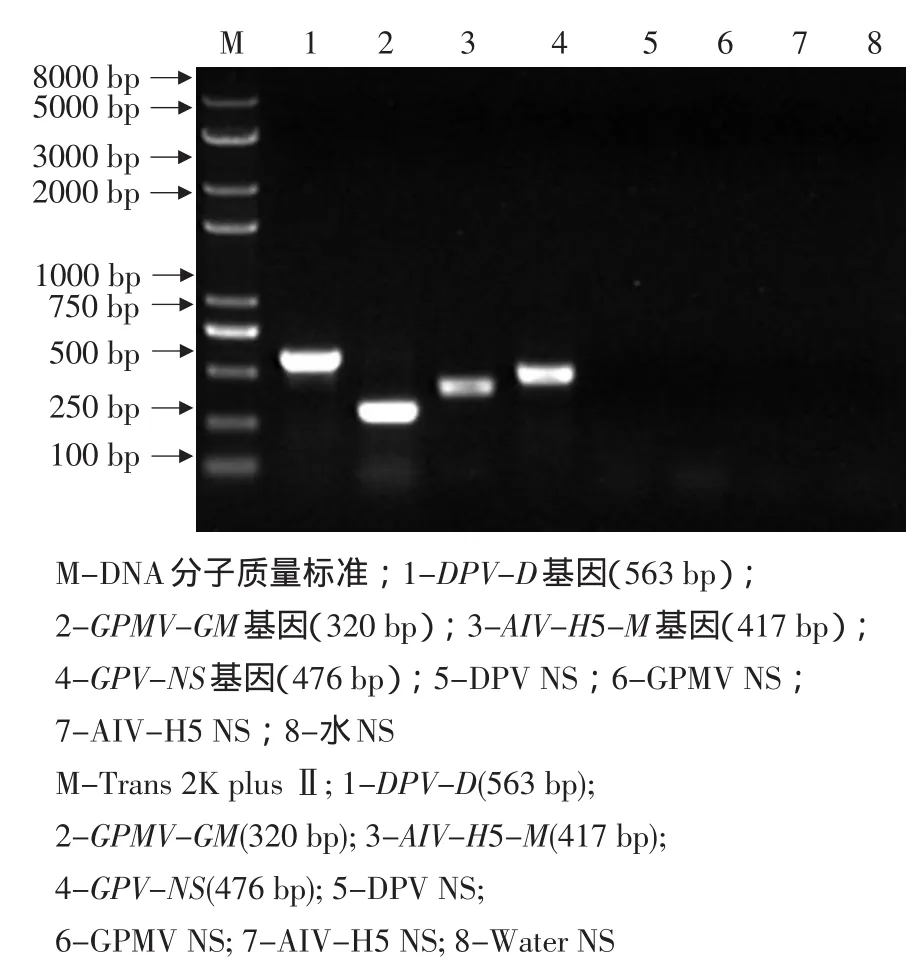
图5 特异性试验结果Fig.5 Specific result of PCR detection
2.6 适应性试验
在3个不同实验室采用该方法对已知阴阳性样品进行PCR扩增,结果与预期一致,表明其适应性良好。
2.7 临床应用
应用建立的PCR方法检测了52份临床感染的雏鹅病料,包括自然感染的17份和人工感染的35份,其中有50份阳性,其阳性检出率为96.2%,2份阴性为人工感染,证实此PCR方法能够直接检测多种临床病料中的鹅细小病毒的DNA,能初步用于临床应用。
3 讨论与结论
我国是世界养鹅第一大国,随着养鹅业的发展,鹅病也出现逐步增多的趋势,而小鹅瘟是危害养鹅业最严重的传染病之一。为了能更加有效地防治该病,采用新型快速诊断方法是控制该病行之有效的途径之一。目前小鹅瘟实验室诊断方法主要有病毒分离、琼扩试验和酶联免疫吸附试验等,这些方法特异性不高、耗时长,不能针对病原做出快速特异的诊断。国内外有许多学者建立了用于检测GPV的PCR方法[8-14],本试验建立的PCR方法具有特异性强、敏感性高、快速简便等特点,相信能在临床诊断中能有良好的应用前景。
在基因选择方面,本试验根据GenBank中7株GPV的全序列,选取了高度保守的NS区625~1 125 nt,以此设计了一对引物,以期能检测所有的GPV,测序结果也证实了这一点,不仅与7株全序列具有高度同源性,也与未公布全序列的NS区具有高度的同源性。
在摸索PCR最佳反应条件时发现本试验所用的检测引物在退火温度52~56℃均能较特异地扩增出目的条带,最终选择55.2℃为退火温度。此PCR方法可最低检测到0.15个ELD50和4.194 pg的核酸,可在病毒的毒力和毒量之间的关系上做个横向的参考。利用此对引物对已知DPV、AIV、GPMV的核酸进行扩增,结果均为阴性,表明此方法具有较高的特异性。
本试验从样品处理到完成整个检测过程大约需8 h,比常规的病毒分离方法的时间缩短了很多。本试验中应用建立的PCR方法检测了52份雏鹅病料,其中50份阳性,2份阴性属于人工感染病料,其原因可能是雏鹅本身体质较弱而病毒未达到脏器所致。在人工感染的病料中,在同一雏鹅上,心和肝都能检出,而肠偶尔检测不出,这可以为日后GPV检测病料选取上提供依据。该方法用于临床还有一定的距离,还需在大量临床样品检测中进行实践和摸索。
本研究是为了鹅细小病毒PCR检测试剂盒的研制奠定基础的,所以以上试验均按照农业部制定的《兽用诊断制品试验研究技术指导原则》所规定的主要技术指标实施的,但限于鹅胚的季节性,敏感性和特异性的部分试验尚未完成,将在后期继续完善。
[1]殷震,刘景华.动物病毒学[M].第2版.北京:科学出版社,1997:1165-1168.
[2]梁珊,黄吉辉.小鹅瘟病毒的分离与鉴定[J].畜牧与兽医,2002,34(5):32-33.
[3]王永坤,田慧芳,周继宏,等.鹅副粘病毒感染的研究[J].广西畜牧兽医,1999,20(6):7-10.
[4]Kardi V,Szegletes E.Use of ELISA procedures for the detection of Derzsy's disease virus of geese and of antibodies produced against it[J].Avian Pathology:Journal of the W.V.P.A,1996,25(1):25-34.
[5]汤明,廖德惠,谢镜怀.斑点酶联免疫吸附试验检测小鹅瘟病毒的研究[J].四川畜牧兽医,1994(3):5-6.
[6]孙怀昌,李俊宝,朱少璇,等.用抗小鹅瘟病毒单抗IgG建立反向间接血凝试验的研究[J].中国畜禽传染病,1989(Z1):44-46.
[7]段玉友,崔治中,王永坤.鹅细小病毒核酸探针的制备和应用[J].中国畜禽传染病,1993(5):37-39.
[8]布日额,王君伟,吴金花,等.GPV野毒株的分离及PCR检测方法的应用[J].中国预防兽医学报,2003,25(6):469-472.
[9]姚笛,张勇,朱战波,等.应用PCR方法检测鹅细小病毒感染[J].黑龙江八一农垦大学学报,2006,18(3):64-67.
[10]刘家森,姜骞,司昌德,等.番鸭细小病毒与鹅细小病毒PCR鉴别诊断方法的建立[J].中国兽医科学,2007,37(6):469-472.
[11]赵妍,王君伟,邢明伟,等.二重PCR检测鸭瘟病毒和鹅细小病毒的初步研究[J].中国预防兽医学报,2007,29(9):710-713.
[12]Yang J L,Cheng A C,Wang M S,et al.Development of a fluorescent quantitative real-time polymerase chain reaction assay for the detection of Goose parvovirus in vivo[J].Virology Journal,2009,6:142.
[13]尚毅,董嘉文,孙敏华,等.鹅细小病毒LAMP快速检测方法的建立[J].华南农业大学学报,201,32(1):98-102,107.
[14]Limn C K,Yamada T,Nakamura M,et al.Detection of goose parvovirus genome by polymerase chain reaction:distribution of goose parvovirus in muscovy ducklings[J].Virus Research,1996,42(1-2):167-172.

