低温诱导甜菜(Beta vulgaris L.)Ty7Br600基因的Northern blotting和Southern blotting分析
戴建军,程大友,常 缨,李彩凤,闫桂萍,马凤鸣
(1.东北农业大学资源与环境学院,哈尔滨 150030;2.哈尔滨工业大学食品学院,哈尔滨 150001;3.东北农业大学生命科学学院,哈尔滨 150030;4.东北农业大学农学院,哈尔滨 150030)
甜菜(Beta vulgaris L.)是二年生作物,通常情况下第一年进行营养生长,第二年经春化作用后块根发芽、抽薹。但是,由于某些原因甜菜也会出现当年抽薹的现象,称为早抽薹。早抽薹植株消耗大量光合产物用于生殖生长,影响块根增长和糖分积累,致使块根产量减产可达20%,含糖率甚至可降低1.6%,工艺品质差,不耐贮藏,严重影响甜菜的生产。国内外研究认为遗传与环境因素都能影响甜菜抽薹。二年生甜菜抽薹需要低温和长日照才能表达[1-2]。对于一定的甜菜品种,早抽薹主要是低温的累积作用继之以长日照或低温与长日照相伴的诱导结果[3-5]。二年生甜菜幼苗在0~10℃温度下,连续光照,可以诱导其抽薹[6]。Barzen等首先用RFLP方法绘制了甜菜重要农艺性状的染色体连锁图谱,抽薹基因B位于xxpKP826标记之间[7];Schondelmaier等将以上连锁标记确定在II号染色体上[8]。El-Mezawy等用AFLP分子标记方法筛选到17个距显性等位基因位点B不到3.2 cM的标记位点,其中有2个标记距B基因只有0.14和0.23 cM,还有2个标记为0.5 cM[9]。Abe等将甜菜抽薹前的生长阶段分为植物对低温感应阶段(春化阶段,要求低温性的基因起作用)和环境因子感应阶段(后春化阶段),感应日照及温度的基因起作用。通过传统的杂交试验,已经发现影响抽薹性几个主要基因,如一年生甜菜抽薹基因B、B'基因的等位基因易抽薹基因和晚抽薹基因lb[2,10],但至今对甜菜抽薹基因片段序列及其特性的报道还很少。
本研究在利用代表性差异分析cDNA-RDA技术克隆了低温诱导的甜菜幼苗差异表达基因片段和cDNA的末端快速扩增(Rapid amplification of cDNA ends)的基础上获得的Ty7Br600基因片段序列,进行Northern和Southern杂交分析。探讨了二年生甜菜当年抽薹的相关基因Ty7Br600的特性,为揭示二年生甜菜当年抽薹的分子机理以及甜菜生产提供理论依据。
1 材料与方法
1.1 植物材料的培养与低温诱导
二年生栽培甜菜甜研7号(Ty7),由东北农业大学作物栽培系提供。
Ty7甜菜种子在室温下浸种7 h,置于培养皿中25℃恒温培养24~48 h,萌发后置2~4℃低温处理72 d,光照16 h,诱导抽薹。以25℃恒温箱中萌发2~3 d的幼苗为对照。
1.2 RNA提取
将诱导抽薹前、后采集的甜菜茎尖样品,按照Trizol试剂盒(GibcolBRL公司)操作程序提取茎尖RNA。具体方法参见文献[11]。进一步通过1%琼脂糖凝胶电泳检测RNA完整性。
1.3 Northern杂交分析
甜菜幼苗分别于低温诱导前后进行采样,Trizol提取总RNA,分别取等量的总RNA进行甲醛变性琼脂糖凝胶分离,并转移到硝酸纤维素膜上,烘干,42℃预杂交3 h。以Ty7的cDNA为模板,根据文献[12-13]克隆的Ty7Br600序列结果设计A49(5'CGAAAGCGGCATAGCAAAGGAA 3')和B75(5'ACATAAGCGCAGCCAGTAACAT 3')为上、下游引物,进行PCR扩增,回收扩增片段后,用Promega公司的随机引物标记Kit Prime-a-Gene®Labeling System,以α-32P-dATP标记,杂交及杂交后洗涤。将洗好的膜在空气中稍晾干后,用保鲜膜包好,在暗室中定位于暗盒中,做好标记,-70℃放射自显影3~7 d。经显影、漂洗、定影获得杂交结果,参照文献[11]程序。
1.4 Southern杂交分析
用SDS法提取甜菜幼苗DNA,取约16 μg基因组DNA,用Eco RⅠ、HindⅢ进行酶切,电泳,转膜至硝酸纤维素膜,烘干,预杂交。以克隆的全长cDNA片段为探针,探针标记、杂交及杂交后洗涤,放射自显影,参照文献[11]程序。
2 结果与分析
2.1 Northern杂交分析
2.1.1 探针的制备
以Ty7的cDNA为模板,以A49和B75为上、下游引物,进行PCR扩增,扩增回收的片段回收后,随机引物标记后作探针。琼脂糖电泳检测结果见图1。
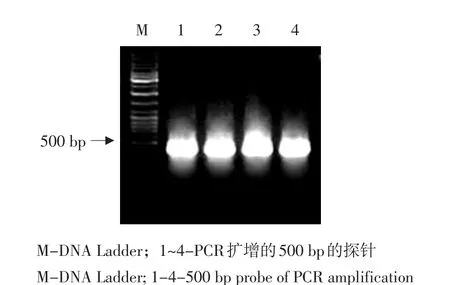
图1 探针的PCR扩增Fig.1 PCR amplification of the probe
2.1.2 Northern印记杂交
以PCR扩增获得差别表达基因片段,按随机引物标记法制成探针,并用来与未诱导和诱导培养的甜菜幼苗RNA群体进行Northern杂交。结果在低温诱导培养的甜菜幼苗的RNA群体中,出现较强的杂交条带,而在未诱导培养的甜菜幼苗的RNA群体中,则没有阳性杂交条带出现(见图2)。Northern杂交试验结果说明,Ty7Br600这一序列有可能是二年生甜菜幼苗经低温诱导处理之后被诱导特异表达的与抽薹相关的新基因序列。
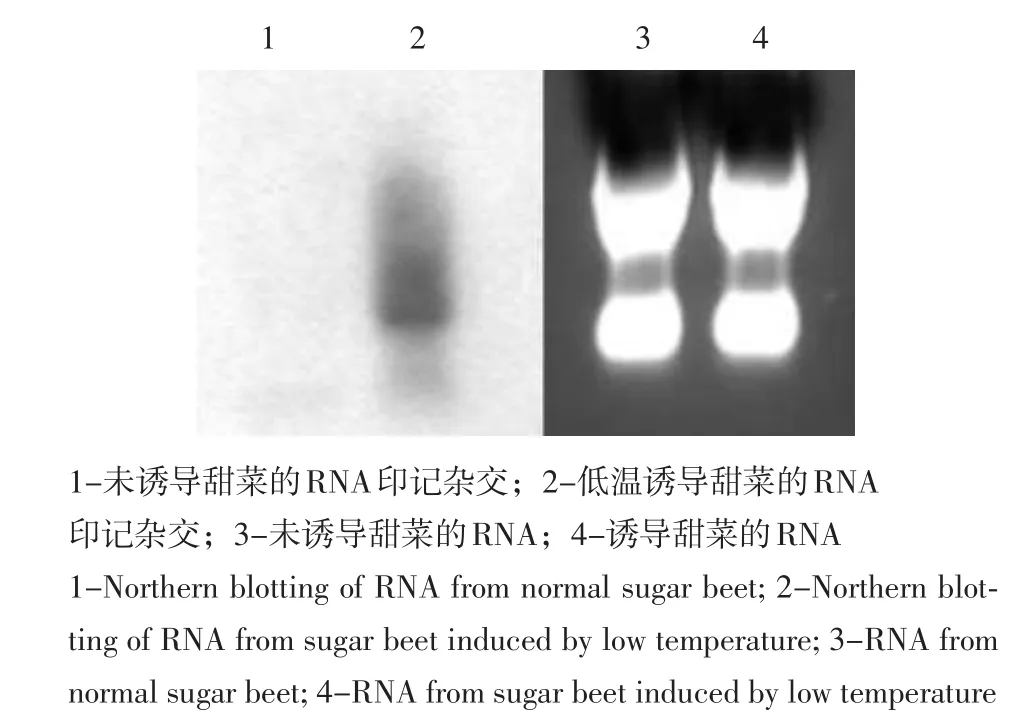
图2 Northern印记杂交Fig.2 Northern blotting hybridization
2.2 Southern杂交分析
2.2.1 DNA的提取及纯化
用SDS法提取甜菜叶片基因组DNA,进行0.8%琼脂糖凝胶电泳,结果见图3。
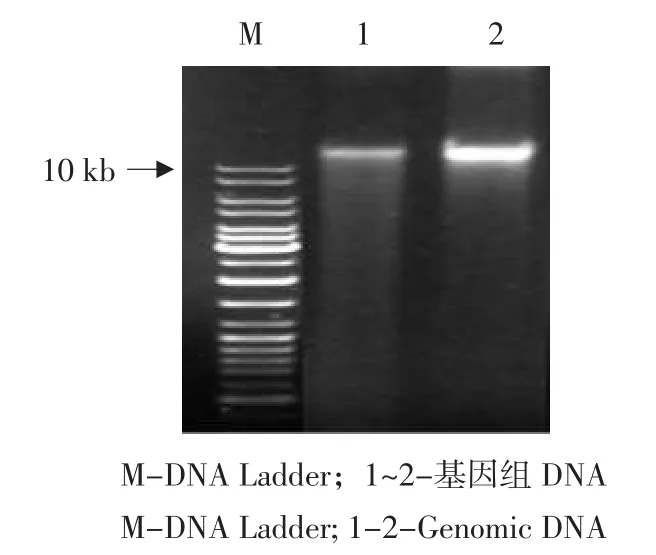
图3 甜菜叶片基因组DNA的提取Fig.3 Isolation of genomic DNA of Beta vulgaris L.
由图3可知,甜菜基因组DNA为10kb以上,提取纯化后的DNA无降解,完全可以满足实验要求。
2.2.2 DNA的限制性内切酶酶切
分别用Eco RⅠ,Bam HⅠ和HindⅢ对Ty7 DNA进行酶切,琼脂糖电泳结果如图4所示。
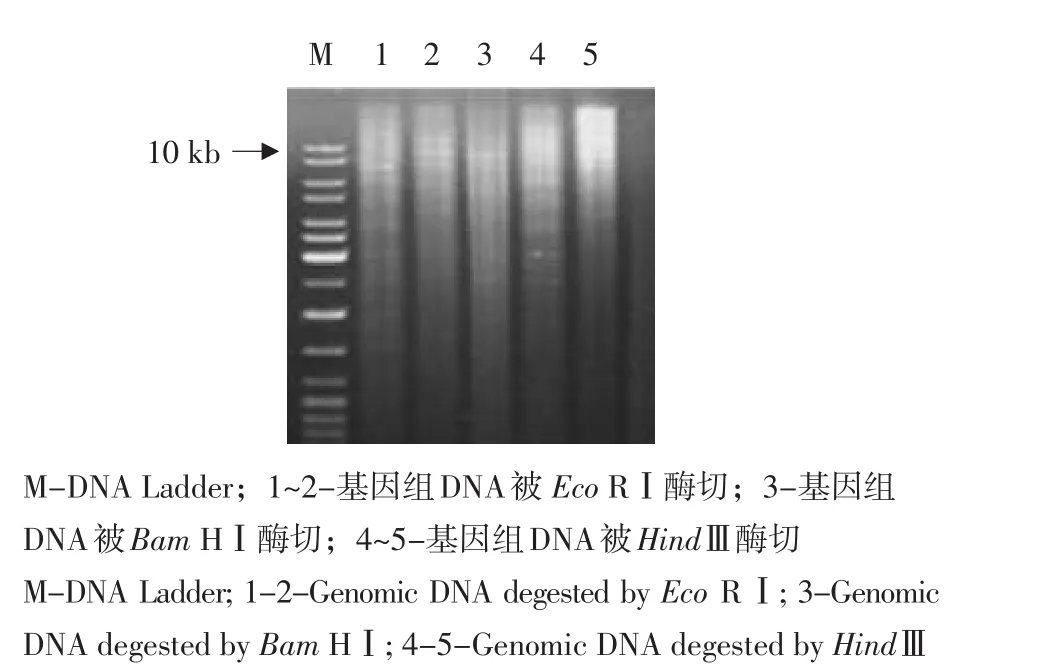
图4 甜菜基因组DNA的限制性内切酶消化Fig.4 Agarose gel electrophoresis of genomic DNA of Beta vulgaris L.degested with restriction endonucleases
2.2.3 Ty7Br600基因在甜菜基因组中的分布
以500 bp的cDNA差异片段为探针,与基因组DNA进行Southern杂交。由图5可知,这些差异cDNA片段探针同经酶切消化的基因组DNA进行Southern杂交时,在每一组酶切中至少有2~3条条带,且有1条带的强度明显高于其他条带,表明这些cDNA差异片段确为甜菜基因组片段,也同时表明该基因在甜菜基因组中以2个拷贝或低拷贝形式存在。
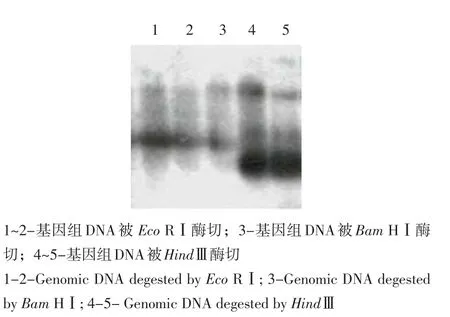
图5 Southern印记杂交Fig.5 Southern blotting hybridization
3 讨论
甜菜当年抽薹严重影响甜菜产量、工艺品质和贮藏。但随着分子生物学、基因工程技术的快速发展,揭示甜菜当年抽薹机理,并提出调控技术已经成为可能。本研究对已经克隆到的低温和长日照诱导表达的基因[12-13],进行Northern和Southern杂交分析,探讨了二年生甜菜当年抽薹的相关基因特性,为揭示二年生甜菜当年抽薹的分子机理以及甜菜生产提供理论依据。
引起甜菜当年抽薹的内在因素是品种特性,即甜菜一年或二年生的习性;而外在因素是生态条件即低温、长日照等条件。一年生甜菜不需低温也可以抽薹,但仍需一定的长日照;而二年生甜菜当年必须满足其低温和长日照等条件,才会出现当年抽薹的现象,抽薹基因B要通过外界因素(如后春化阶段的长日照,高温)才能起作用。因此栽培甜菜当年抽薹的机理相当复杂,不仅涉及到抽薹基因,还受一些与其相互作用的感光性基因影响。国内外陆续有很多报道。甜菜抽薹是一个高度复杂而复合的,在一定遗传背景下的生理生化及形态发生过程。甜菜植株接受环境因子诱导后,经一系列信号传导过程,启动抽薹决定过程中的控制基因。这些过程中许多特异性基因按一定的时间顺序和空间特异性程序启动和关闭,各个基因既具有独立功能,又相互影响、相互制约。
抽薹性状本身是一种质量性状,通常由单基因控制[14],但是甜菜的整个抽薹过程却必需经过春化过程和适当的光周期诱导,因此就甜菜抽薹整个过程而言,抽薹过程是一系列春化作用、光周期和抽薹相关基因的接受外界刺激信号顺序表达的结果[2]。遗憾的是,至今对甜菜抽薹的本质和机理还未研究清楚。要想弄清其本质机理,就必需追根溯源,找到控制甜菜抽薹的主效基因和连锁的相关基因,才能从更深的层次即分子水平上解释甜菜抽薹机理。如果能克隆出控制甜菜抽薹的主效基因或几个关键基因,则可以采用反义RNA控制二年生栽培甜菜抽薹基因的表达,用基因敲除等生物技术对基因组进行重建改造,提高产糖量,应用前景相当广阔。
4 结论
本文分别进行Northern印迹和Southern印迹杂交。结果表明,Ty7Br600 cDNA差异片段只在低温诱导的甜菜中表达,在甜菜基因组中以2个拷贝或低拷贝形式存在。本研究克隆到的低温和长日照诱导表达的基因,为研究甜菜抽薹及其调控的机理,最终采用生物技术手段控制甜菜抽薹、降低抽薹率和提高产糖量提供了理论基础和基因材料。
[1]Owen F V.The significance of single gene reactions in sugar beets[J].Proceedings of the American Society of Sugar Beet Technologists,1954,8:392-398.
[2]Abe J,Guan G P,Shimamoto Y.A gene complex for annual habit in sugar beet(Beta vulgaris L.)[J].Euphytica,1997,94:129-135.
[3]王立方.甜菜抽薹开花的条件及控制技术的应用[J].中国甜菜,1983(2):1-13.
[4]Lasa J M.Sugar beet bolting in the root crop[J].J Agric Sci,1977,89(1):223-238.
[5]Longden P,Clarke N,Thomas T.Why are bolting and flowering important in sugar beet[J].British Sugar Beet Review,1994,62(2):23-26.
[6]王立方.甜菜发育控制技术研究.光照和温度条件对甜菜抽薹开花的影响[J].甜菜糖业,1979(2):17-28.
[7]Barzen E,Mechelke W,Ritter E,et al.RFLP markers for sugar beet breeding:Chromosomal linkage maps and location of major genes for rhizomania resistance,monogermy and hypocotyl colour[J].Plant Journal,1992,2:4,601-611.
[8]Schondelmaier J,Jung C.Chromosomal assignment of the nine linkage groups of sugar beet(Beta vulgaris L.)using primary trisomics[J].Theor Appl Genet,1997,95:590-596.
[9]El-Mezawy A,Dreyer F,Jacobs G,et al.High-resolution mapping of the bolting gene B of sugar beet[J].Theor Appl Genet,2002,105:100-105.
[10]Abe J,Guan G P,Shimamoto Y.A marker-assisted analysis of bolting tendency in sugar beet(Beta vulgaris L.)[J].Euphytica,1997,94:137-144.
[11]萨姆布鲁克J,弗里奇E F.分子克隆实验指南[M].金冬雁,黎孟枫等译.2版.北京:科学出版社,2002.
[12]戴建军,常缨,李彩凤,等.低温诱导甜菜抽薹基因的差异表达分析[J].东北农业大学学报,2009,40(12):13-17.
[13]戴建军,常缨,李彩凤,等.低温诱导甜菜(Beta vulgaris L.)抽薹相关基因的RACE分析[J].东北农业大学学报,2010,41(7):10-15.
[14]Chia T Y P,Muller A,Jung C,et al.Sugar beet contains a large CONSTANS-LIKE gene family including a CO homologue that is independent of the earlybolting(B)gene locus[J].Journal of Experimental Botany,2008,59(10):2735-2748.

