麦角酰胺产生菌Claviceps paspali的复合诱变及理性筛选
王相晶,王金平,张 继,张匀华
(1.黑龙江省农业科学院博士后工作站,哈尔滨 150086;2.东北林业大学博士后流动站,哈尔滨 150040;3.东北农业大学生命科学学院,哈尔滨 150030)
麦角酰胺是一种简单的麦角生物碱(简称麦角碱),具有四环麦角灵的结构特征,由子囊菌麦角菌属(Claviceps)真菌代谢产生。麦角碱对人体具有药理作用,在传统医学中,麦角浸出物被用于治疗妇科产后出血;在现代医学中,麦角碱已被广泛用于治疗神经内分泌、脑血管系统的疾病(如老年性痴呆)以及产后止血,同时还能作为原料用于合成其他重要药物。研究表明,麦角碱的生理作用大多源于其母体结构—麦角灵与去甲肾上腺素、多巴胺、5-羟色胺等神经介质结构上的相似性[1]。因此,麦角碱研究引起了广泛关注[2-4]。
在天然状态下,麦角菌寄生于禾本科植物子房内,夏秋之际使得寄主子房呈现外紫内白、形状如动物之角的固体,由此得名“麦角”。因野生的麦角产量不足,并受到自然条件的限制,麦角碱的生产主要通过麦角菌的发酵而获得。几十年来,国外科研人员在菌种的选育、发酵工艺及培养条件等方面进行了大量研究,取得了很多成果,并用于生产[5-7]。国内虽然也有利用麦角菌发酵生产麦角酞胺、麦角新碱和麦角隐亭的报道,但由于研究工作不够深入,麦角碱生产率低,生产成本高,无法用于生产。至今,国内的麦角碱类药物仍然依赖进口。
提高微生物发酵产量,诱变是最行之有效的方法。国内外关于麦角菌研究的报道,多为单一的紫外诱变或者化学诱变,复合诱变的报道鲜少看见[2,8-9]。此外,研究者在工业微生物育种中从生物合成途径出发,运用理性筛选的方法选育高产菌株[10-11]。但这种方法多用于产抗生素菌株,多数为自身代谢产物耐受性筛选,完全从生理特性出发的报道还未见。本文以麦角酰胺产生菌Claviceps paspali为研究对象,从其生理特性以及发酵过程调控出发,运用复合诱变与理性筛选结合的方式筛选出高产菌株,并进行扩大培养,对其发酵条件进行初步研究,为麦角酰胺的工业生产提供数据支持和理论基础。
1 材料与方法
1.1 材料
1.1.1 菌种
麦角菌HY17-3:东北农业大学生物化工实验室保存。
1.1.2 培养基
斜面及分离平板培养基:去皮马铃薯200 g,切块煮沸0.5 h后过滤,加琼脂20 g,葡萄糖20 g,加去离子水至1 000 mL,用浓氨水调pH值为7.0。
摇瓶种子培养基:甘露醇40 g,琥珀酸10 g,KH2PO41 g,豌豆粉1 g,MgSO4·7H2O 0.3 g,加去离子水至1 000 mL,用氨水调pH为5.2。
发酵培养基:山梨醇100 g,玉米浆30 g,琥珀酸胺40 g,MgSO4·7H2O 0.3 g,加去离子水至1 000 mL,用NaOH调pH 5.2。
1.2 方法
1.2.1 紫外诱变、甲基磺酸乙酯(EMS)复合诱变
将麦角菌HY17-3接种于斜面培养基,28℃培养7 d。刮取长好的新鲜斜面培养物于装有10 mL无菌水的灭菌磨砂试管内,用磨砂玻璃棒研磨成匀浆状,然后置于预热半小时的紫外灯下进行紫外诱变。紫外灯功率30 W,距离30 cm,时间9 min。
冰浴条件下取0.5mLEMS原液加入10mL磷酸盐缓冲液(0.2mol·L-1,pH7.2),配制成0.1mol·L-1母液备用。将上述经紫外诱变的菌液用羟乙基哌嗪乙硫磺酸(HEPES)缓冲液(pH 7.2)稀释10倍后,取5 mL至无菌离心管中,并加入1 mL的EMS母液,并用HEPES缓冲液稀释使EMS的终浓度为0.01 mol·L-1。然后将菌悬液置于28℃的摇床上250 r·min-1振荡。1 h后,取1 mL菌悬液于无菌的离心管中20 000 r·min-1离心2 min,弃上清,加入1 mL 12%的硫代硫酸钠吹打洗涤终止反应,重复洗涤5次备用。
1.2.2 筛选剂及抗性突变筛选
将复合诱变过的菌体匀浆梯度稀释后涂布于分别含有适当浓度的乙酸钠平板中,于28℃培养14 d,筛选耐受性突变株,并挑取一定数量的单菌落进行摇瓶发酵培养。筛选出高产菌株后重复上述操作涂布于含有一定浓度色氨酸的平板中,同样筛选出高产菌株。按照这个方法,依次筛选出丁二酸、山梨醇及麦角酸的抗性突变菌株。
1.2.3 30 L发酵生产工艺
发酵罐罐体积为30 L,装液量为15 L,接种量10%,发酵过程空气流量控制0.5 VVM,罐温25 ℃,罐压0.05 MPa,转速150 r·min-1,发酵第9天补加50%的山梨醇600 mL,培养16 d,发酵结束。
1.2.4 分析方法
1.2.4.1 麦角酰胺发酵效价的测定
采用高效液相色谱法(HPLC)[12]。
1.2.4.2 发酵pH及菌丝浓度测定
发酵过程中的pH变化采用DELTA 320酸度计(梅特勒-托利多仪器(上海)有限公司)进行测定;菌丝浓度以PMV表示,具体测定方法见文献[11]。
1.2.4.3 残留山梨醇的测定
采用高效液相色谱法(HPLC)[13]。
2 结果和分析
2.1 乙酸钠耐受株
通过对麦角碱生物合成途径的研究,麦角碱的生物合成过程首先是麦角灵环的合成,即由乙酰CoA生成萜类和生物碱合成的起始物—甲戊二羟酸,进而形成焦磷酸二甲烯丙酯。焦磷酸二甲烯丙酯在二甲烯丙基色氨酸合酶催化下与L-色氨酸发生环化得到二甲烯丙基色氨酸,然后由二甲烯丙基色氨酸经一系列的生物合成途径最终生成麦角碱[14]。因此,乙酰CoA是麦角碱产生菌生物合成麦角碱的前体诱导物质,并且该前体物质是麦角碱产生菌的胞内初级代谢产物,属于内源性前体。一般来说,微生物代谢产物的合成能力与其利用前体的能力是密切相关的,而过量的内源性前体往往对代谢产物的产生具有反馈调节作用。故筛选耐乙酰CoA结构类似物(即乙酸钠(NaAc))的突变株,有可能获得麦角酰胺的高产突变株。
以菌株HY17-3为出发菌株,经UV及EMS复合诱变后,筛选出一株乙酸钠耐受菌株HY6-13。对比自然选育、复合诱变选育和乙酸钠耐性选育结果,HY6-13效价比自然选育和复合诱变分别提高了9%和4%,具体数据见图1。为了证明其遗传稳定性,传代培养,得到HY21-9稳定菌株,并以HY21-9为出发菌株,进行下一步的推理选育。
2.2 5-甲基色氨酸耐受株
在微生物次级代谢过程中,次级代谢产物的调节可通过酶的合成量而进行调节。二甲烯丙基色氨酸合酶是麦角碱生物合成途径的关键酶之一,色氨酸既是该酶的底物又是诱导物。有文献表明,色氨酸对麦角酰胺产量有显著影响[15],但是随着色氨酸浓度的增加,产碱量趋于平稳,呈现出饱和曲线的特点[16]。因此,通过筛选色氨酸结构类似物5-甲基色氨酸的耐受株有助于解除高浓度色氨酸对菌体自身的抑制作用,从而得到高产菌株。
经UV及EMS复合诱变后,以HY21-9为出发菌株筛选出一株5-甲基色氨酸耐受菌株HY25-16。对比自然选育、复合诱变选育和5-甲基色氨酸耐性选育结果,HY25-16效价比自然选育和复合诱变分别提高了6%和5%,并作为下一轮的出发菌株,具体数据见图1。
2.3 丁二酸耐受株
在麦角菌的发酵培养基中,往往含有三羧酸循环中的一种有机酸作为碳源之一,此有机酸的作用是进入三羧酸循环使乙酰CoA大量积累,而乙酰CoA的积累对于后期糖的利用以及麦角酰胺的合成有着重要的意义[17]。文献报道丁二酸对麦角菌产碱能力有显著影响,产碱量会随着丁二酸浓度得升高而缓慢升高[18]。但是高浓度的丁二酸对菌体具有抑制作用,因此,通过筛选耐受高浓度丁二酸的菌株,有助于麦角酰胺产量的提高。
经UV及EMS复合诱变后,以菌株HY25-16为出发菌株筛选得到一株丁二酸耐受菌株HY32-19。对比自然选育、复合诱变诱变选育和丁二酸耐性选育结果,HY32-19效价比自然选育和复合诱变选育分别提高了15%和7%,具体数据见图1。
2.4 山梨醇耐受株
据报道,麦角菌培养基中的高糖分及高碳氮比有助于解除磷酸盐对次级代谢的抑制作用,从而启动高水平的氧化代谢,这是细胞合成次生代谢产物所必须的[19]。根据该报道,筛选高糖分的耐受株将有助于麦角酰胺产量的提高。
经UV及EMS复合诱变后,从出发菌株HY32-19筛选出一株山梨醇耐受菌株HY45-15。对比自然选育、复合诱变诱变选育和山梨醇耐性选育结果,HY45-15效价比自然选育和复合诱变分别提高了6%和4%,具体数据见图1。
2.5 麦角酸耐受株
次级代谢产物耐受型菌株在工业微生物发酵中具有十分重要的实用价值,一个菌株的生产能力与耐受自身代谢产物的浓度呈正相关性。因此,真正的高产菌株必须具备很强的对自身代谢产物的耐受性[14]。文献报道,雀稗麦角菌和黑麦麦角菌中的生物碱是由D-麦角酸通过一系列的酶催化反应最终生物合成麦角酰胺类或麦角肽碱。因此,增强菌株对麦角酸的耐受性,对于提高麦角酰胺的产量有重要意义。
经UV及EMS复合诱变后,从出发菌株HY45-15筛选出一株丁二酸耐受菌株HY65-13。对比自然选育、复合诱变选育和麦角酸耐性选育结果,HY65-13效价却比自然选育和复合诱变选育选育分别提高了15%和6%,具体数据见图1。

图1 麦角菌73-9系谱图Fig.1 Genealogical tree of HY73-9
2.6 麦角菌HY65-13遗传稳定性的考察
将高产菌株HY65-13进行传代培养五代,传代培养表明,经推理选育的菌株,高产性状遗传稳定,最后得到HY73-9,结果见表1。
2.7 麦角菌HY73-9 30 L发酵罐发酵结果
将推理选育的高产菌株HY73-9进行30 L发酵罐发酵培养,具体结果如图2所示。

表1 复筛菌株的传代稳定性试验结果Table1 Results of subculture of strains
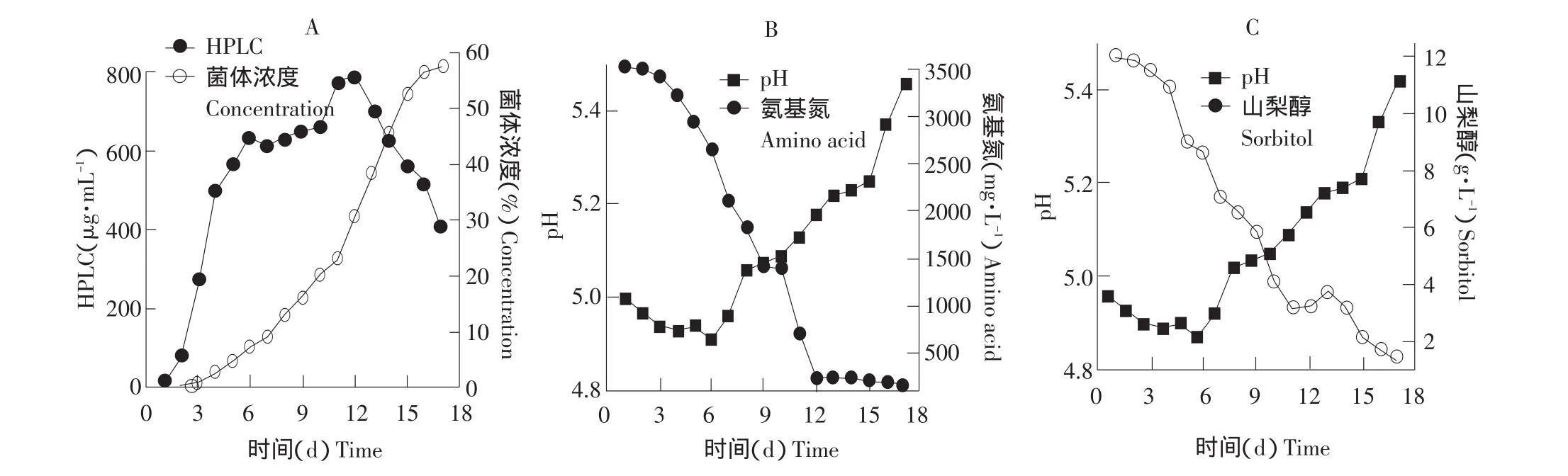
图2 麦角菌HY73-9 30 L发酵过程中各参数的变化Fig.2 Time courses of several parameters fermentation in 30 L fermentor with HY73-9
由图2可知,发酵初期,发酵液pH基本维持在4.9~5.0之间(图2B)。此时PMV快速增加,山梨醇以及氨基氮消耗很快,但是麦角酰胺产量不高,且波动不大(图2A、2C),说明此时是菌体快速生长繁殖的阶段。
随后,pH小幅度上升,而PMV趋于平衡,这时山梨醇与氨基氮保持较快的消耗速度,而麦角酰胺的产量快速上升,说明此时已经进入次级代谢阶段。当发酵进行到第9天时,菌体浓度稍微下降,此时向发酵料液中补加2%的山梨醇,在第10天后,菌体浓度有回升的趋势,这是由于碳源的补加而导致的菌体二次增长。此时,由于大部分菌体仍处于次级代谢阶段,所以麦角酰胺的产量依旧持续的增加。
在第12天后,由于大部分的菌体老化,导致发酵液的pH上升以及菌体浓度下降。此时,山梨醇氨基氮消耗殆尽,但由于二次生长菌体仍可以利用前期的代谢中间产物,所以麦角酰胺产量依旧增加。在第15天后,pH达到5.35以上,菌体大部分发生自溶,麦角酰胺产量基本稳定,发酵结束。最终麦角酰胺产量达到815 μg·mL-1。
3 讨论与结论
关于麦角酰胺国内外研究很多,主要有:培养基优化,传统诱变育种,原生质体以及基因改造等。众所周知,微生物育种产量的提高要实现质的飞跃主要是靠诱变育种,传统育种工作量极大,原生质体技术虽然可以提高菌种的稳定性,但是后续工作依旧是传统诱变。目前关于基因改造能明显提高菌种产量的报道很少。本菌种存在菌体不产孢和菌丝体质硬等问题,不论对于传统的筛选还是原生质体诱变来说,菌体的大量处理都是一个很复杂的过程。本试验从麦角酰胺生物合成过程出发,经复合诱变后再通过不同筛选剂定向筛选出高产菌株,减少了工作量与筛选的盲目性,提高了效率。
相比之下,虽然本研究所采用的推理选育方法获得的菌种稳定性不如原生质体法,目的性没有基因改造法强,但是推理选育方法减少了大量繁冗工作,所得菌株的产量显著提高,传代培养证明高产菌株具有很高的遗传稳定性。该方法不仅适用于麦角菌,也能广泛应用于大规模的其他工业微生物选育,为提高工业微生物选育效率提供理论支持。
综上所述,本试验通过UV与EMS复合诱变,再经过理性筛选,得到高产菌株HY73-9,证明了复合诱变后的菌株通过理性选育提高产量是一个切实可行的筛选方式;同时经30 L发酵罐发酵,麦角酰胺的产量达到815 μg·mL-1,比原始菌株产量提高了172%,可为工业化生产麦角酰胺提供理论参考。
[1]Brown H B.Life history and poisonous properties of Claviceps paspali[J].Journal of Agricultural Research,1916,7:9-10.
[2]Mukherjee J,Menge M.Progress and prospects of ergot alkaloid research[J].Advances in Biochemical Engineering,2000,68(5):l-20.
[3]Ricicová A,Flieger M,Rehácek Z.Quantitative changes of the alkaloid complex in a submerged culture of Claviceps paspali[J].Folia Microbiologica,1982,27(6):433-445.
[4]Rylko V,Linhartová R,Sajdl P,Rehácek Z.Formation of conidia in a saprophytic strain Claviceps paspali producing simple lysergic acid derivatives[J].Folia Microbiologica,1988,35(5):425-95.
[5]Boiehenko L V,Boiehenko D M,Vinokurova N G.Use of polymerase chain reaction for searching for producers of ergot alkaloids from among mieroseopic fungi[J].Microbiology,2001,70(8):360-364.
[6]Menge M,Mukherjce J,Seheper T.Applieation of oxygen vectors to Claviceps purpurea cultivation[J].Applied Microbiloby Biotechnology,2001,55(4):411-416.
[7]陈江源,代江红,刘志国,等.麦角酰胺产生菌原生质体的紫外诱变育种[J].化学与生物工程,2005(7):33-45.
[8]何惠霞,朱平,李焕娄.ɑ-麦角隐亭产生菌的原生质体诱变育种[J].真菌学报,1966,15(3):215-219.
[9]王相晶,王晓舟,张继,等.土壤多重抗生素抗性放线菌的筛选及其发酵产物的初步研究[J].东北农业大学学报,2011,42(2):84-91.
[10]车可舒,王相晶,向志丹.多杀菌素高产菌株的选育[J].东北农业大学学报,2011,39(8):74-76.
[11]Wang X J,Wang X C,Xiang W S.Improvement of milbemycin-producing Streptomyces bingchenggensis by rational screening of ultraviolet and chemically induced mutants[J].World Journal of Microbiology and Biotechnology,2009,25:1051-1056.
[12]赵慎飞.HPLC法测定甲磺酸双氢麦角毒碱注射液中有关物质[J].海峡药学,2008,20(4):32-34
[13]袁晓环.高效液相色谱法测定山梨醇含量[J].齐齐哈尔大学学报,2001,17(3):15-21.
[14]朱平.麦角生物碱生物合成研究进展[J].药学学报,2000,35(8):630-634.
[15]王亚林,赵静国,熊万斌.产麦角碱麦角菌发酵培养基的研究[J].武汉工业学院学报,2003,22(2):1-3.
[16]刘志国,王亚林,赵静国.雀稗麦角菌产麦角碱发酵条件的优化[J].化学与生物工程,2004(2):18-21.
[17]施巧琴,吴松刚.工业微生物育种[M].北京:科学出版社,1991:242-243.
[18]胡晨曦,杨金玲,程克棣,等.麦角碱生物合成途径中酶学及相关基因研究进展[J].西北植物学报,2005,25(4):819-828.
[19]Spalla C,Filippini S,Grein A.A hypothesis on the regulation mechanisms governing the biosynthesis of alkaloids Claviceps[J].Folia Microbiologica,1978,23:505-508.

