胎儿后尿道瓣膜产前评估与宫内治疗(附1例报道)
鲁云涯 周祎陈涌珍 李满超 黄林环 朱云晓 石慧娟 商梅娇 黄爱兰 方群
(中山大学附属第一医院妇产科胎儿医学中心,广东 广州 510080)
胎儿后尿道瓣膜产前评估与宫内治疗(附1例报道)
鲁云涯 周祎*陈涌珍 李满超 黄林环 朱云晓 石慧娟 商梅娇 黄爱兰 方群
(中山大学附属第一医院妇产科胎儿医学中心,广东 广州 510080)
后尿道瓣膜(PUV)是胎儿下尿路梗阻最常见的病因,产前超声主要表现为羊水过少、膀胱壁进行性增厚和“钥匙孔征”,严重者可导致肾积水和输尿管扩张。确诊胎儿PUV后应评估胎儿的肾功能、膀胱功能,监测羊水量以及进行染色体核型分析。对羊水过少而肾功能良好的病例,可考虑宫内治疗,目前可行的方法有膀胱-羊膜腔分流术、胎儿膀胱镜下后尿道瓣膜消融术,但其治疗价值还有待进一步观察和分析。
后尿道瓣膜;下尿路梗阻;产前诊断;宫内治疗
后尿道瓣膜(Posterior Urethral Valves,PUV)是后尿道内的软组织瓣膜,可导致尿道梗阻,瓣膜可呈双叶状、隔状或仅为黏膜皱襞,仅发生于男性,PUV畸形是男性新生儿下尿路梗阻(Lower Urinary Tract Obstruction,LUTO)最常见的原因,活产新生儿发病率大约为1/8000~1/25 000[1,2]。本病病因不明,可能为多基因遗传,与尿生殖膈分化不全有关。PUV在胚胎早期就已出现,可引起泌尿系统及其他系统发育不良和功能障碍,如上尿路扩张及膀胱输尿管返流(Vesicoureteric Reflux,VUR)、膀胱扩大及膀胱功能异常、肾小球及肾小管功能异常以及因羊水过少导致的胎肺发育不全[3]。由于胎儿PUV会导致羊水过少、肾损害、肺发育不全及新生儿死亡等一系列改变,其围生期发病率和死亡率都非常高,故而可以考虑对梗阻严重的胎儿进行早期宫内干预[4]。
随着超声和MRI技术的提高,更多的PUV在产前被诊断出来。本文报道本院新近诊断的1例胎儿PUV,附解剖及组织病理检查结果,并对该病的产前诊断、宫内评估、宫内治疗和预后进行综述。
1 病例回顾
孕妇,25岁,G1P0,孕22周外院B超提示“胎儿肠管回声增强,双肾重度积水,双侧输尿管扩张”。孕25周转诊至本院,复查B超提示“NF 5.5mm,胎儿头面、脊柱、四肢及胸腔基本正常。肾盂分离:左13mm,右19mm;左肾大小40mm×22mm×27mm,肾皮质最薄处厚度2.7mm;左侧输尿管扩张,中段(扩张最明显处)横径达8.2mm;右肾大小45mm×21mm×28mm,肾皮质最薄处厚度2.5 mm;右侧输尿管扩张,中段(扩张最明显处)横径达10.6mm;膀胱大小43mm×40mm,出口处呈“钥匙孔”征(图1);膀胱壁增厚,约3.5mm,回声增强,羊水最大深度52mm。超声诊断:宫内妊娠,胎儿存活,发育相当于25+6周,胎儿双肾中度积液,双侧输尿管扩张,膀胱形态异常——考虑后尿道瓣膜”。孕26+4周时本院行脐静脉穿刺,脐血染色体核型为46,XY,弓形体病原体、巨细胞病毒、风疹病毒IgM均阴性,β2-微球蛋白(β2-MG)2.5mg/L。本中心对胎儿病情进行宫内评估:①发病孕周早,约为22周;②肾皮质变薄,厚约2.7mm;③膀胱壁明显增厚,达3.5mm;④羊水量正常,AFV 52mm。告知孕妇胎儿起病时间早,肾皮质变薄,膀胱壁增厚,羊水量虽正常,但不排除胎儿肾脏或膀胱功能受损可能,如希望保留胎儿,建议行膀胱-羊膜腔分流术(Vesicoamniotic Shunting,VAS)。已做好手术准备,但患者最终选择终止妊娠,于孕27+3周引产娩出一男死胎。经孕妇同意行引产胎儿尸体解剖及病理检查。

图1 胎儿“钥匙孔征”超声图:图示膀胱扩大,箭头所指为“钥匙孔征”
大体解剖可见引产胎儿双肾中度积液,左肾大小56mm×35mm×30mm,皮质最薄处厚2.7mm;右肾大小60mm×38mm×30mm,皮质最薄处厚1.5mm;双输尿管扩张,左输尿管中段横径达10mm,右输尿管中段横径达12mm;膀胱形态异常,大小48mm×20mm,膀胱壁厚达4mm(图2),后尿道距膀胱颈10mm处可见大小4mm×2mm的隔状瓣膜(图3),确诊为PUV。
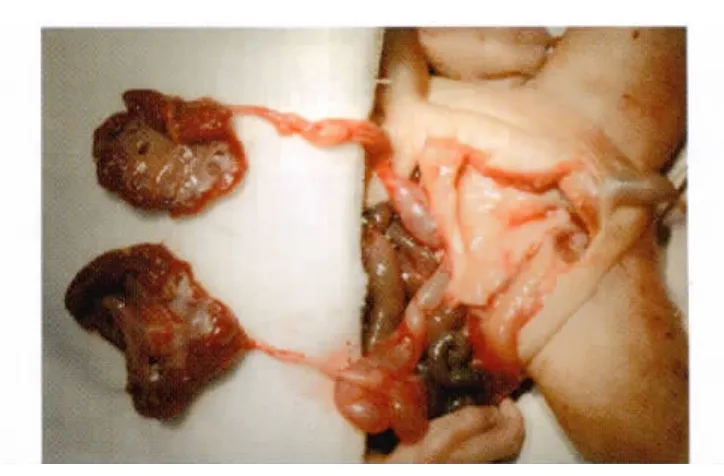
图2 泌尿系大体解剖图:解剖示双肾增大积水,双输尿管扩张迂曲,膀胱扩大,膀胱壁增厚

图3 膀胱及后尿道解剖图:矢状切开膀胱前壁,距膀胱颈10mm处见4mm×3mm大小瓣膜,诊断为后尿道瓣膜(PUV)
取引产胎儿肾脏及膀胱组织送病理检查,可见肾小球及肾小管发育幼稚,呈局灶性囊样扩张,肾间质水肿,慢性炎性细胞浸润,肾盂黏膜部分脱落,部分肾小管扩张(图4);膀胱纤维组织和血管增生紊乱,少量炎性细胞浸润,未见膀胱粘膜(图5)。
2 讨论
2.1 胎儿PUV的产前诊断
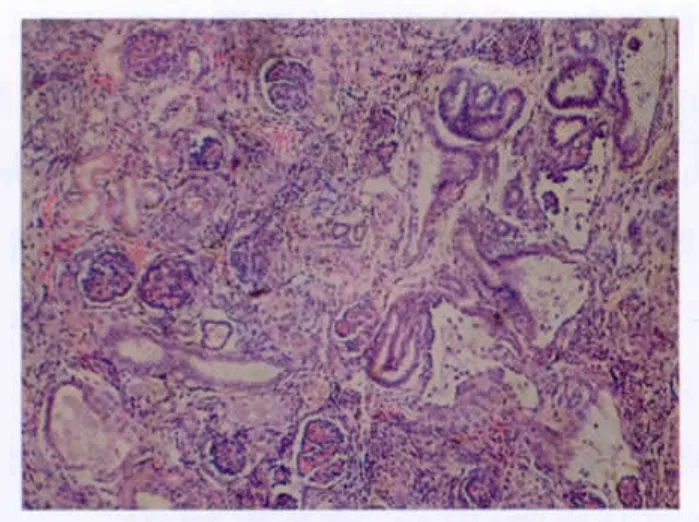
图4 肾脏病理组织切片图(HE×100倍):肾小球发育幼稚,毛细血管腔小,分叶少,足细胞胞浆少、核大,呈花环状排列于毛细血管周围;肾小管发育幼稚,呈局灶性囊样扩张,肾间质水肿,慢性炎性细胞浸润
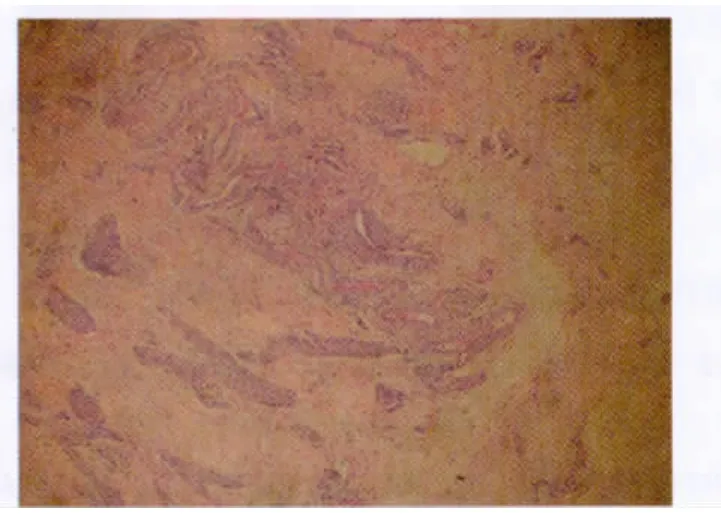
图5 膀胱病理组织切片图(HE×40倍):纤维和血管增生紊乱,少量炎性细胞浸润,未见膀胱黏膜
2.1.1 超声诊断 产前诊断PUV主要依靠超声,其敏感性为95%,特异性为80%[5-7]。文献报道超声能在孕17周时诊断胎儿PUV[8]。当超声出现双肾扩大、肾内液性暗区、双侧肾盂及双侧输尿管扩张、膀胱扩张等改变时,应高度怀疑LUTO。羊水过少、膀胱壁进行性增厚和“钥匙孔征”是胎儿PUV的三大超声表现。“钥匙孔征(Keyhole sign)”是超声诊断胎儿PUV的一个敏感指标,即后尿道梗阻患者膀胱和后尿道扩张的征象,其在产前诊断PUV的敏感性为94%,特异性为43%,而诊断胎儿PUV最佳的指标是膀胱壁增厚和膀胱扩张[9]。典型病例中,B超下可见到巨大膀胱,由于膀胱过度伸展,收缩舒张功能异常,肌纤维增生,膀胱壁增厚变形,故呈强回声改变。晚期由于膀胱破裂或膀胱压力过大可导致尿液外渗出现尿性腹水,在超声下可表现为腹腔积液。当出现VUR时,可见输尿管明显扩张,肾盂和肾脏积水,肾皮质变薄等改变。如果能够早期诊断,尽早评估其肾功能,可以考虑对胎儿进行早期宫内干预。本例“钥匙孔征”明显,膀胱壁厚且扩张明显,诊断明确,经引产后尸体解剖证实。
2.1.2 MRI诊断 MRI能更好地区分胎儿肾积水的程度,也能辅助评价是否合并肾功能损害或肾脏畸形。当羊水过少使得超声的应用受限时,MRI就显示出了它独特的优势,因为它不需要羊膜腔灌注就能清晰地显示胎儿的泌尿道[7,10]。B超诊断困难时可以考虑进一步行MRI检查。本例因诊断较明确且患者拒绝治疗而未行MRI检查。
2.1.3 经皮膀胱镜检查 B超及MRI检查用于诊断LUTO,并了解其带来的胎儿泌尿系统形态学改变,宫内经皮膀胱镜检查可以确诊PUV,对LUTO进行病因学诊断,并同时达到治疗目的。胎儿膀胱镜检查可清晰地显示输尿管口、膀胱颈及后尿道的扩张情况,若联合超声检查可提高诊断的准确率[7,11,12],但其使用受限于操作者的技术水平,且有一定的侵入性风险,故适用于对B超和MRI诊断后的病人的确诊和进一步治疗。
2.2 胎儿PUV的宫内评估 对PUV胎儿进行宫内评估与明确诊断同等重要,因为这样既可以早期干预以挽救胎儿的肾功能,又可以避免对无法存活的胎儿进行无谓的治疗,以减少母体并发症。当诊断为PUV时,应对胎儿进行全面的宫内评估,以确定下一步处理措施,其中主要包括肾脏与膀胱功能评估、染色体检查及其他系统畸形筛查。
2.2.1 肾脏、膀胱功能及预后评估 先前有研究表明胎儿尿液分析有预测肾功能的作用,其方法是在B超介导下膀胱穿刺获取胎儿尿液,临床意义较大的有电解质、渗透压和β2-MG,其中钠离子<100 mmol/L,氯 离 子 <90mmol/L,渗 透 压 <210 mOsm/L,β2-MG<4mg/L提示胎儿肾功能好;β2-MG被用来衡量胎儿的肾小球滤过率,β2-MG>13 mg/L的患儿几乎100%在新生儿期死亡[13,14]。但是最近的研究结果表明:胎儿尿液分析对生后肾功能的预测价值不大[4,15,16]。因此,胎尿评估肾功能的作用还有待进一步研究证实。
超声不仅在诊断胎儿PUV上有很大意义,还能评估胎儿的肾功能及其预后,肾脏回声增强、皮质-髓质区分不清和皮质囊肿常提示肾发育不良,也是预后差的征象[17]。肾皮质囊肿预测生后肾功能不全的特异性为100%,敏感性为44%;肾脏强回声预测肾功能不全的特异性是80%,敏感性是73%[18]。B超发现羊水过少提示可能存在肾发育不良和肺发育不全,这是一个重要的致死信号,其宫内死亡率高达80%,幸存胎儿有严重的肾损害,25%~30%发展为终末期慢性肾病,需要透析或肾移植[15,19]。Mitchell[20]提出“瓣膜膀胱综合征”这一说法,即膀胱壁厚、顺应性降低、膀胱内高压等特征,认为这是胎儿膀胱功能丧失、需尿流改道的直接依据。但是由于这些超声下的指标难以量化,且各个中心的研究存在异质性,因此国内外仍没能找到非常确切的肾功能评估指标。目前比较可靠的预测生后肾功能的指标为羊水量减少和拟诊PUV时肾皮质变薄[15]。其他提示肾脏与膀胱功能异常的超声指标还包括:24周前出现重度肾盂分离、膀胱壁厚度大于2mm、膀胱壁回声增强等。
2.2.2 染色体检查及系统畸形排查 B超发现胎儿泌尿系统异常征象时,有必要行染色体核型分析及全身超声扫描以排除其他系统畸形。PUV和尿道闭锁在男性胎儿中高发[7],一般只对孤立性PUV进行宫内治疗,如合并染色体异常或其他系统严重畸形则治疗已无意义。
本例胎儿染色体核型为正常男性,无合并其他畸形,虽产前超声提示羊水量正常,但在24周前出现重度肾盂分离,引产后肾皮质厚度最薄约1.5mm,输尿管扩张达12mm,膀胱壁厚达4mm、回声增强,且肾脏组织学改变经病理检查证实,考虑产前有肾功能、膀胱功能受损可能。
2.3 胎儿 PUV 的宫内治疗 Harrison等[21,22]研究表明,产前对LUTO进行治疗可有效地防止胎儿肺发育不全和肾发育不良。为了防止先天性PUV带来的严重并发症,不同的产前干预措施在20年前已被提出,早期宫内干预能有效缓解梗阻和增加羊水量,从而改善胎儿预后。目前使用最多的是膀胱-羊膜腔分流术,胎儿膀胱镜后尿道瓣膜消融术也已经进入实验研究阶段,开放性膀胱造口术则已被弃用。有分析认为:不同的宫内干预措施对远期慢性肾脏疾病的发生率没有统计学差异[18]。不管采用何种方法,治疗前都应充分对胎儿进行宫内评估。2.3.1 膀胱-羊膜腔分流术 膀胱-羊膜腔分流术(Vesico-amniotic Shunting,VAS)旨在胎儿膀胱和羊膜腔之间放置一根分流管,使胎儿尿液从旁路进入羊膜腔,既有效地缓解了肾脏及输尿管的压力,又增加了羊水量,从而防止继发的胎儿肾功能损害和肺发育不全。这一技术要求在超声介导下进行,严重羊水过少时在分流前应先行羊膜腔灌注以获得足够的操作空间。至今已有多个中心成功施行了VAS,Coplen[23]对5个中心共169例成功施行VAS的病例进行了总结,得出总的胎儿存活率仅为47%,由于羊水过少导致肺发育不全等并发症的发生率高达45%。Biard等[24]的研究表明VAS可明显改善肾功能、增加羊水量、防止胎肺发育不全,这些经过宫内治疗的胎儿出生后虽然需要长期的支持治疗,但大多数对生活质量满意。尽管VAS简单有效且可增加PUV患者的围生期生存率,但仍有许多并发症,如膀胱收缩功能丧失、引流管堵塞、胎膜早破、尿性腹水、绒毛膜羊膜炎等,其预后主要取决于病例的选择及术后膀胱功能的恢复。
2.3.2 胎儿膀胱镜下后尿道瓣膜消融术 胎儿膀胱镜先前主要被用来诊断胎儿泌尿系统疾病,Quintero[11]在1995年最先提出并实施了胎儿膀胱镜下放置分流管及切除PUV的方法,该方法使尿流通畅,对孕妇和胎儿造成的并发症相对较小。它可以明确梗阻的具体位置,从根本上消除梗阻的病因,改善胎儿的肾脏和膀胱功能。
对于合适的病例,介入性手术宜尽早进行,解除胎儿膀胱流出道梗阻,防止胎儿肾功能进一步恶化,从而改善胎儿预后[25]。其最大的困难在于膀胱与后尿道之间存在一个角度,怎样使镜子通过膀胱-后尿道夹角进入后尿道成为手术成功最大的障碍[17]。对于胎儿PUV的治疗,胎儿膀胱镜下激光消融可以避免VAS后出现排尿困难,从根本上解除梗阻,既能使胎儿膀胱动力和生理功能恢复,还有可能彻底治愈PUV,它的侵入性比膀胱造口术小,治疗效果理论上比VAS好,所以胎儿膀胱镜下激光消融术有望成为治疗胎儿PUV的主要措施。但是现今胎儿膀胱镜手术只在少数几个中心开展,它的发展还处于实验研究阶段,在广泛应用于临床之前仍需要更深入的探讨和研究。
2.4 远期预后 肾脏及膀胱功能、羊水量、诊断孕周、干预时间是判断胎儿预后的几个关键因素。胎儿PUV发生率低、介入手术操作困难,使得宫内治疗胎儿PUV仍然是一个具有挑战性的课题,存活新生儿的远期结局和预后缺乏有效的文献资料。虽然宫内干预能减低胎儿肾发育不良和肺发育不全的发生率,但是PUV患者的远期严重并发症并不能被阻止[17],如慢性终末期肾病、肾功能衰竭、膀胱功能丧失,且宫内治疗本身不可避免地会带来出血、感染、流产、早产等并发症。总之,对PUV胎儿进行宫内干预有很大的风险,胎儿死亡率达到了43%[18],手术治疗宜选择羊水过少而肾功能正常的病例[26]。Hutton等[27]提出孕24周前发生胎儿PUV提示预后不良,若诊断时双侧肾功能已严重损害不可逆转,则宫内治疗失去意义,此时单纯梗阻的解除不能解决泌尿系统畸形的问题,不会使膀胱内压完全恢复正常,发育不良的肾皮质功能也不会逆转。因此,早期发现并早期治疗是改善胎儿远期预后的关键。
2.5 展望 超声在诊断和评估胎儿PUV中具有极大的作用,宫内成功治疗PUV且远期预后良好的病例报道并不多。由于缺乏大样本研究,目前尚无确切的胎儿肾功能评估指标,宫内干预后PUV患者远期生存率的提高和肾功能的改善有待进一步证实,故而有必要对胎儿PUV的治疗进行大规模前瞻性队列研究以明确宫内干预的价值。随着产前诊断和宫内干预技术的不断提高,宫内治疗的未来值得期待。
[1]Casale AJ.Early ureteral surgery for posterior urethral valves[J].Urol Clin North Am,1990,17(2):361-372.
[2]Atwell JD.Posterior urethral valves in the British Isles:a multicenter B.A.P.S.review[J].J Pediatr Surg,1983,18(1):70-74.
[3]黄澄如,张潍平,孙宁,等.后尿道瓣膜症[J].中华小儿外科杂志,2005:26,30-33.
[4]Ruano R.Fetal surgery for severe lower urinary tract obstruction[J].Prenat Diagn,2011,31(7):667-674.
[5]Robyr R,Benachi A,Daikha-Dahmane F,et al.Correlation between ultrasound and anatomical findings in fetuses with lower urinary tract obstruction in the first half of pregnancy[J].Ultrasound Obstet Gynecol,2005,25(5):478-482.
[6]Wu S,Johnson MP.Fetal lower urinary tract obstruction[J].Clin Perinatol,2009,36(2):377-390.
[7]Lissauer D,Morris RK,Kilby MD.Fetal lower urinary tract obstruction[J].Semin Fetal Neonatal Med,2007,12(6):464-470.
[8]罗朵朵,董刚.超声诊断胎儿后尿道瓣膜病1例[J].中国医学影像技术,2007,11:1726
[9]Bernardes LS,Aksnes G,Saada J,et al.Keyhole sign:how specific is it for the diagnosis of posterior urethral valves?[J].Ultrasound Obstet Gynecol,2009,34(4):419-423.
[10]Poutamo J,Vanninen R,Partanen K,et al.Diagnosing fetal urinary tract abnormalities:benefits of MRI compared to ultrasonography[J].Acta Obstet Gynecol Scand,2000,79(1):65-71.
[11]Quintero R A,Johnson M P,Romero R,et al.In-utero percutaneous cystoscopy in the management of fetal lower obstructive uropathy[J].Lancet,1995,346(8974):537-540.
[12]Welsh A,Agarwal S,Kumar S,et al.Fetal cystoscopy in the management of fetal obstructive uropathy:experience in a single European centre[J].Prenat Diagn,2003,23(13):1033-1041.
[13]梁志清,李俊男.胎儿下尿路梗阻的宫内诊断与治疗进展[J].实用妇产科进展,2009,25:714-716.
[14]Muller F,Bernard MA,Benkirane A,et al.Fetal urine cystatin C as a predictor of postnatal renal function in bilateral uropathies[J].Clin Chem,1999,45(12):2292-2293.
[15]Morris RK, Malin GL,Khan KS,et al.Antenatal ultrasound to predict postnatal renal function in congenital lower urinary tract obstruction:systematic review of test accuracy[J].BJOG,2009,116(10):1290-1299.
[16]Morris RK,Quinlan-Jones E,Kilby MD,et al.Systematic review of accuracy of fetal urine analysis to predict poor postnatal renal function in cases of congenital urinary tract obstruction[J].Prenat Diagn,2007,27(10):900-911.
[17]Agarwal SK,Fisk NM.In utero therapy for lower urinary tract obstruction[J].Prenat Diagn,2001,21(11):970-976.
[18]Holmes N,Harrison MR,Baskin LS.Fetal surgery for posterior urethral valves:long-term postnatal outcomes[J].Pediatrics,2001,108(1):E7.
[19]Parkhouse HF,Barratt TM,Dillon MJ,et al.Long-term outcome of boys with posterior urethral valves[J].Br J Urol,1988,62(1):59-62.
[20]Mitchell ME.Persistent ureteral dilation following valve resection[J].Dial Pediatr Urol,1982,5:8-10.
[21]Harrison MR,Ross N,Noall R,et al.Correction of congenital hydronephrosis in utero.I.The model:fetalurethral obstruction produces hydronephrosis and pulmonary hypoplasia in fetal lambs[J].J Pediatr Surg,1983,18(3):247-256.
[22]Glick PL,Harrison MR,Adzick NS,et al.Correction of congenital hydronephrosis in utero IV:in utero decompression prevents renal dysplasia[J].J Pediatr Surg,1984,19(6):649-657.
[23]Coplen DE.Prenatal intervention for hydronephrosis[J].J Urol,1997,157(6):2270-2277.
[24]Biard JM,Johnson MP,Carr MC,et al.Long-term outcomes in children treated by prenatal vesicoamniotic shunting for lower urinary tract obstruction[J].Obstet Gynecol,2005,106(3):503-508.
[25]Ruano R,Duarte S,Bunduki V,et al.Fetal cystoscopy for severe lower urinary tract obstruction-initial experience of a single center[J].Prenat Diagn,2010,30(1):30-39.
[26]Deprest JA,Lerut TE,Vandenberghe K.Operative fetoscopy:new perspective in fetal therapy?[J].Prenat Diagn,1997,17(13):1247-1260.
[27]Hutton KA,DF Thomas,BW Davies.Prenatally detected posterior urethral valves:qualitative assessment of second trimester scans and prediction of outcome[J].J Urol,1997.158(3):1022-1025.
编辑:付静
Prenatal Assessment and Intrauterine Treatment of Fetal Posterior Urethral Valves(A Case Report)
Lu Yun-ya,Zhou Yi*,Chen Yong-zhen,Li Man-chao,Huang Lin-huan,Zhu Yun-xiao,Shi Hui-juan,Shang Mei-jiao,Huang Ai-lan,Fang Qun.
(The First Affiliated Hospital,Sun Yat-sen University,Guangzhou 510080,China)
Posterior urethral valves(PUV)is the most common anomaly of fetal lower urinary tract obstruction.Prenatal ultrasound can present oligohydramnios,thick-walled bladder and the ‘keyhole sign’.In severe cases,they result in hydronephrosis and ureteric dilatation.If diagnosed,We should assess renal function and bladder function of the fetus,examine the amniotic fluid volume and analyze the chromosomal karyotype.For those fetuses with normal renal function and oligohydramnios,intrauterine treatment can be provided,such as Vesico-amniotic Shunting and fetal cystoscopy PUV ablation,while the value of these approaches needs further investigation.
posterior urethral valves;lower urinary tract obstruction;prenatal diagnosis;intrauterine treatment
R714.55
B
2012-05-17)
广东省国际合作项目(2010B050700006),广东省科技基础条件建设项目(2011B060300011)
*通信作者:周祎,E-mail:zhouyifm@yahoo.com

