半纤维素结构的植物分类学特征
张晓民
(南京野生植物综合利用研究院,江苏南京210042)
半纤维素结构的植物分类学特征
张晓民
(南京野生植物综合利用研究院,江苏南京210042)
依据结构特征界定了半纤维素。不同植物品种和不同细胞类型的半纤维素在结构细节和含量上普遍存在着差异。总结了从轮藻到陆生植物中的半纤维素在结构上的分类学分布,并据此比较了初生壁和次生壁。
半纤维素;杂聚糖;平伏键构型;木葡聚糖;木聚糖;甘露聚糖;β-(1→3,1→4)葡聚糖
真核植物在向维管植物进化的过程中,从一些和陆生植物一样具有许多亚细胞特征的轮藻门植物开始,就出现了包括纤维素和半纤维素在内的细胞壁多糖。植物的这种进化是为了适应在陆地上的生存。一旦半纤维素束缚住纤维素的微纤丝(microfibril),强化的细胞壁就能支撑植物在陆地上直立,并且正是这种愈久弥坚的支撑才使植物可以长得如树木般的高大。为了适应生长,植物细胞壁一般具有两种主要结构:初生壁和次生壁。它们由外向里分布。初生壁(primary wall)是具有生长能力的可扩展细胞壁,细胞在生长时,纤维素的微纤丝将沉积在上面,一旦形成一薄层微纤丝,细胞就停止生长,初生壁就不再获得更多的纤维素,但可能会有少量木素形成。因此,初生壁薄而柔顺。而次生壁(secondary wall)是在细胞停止生长(扩展)后形成的,它往往具有几层,比如两层(S1,S2)或三层(S1,S2,S3)。次生壁中多层微纤丝和木素等其它非糖物质的形成使它比初生壁厚得多并且愈发刚硬。
半纤维素往往具有两种以上的糖基,连接糖基的苷键类型也至少在两种以上。半纤维素的组成和结构上的分类学特征在初生壁和次生壁中各有表现。植物在生长时,细胞壁中的半纤维素还可能同其它高聚物形成化学连接。由于半纤维素结构的复杂性,对半纤维素的界定至今都值得商榷。半纤维素至所以一开始被这样称呼,是人们在研究早期遇到它时以为它是纤维素的一部分或者就以为它是纤维素;后来,人们把半纤维素界定为植物细胞壁中可以用碱液提取出的多糖。然而,这种依据性质而不是按其组成和结构界定化学成分的作法是不严谨的。半纤维素作为一种高分子物质,它的糖基组成、聚合度、支链化程度、分子链是否携带电荷以及携带电荷的密度等都会对其溶解性能产生明显的影响。此外,有些半纤维素不仅存在于植物的细胞壁中,有时也会像淀粉一样,被当作“食粮”贮存在某些植物的种子中。比如,木葡聚糖是陆生植物细胞壁中都能发现的一种半纤维素,但是它还会出现在罗望子种子中。阿拉伯糖基木聚糖是谷物胚乳中的一种半纤维素,此时它无须用碱就很容易释放出来。而石松门植物中普遍存在的果胶并不属于半纤维素,但它们却可以用碱液提取出来。显然,诸如此类的事例都与上述界定相悖。因此,对半纤维素进行准确的界定只有从它的结构特征入手。1984年,美国的Reddy等人就进行了这方面的尝试。他们认为,半纤维素是一种杂聚糖,取决于来源,它至少有2~4种糖基组成[1]。按照这样的界定,以聚半乳糖醛酸为主要成分的果胶因其支链上有多种糖基也将被划入半纤维素之中,而被广泛认可的一种半纤维素β-(1→3,1→4)葡聚糖则因其中只有一种糖基将不再属于半纤维素。无疑,这样的界定会颠覆传统的多糖分类习惯。2010年,丹麦的Scheller和Ulvskov重新对半纤维素进行了结构上的界定:半纤维素是一种植物细胞壁多糖,其主链由平伏键构型(equatorial configuration)的 β-(1→4)键连接而成(图1)[2]。这一界定的重要意义在于首次指出了半纤维素的重要结构特征是主链上具有平伏键构型的β-(1→4)键。不过,纤维素也同样具这样的结构特征;并且前面已经提到,植物中的半纤维素不仅只存在于细胞壁中。因此,尼日利亚的 Ogaji等人在2011年指出:半纤维素主链由具有平伏键构型的β-(1→4)键连接而成,但纤维素是结晶并无支链的,而半纤维素是无定形且有支链的[3]。显然,他们在界定半纤维素时已经考虑到要弥补丹麦同行的疏忽,但这样的界定仍有瑕疵:比如,前面提到的一种半纤维素β-(1→3,1→4)葡聚糖偏偏就没有支链。到了2012年,北京林业大学的王堃等人对半纤维素的界定是:半纤维素是不同的糖单元以平伏键构象按不同比例排列起来的杂聚糖(heteropolysaccharide或heteroglycan)[4]。本人对王堃等人这样的界定不敢苟同。因为多糖支链中的糖基种类和糖苷键类型往往比主链更复杂多样,包括支链在内的整个分子中所有糖苷键都是平伏键构型是无法想象的。所以,无论是丹麦还是尼日利亚的同行在对半纤维素进行结构界定时仅限制主链中的糖苷键是平伏键构型是非常重要的,只是这两种界定还要稍做些修正。本人认为,似乎可以这样界定:半纤维素是一种杂聚糖,其主链上具有平伏键构象的β-(1→4)键。根据这样的界定,植物体内属于半纤维素的多糖可分为如下几类:木葡聚糖,木聚糖,β-(1→3,1→4)-葡聚糖,甘露聚糖和葡甘聚糖。而主链上的糖苷键不是平伏键构型但有时也会划入半纤维素中的多糖,如半乳聚糖、阿拉伯聚糖和阿拉伯糖基半乳聚糖将不再属于半纤维素;实际上,这些多糖是否属于半纤维素本来就尚无明确定论,并且它们在植物体内合成时似乎就是果胶分子的一部分[2]。所以,这样界定将使习惯上的植物多糖分类更加明确合理。

图1 半纤维素的结构特征
1 木葡聚糖
除了在轮藻中还没有发现,从苔藓植物开始,木葡聚糖是存在于每一种陆生植物中的一类半纤维素[5-7]。木葡聚糖和纤维素一样,具有以(1→4)键连接β-Glc基而形成的主链;和纤维素不同的是,木葡聚糖还具有主要由Xyl,Gal,Fuc,Ara等糖基组成的支链。木葡聚糖的结构较为复杂,尤其是其支链。为了简洁而清晰地表示各种木葡聚糖分子中的支链,目前都习惯用一个英语大写字母表示木葡聚糖中的某一特定支链与主链上连接这个支链的Glc基:

本文就将使用这种方法表示木葡聚糖的支链类型。对于这张单子,需要指出的是,上面所开列的木葡聚糖支链只是已经鉴定了结构的支链类型,并非是植物中所有木葡聚糖的支链类型。Penã等人在几年前开始、目前仍在进行中的苔藓木葡聚糖研究就很可能在这张单子上再开列出更多的木葡聚糖支链类型[8]。
近来的研究结果表明木葡聚糖的这些支链具有功能和分类学的意义。木葡聚糖的结构差异在分类学上意义最为深远的是带电和不带电的支链。在苔藓植物中发现的是前者[9],而维管植物的木葡聚糖是电中性的。维管植物之间木葡聚糖的主要差别在于重复的低聚木葡糖结构XXGG或XXXG是否占主导地位[10]。木葡聚糖一般不同程度地乙酰化了,乙酰基大部分是接在支链Gal基的O-6位上形成6AcGal基。
值得一提的是,木葡聚糖的一个生理作用是信号分子的来源,它最主要的的降解产物是XXFG,已经证实,XXFG消除了植物生长素对细胞扩展的诱导[11-13]。它抑制植物生长素活性的浓度可低至1 n M。木葡聚糖的其它低聚物,尤其是XXLG和XLLG反而是能够促进所有细胞扩展的,只是要在高浓度的情况下[14]。
1.1 被子植物中的木葡聚糖
除了单子叶中的禾本目(Poales)植物之外,木葡聚糖是种子植物初生壁中最丰富的半纤维素。双子叶植物的初生壁中木葡聚糖含量尤其令人瞩目,一般高达20% ~30%;而在种子植物的次生壁中,木葡聚糖的含量并不高。许多双子叶植物的木葡聚糖主链由重复的纤维四糖(XXXG)组成,最初的三个Glc基(从非还原端开始计)的6-位上带有一个α-Xyl,这里重复的二糖单位α-Xyl-(1→6)-Glc就是异樱草糖(isoprimeverose),第四个Glc基本上是未取代的。除了这种以Glc4为基点的XXXG重复结构外,有的Xyl基(尤其是从非还原端的开始后的第三个)在2-位上还带有一个β-Gal基,而这个β-Gal基往往在其2-位上又带有一个α-Fuc基(图2),这就是可能出现的XXFG结构。除此之外,双子叶植物中的木葡聚糖还可能伴有少量的XXLG,XLFG及XLLG结构。某些双子叶植物,如茄目和唇形目植物,其木葡聚糖中的XXXG重复结构却很少甚至没有;然而,橄榄(唇形目)中的木葡聚糖却是XXXG型的(主要的重复单元是XXSG和XLSG)。
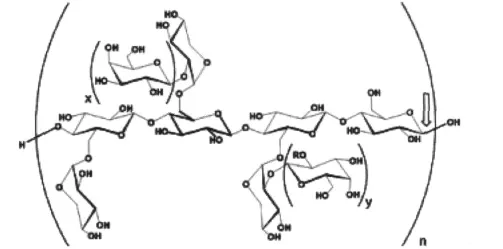
图2 双子叶植物木葡聚糖的一般结构
和双子叶植物相比,在鸭跖草类单子叶植物的初生壁中木葡聚糖占主导地位的是低取代度的XXGG型木葡聚糖。它们是低含量的,一般占次生壁的5%。需要指出的是,这些数据指的是具有扩展能力的细胞,停止生长后木葡聚糖的含量将有所下降。单子叶的禾本目植物在初生壁中的木葡聚糖不仅Xyl基含量低,Gal基、Ara基和Fuc基也非常少。这说明此类木葡聚糖的分子链上支链较少。因此,用碱抽提禾本目植物所得到的木葡聚糖在水中的溶解性较差,它可列入在中性时沉淀的半纤维素A中。
目前,市售的木葡聚糖是从罗望子种子中提取的。该产品在结构中除了缺少Fuc基,和槭属植物的木葡聚糖十分相像。
异樱草糖是木葡聚糖中最具特征的重复单元,这在其它聚合物中未曾所闻。在崩溃酶的作用下,基本上所有其它糖基都可作为游离单糖释放出来,而6AcGal基似乎也是以Gal和乙酰基被相关的崩溃酶释放;但崩溃酶缺乏可以检测到的α-木糖苷酶活性,α-Xyl基对崩溃酶是相当稳定的,所以可以用崩溃酶简单地检测木葡聚糖。用崩溃酶分解木葡聚糖时,异樱草糖就可以定量地释放出来。
1.2 裸子植物中的木葡聚糖
迄今为止,所研究的裸子植物(主要是针叶树)细胞壁成分类似于双子叶植物,这包括含XXXG,XLFG,XXLG和XLLG重复结构的木葡聚糖,它主要在初生壁中,但含量不高(约 10%)[15]。
1.3 苔藓植物中的木葡聚糖
苔藓植物像所有陆生植物一样,含有木葡聚糖,尽管和维管植物相比往往所占比例较小。最直接的证据是用崩溃酶分解苔藓植物时产生的异樱草糖。2007年开始,Peãa等人已开始进行了这方面的工作[8]。他们意外地发现,从小立碗藓中得到的低聚木葡糖产物含酸性糖基支链。从角苔属的金鱼藻中也发现了一些奇特的木葡聚糖。相关研究人员认为这是一种经陆生植物进化而保留下来的木葡聚糖。
1.4 关于轮藻植物
这是亲缘关系与陆生植物最接近的海藻群。可惜的是人们对轮藻植物细胞壁组成的研究不是很多。已经知道,它们含有纤维素,富含GalA基,这说明它们是含有果胶这种不同于半纤维素的杂聚糖。酸解克里藻和轮藻,从细胞壁中可得到大致相等的Xyl和Glc。但是用崩溃酶分解轮藻,鞭毛藻和克里藻的细胞壁或半纤维素时得不到异樱草糖,这表明缺少常见的木葡聚糖。轮藻细胞壁的许多信息还有待于发现,这将有助于我们了解陆生植物细胞壁的原始特征。[7]
2 木聚糖
木聚糖不仅广泛存在于被子植物中,也存在于松柏类这样的裸子植物中。对单子叶的鸭跖草亚纲(包括禾本科植物和某些相关的品种)植物而言,初生壁和次生壁的半纤维素均以木聚糖为主。除它们之外的上述植物,木葡聚糖是初生壁内主要的半纤维素,木聚糖则是次生壁内主要的半纤维素。木聚糖具有经(1→4)键把β-木糖(Xyl)基连接成主链的共同结构特征。实际上“木聚糖”这个术语涵盖了具有这种主链的所有半纤维素;而其支链结构也同木葡聚糖一样表现出明显的分类学特征,只是并不像木葡聚糖那样具有重复的结构。这些木聚糖也往往具有不同程度的乙酰化。
2.1 双子叶植物中的木聚糖
在双子叶植物的初生壁中,木聚糖含量在5%左右,但在其次生壁中可高达20% ~30%。这种木聚糖的乙酰基主要接在主链Xyl基的O-3位上,而接在O-2位上的较少。双子叶植物木聚糖的支链上还带有α-Ara基,α-GlcA基和α-MeGlcA基,因此,双子叶植物的木聚糖有一个更完整的名称:葡萄糖醛酸木聚糖。在这种木聚糖的基本结构当中,α-GlcA基是接在主链Xyl基的 O-2位上,L-D-Araf基则是在其O-2位及O-3位上取代,但主要是O-2位上取代。一般说来,双子叶木聚糖中Araf基的取代度是比较低的,但在悬铃木的初生壁[16],亚麻子壳[17]及车前草种子的木聚糖中[18]这种糖基却是是丰富的,而在亚麻粘液的此类半纤维素中该糖基是双取代的[19],在车前草种子的木聚糖中它主要接在O-3位上[20]。在双子叶植物和属于裸子植物的针叶树中,木聚糖都有一个多少令人感到意外的特点:其还原末端有一个守恒的低聚糖,β-D-Xylp-(1→4)-β-D-Xylp-(1→3)-α-l-Rhap-(1→2)-α-D-GalpA-(1→4)-DXylp[20-23]。
2.2 单子叶植物中的木聚糖
单子叶植物细胞壁中木聚糖的分布和结构是最能显示其分类学特征的,其中的鸭跖草亚纲更是如此。槟榔目(棕榈目)是鸭跖草类植物中比较独特的,这些植物类似于非鸭跖草类的植物,即在细胞壁中以果胶为主要的基质多糖,只有少量在2-,3-位上带有支链的阿魏酰木聚糖,并极有可能还有岩藻酸酯化的木葡聚糖[24-25],这些特征似乎代表着和槟榔目地位相吻合的过渡形态而作为鸭跖草分支中一个最小的衍生类别。除槟榔目以外,在鸭跖草亚纲的单子叶植物中,木聚糖是细胞壁中最主要的半纤维素,它要占到初生壁的20% ~40%,在次生壁中更是高达40%~50%。而木葡聚糖在禾本科植物的初生壁中只有2% ~5%,在次生壁中就更少了。单子叶植物细胞壁中的木聚糖和双子叶植物中的木聚糖相比,Ara基的取代度明显要高,另一方面这些木聚糖和双子叶木聚糖一样,仍含有GlcA基或MeGlcA基,因此,单子叶植物木聚糖更具体的名称是葡萄糖醛酸阿拉伯糖基木聚糖,有时也称作阿拉伯糖基木聚糖。这种木聚糖中还可能含有比Araf基更多的GlcA基,但在谷物的胚乳中这种木聚糖却几乎是不含GlcA基的。所以把谷物中的木聚糖称作阿拉伯糖基木聚糖更准确些。禾本科植物木聚糖大部分的Araf基是接在主链Xylp基的O-3位上的,而禾本科植物胚乳的木聚糖中Araf基则双取代在主链Xylp基的O-2和O-3位上[26]。这种木聚糖的支链可能是单糖基的,也可能是低聚糖构成的。支链中的糖基一般有:α-L-Araf基,β-D-Xylp基,D-Galp基和L-Galp基等。在单子叶植物中,除了天冬目和百合目外,禾本目,姜目及棕榈目的木聚糖有一个非常重要的特征,就是其中的某些Araf基的O-5位上有酯化的阿魏酸或香豆酸。这就是在某些场合下禾本科植物的木聚糖被称作阿魏酰化阿拉伯糖基木聚糖的原因。通过阿魏酸的脱氢氧化耦合,这些木聚糖可以彼此交联起来,这类木聚糖还会通过阿魏酸与木素结合。两个木聚糖分子上的阿魏酰基彼此是以8-O-4醚键耦合起来的。还可以看到,凡支链含有Araf基的低聚糖,Araf基必处于与主链Xyl基毗邻的支链末端。在这些木聚糖中含Ara基的支链出现率很高,因此人们往往通过Ara基与Xyl基比值的大小大致反映木聚糖的支链化程度。支链化程度高的木聚糖溶解性好。例如,玉米麸皮中木聚糖的支链化度高达70%,它的阿拉伯糖含量就相当高,所以它的溶解性也较好,用稀碱就可将其溶出。
当用崩溃酶分解细胞壁时,木聚糖的主链断裂,形成了含木糖和木二糖的混合物,其产量是评估木聚糖含量的依据。木二糖是一种特别有用的特征性片断,就如同木葡聚糖中的异樱草糖。木二糖在崩溃酶中是十分稳定的。但是崩溃酶中缺少α-D-葡萄糖醛酸酶,因此在崩溃酶分解木聚糖时,GlcA基和MeGlcA基最终是随低聚糖而去的。
3 甘露聚糖
甘露聚糖的主链由富含(或完全由)(4→1)键的β-Man基组成。其中,包括了在这种主链上接有β-Glc基和∕或α-Gal基作为支链的多糖,甘露聚糖可具体分为甘露聚糖,葡甘聚糖,半乳甘露聚糖和半乳葡甘聚糖。在甘露聚糖和半乳甘露聚糖中,主链完全是由Man基组成的(图3);而在葡甘聚糖和半乳葡甘聚糖中,主链由Man和Glc两个糖基共同以β-(1→4)苷键连接而成,不过,它们并不以重复模式排列(图4)。

图3 半乳甘露聚糖的结构

图4 魔芋葡甘聚糖的结构
甘露聚糖是轮藻中的主要半纤维素[6-7]。甘露聚糖似乎在早期的陆生植物中就非常丰富了,而在苔藓植物[27]和石松门植物[28]中更丰富。在种子植物中,属于裸子植物的针叶树和苏铁类植物就经常显示出细胞壁中含有较多半乳甘露聚糖的特征;而买麻藤纲植物却并非如此[17],它可能是裸子植物中最亲近被子植物的。被子植物的细胞壁中甘露聚糖和葡甘聚糖一般就谈不上丰富了,似乎是其它类型的半纤维素在很大程度上取代了它们。双子叶植物中的初生壁和次生壁中都含有少量的(葡)甘露聚糖(各为2% ~5%)。单子叶的禾本科植物细胞壁中也是如此(分别为2%和0~5%),这时它主要存在于表皮细胞的细胞壁中,此处是抑制器官发育时特别重要的场所。
因为大量重要的经济作物,如椰子、瓜尔豆和刺槐豆等,人们才充分了解了半乳甘露聚糖。半乳甘露聚糖在豆科植物的胚乳中尤其丰富,不过在其它种子中也有。葡甘聚糖存在于魔芋中,此时贮存它的是球茎和种子。已经有人认为,从植物分类的视角看,在种子贮存糖类方面,半纤维素和淀粉一样,其作用也是重要的[29]。
4β-(1→3,1→4)-葡聚糖
在整个禾本目植物(包括最基本的鞭藤科)中都存在着β-(1→3,1→4)-葡聚糖。最近还发现,这些混合连接的葡聚糖以含有β-(1→3)键的纤维三糖和纤维四糖片断为主(图5),但也有更长的β-(1→4)键连接片断存在[30]。在初生壁中,这种混合连接的葡聚糖在细胞扩展时发挥作用并且其量的多少和生长阶段密切相关,在细胞完成扩展时,其细胞壁中的β-(1→3,1→4)-葡聚糖就会大量减少[31-33]。在生长的细胞中,这种半纤维素以氢键非常坚固地与纤维素缔合在一起[34]从而束缚住纤维素的微纤丝[35]。在谷物中同样存在着β-(1→3,1→4)-葡聚糖,但它们并不存在与纤维素的氢键缔合。目前市售的β-(1→3,1→4)-葡聚糖就是从大麦谷粒中提取的。

图5 β-(1→3,1→4)-葡聚糖的常见结构
β-(1→3,1→4)-葡聚糖一旦用碱提出就成为柔顺分子在中性的水中溶解,这明显不同于和它结构十分接进的β-(1→4)-葡聚糖(即纤维素),后者在水中是极度不溶的。
很长一段时间以来,人们一直认为β-(1→3,1→4)-葡聚糖只存在于禾本目的植物中;然而,近来发现,这种类型的半纤维素也同样存在于木贼属植物(蕨类)中[36-37]。然而,除了禾本目植物外,大量的种子植物类群中并不存在这种半纤维素,这种半纤维素是一个保留下来的古老特征,只是在大量种子植物类群中消失了,还是又在禾本目植物逐步独立形成的,目前科学家们并不能解释。
缩略词:Glc—葡萄糖;Gal—半乳糖;Man—甘露糖;Xyl—木糖;Ara—阿拉伯糖;Rha—鼠李糖;Fuc—岩藻糖;GlcA—葡萄糖醛酸;GalA—半乳糖醛酸;Glcp—吡喃葡萄糖;Xylp—吡喃木糖;Araf—呋喃阿拉伯糖。
[1] Reddy N R,Palmer J K,Pierson M D.Hydrolysis of wheat straw hemicellulse and heteroxylan(larch wood)by human colon Bacteriodes ovatus B4-11 enxymes[J].J Agric Food Chem,1984,32:840-844.
[2] Scheller H V,Ulvskov P.Hemicellulose[J].Annu.rev.Plant Biol,2010,61:263-289.
[3] Ogaji I J,Nep E I,Audu-Peter J D.Advances in Natural Polymers as Pharmaceutical Excipients[J].Pharm Anal Acta,2012,3(1):146-162.
[4] Wang K,Yang H,Yao X,et al,Structural transformation of hemicelluloses and lignin from triploid poplar during acid-pretreatment based biorefinery process[J].Bioresource Technology,2012,116:99-106.
[5] Moller I,Søensen I,Bernal AJ,et al.High-throughput mapping of cell wall polymers within and between plants using novel microarrays[J].Plant J.2007,50:1118-1128.
[6] Popper Z A.Evolution and diversity of green plant cell walls[J].Curr.Opin.Plant Biol.2008,11:286-292.
[7] Popper Z A,Fry S C.Primary cell wall composition of bryophytes and charophytes[J].Ann Bot,2003,91:1-12.
[8] Penã M J,Darvill A G ,York W S,et al.Structural diversity of xyloglucans in the cell walls of land plants[J] .Physiologia Plantarum ,2007,130.
[9] Penã M J,Darvill A G,Eberhard S,et al.Moss and liverwort xyloglucans contain galacturonic acid and are structurally distinct from the xyloglucans synthesized by hornworts and vascular plants[J].Glycobiology,2008,18:891-904.
[10] Vincken J P,York W S,Beldman G,et al.Two general branching patterns of xyloglucan,XXXG and XXGG[J].Plant Physiol,1997,114:9-13.
[11] York W S,Darvill A G,Albersheim P.Inhibition of 2,4-dichlorophenoxyacetic acid-stimulated elongation of pea stem segments by a xyloglucan nonasaccharide[J].Plant Physiol,1984,75:295-297
[12] McDougall G J,Fry S C.Inhibition of auxin-stimulated growth of pea stem segments by a specific nonasaccharide of xyloglucan[J].Planta,1988,175:412-416.
[13] McDougall G J,Fry S C.Structure-activity relationships for xy-loglucan oligosaccharides with antiauxin activity[J].Plant Physiol,1989,89:883-887.
[14] McDougall G J,Fry S C.Xyloglucan oligosaccharides promote growth and activate cellulase:evidence for a role of cellulase in cell expansion[J].Plant Physiol,1990,93:1042-1048.
[15] Popper Z A ,Fry S C.Primary cell wall composition of pteridophytes andspermatophytes[J].New Phytologist,2004,164:165-174.
[16] Darvill J E,McNeil M,Darvill A G,et al.Structure of plant cell walls.XI.Glucuronoarabinoxylan,a second hemicellulose in the primary cell walls of suspension-cultured sycamore cells[J].Plant Physiol,1980,66:1135-1139.
[17] Fischer M H,Yu N,Gray G R,et al.The gel-forming polysaccharide of psyllium husk(Plantago ovata Forsk)[J].Carbohydr Res,2004,339:2009-2017.
[18] Naran R,Chen G,Carpita N C.Novel rhamnogalacturonan I and arabinoxylan polysaccharide of flax seed mucilage[J].Plant Physiol,2008,148:132-141.
[19] Darvill J E,McNeil M,Darvill A G,et al.Structure of plant cell walls.XI.Glucuronoarabinoxylan,a second hemicellulose in the primary cell walls of suspension-cultured sycamore cells[J].Plant Physiol,1980,66:1135-1139.
[20] Johansson M H,Samuelson O.Reducing end groups in birch xylan and their alkaline degradation[J].Wood Sci Technol,1977,11:251-263.
[21] Penã M J,Zhong R,Zhou G K,et al.Arabidopsis irregular xylem8 and irregular xylem9:Implications for the complexity of glucuronoxylan biosynthesis[J].Plant Cell,2007,19:549-563.
[22] Shimizu K,Ishihara M,Ishihara T.Hemicellulases of brown rotting fungus,Tyromyces palustris.II.The oligosaccharides from the hydrolysate of a hardwood xylan by the intracellular xylanase[J].Mokuzai Gakkaishi,1976.22:618-625.
[23] Andersson S I,Samuelson O,Ishihara M,et al.Structure of the reducing end-groups in spruce xylan[J].Carbohydr Res,1983,111:283-288.
[24] Carnachan S M,Harris P J.Polysaccharide compositions of primary cell walls of the palms Phoenix canariensis and Rhopalostylis sapida[J].Plant Physiol Biochem 2000,38:699-708.
[25] Harris P J,Kelderman M R,Kendon M F,et al.Monosaccharide compositions of unlignified cell walls of monocotyledons in relation to the occurrence of wall-bound ferulic acid[J].Biochem Syst Ecol,1997,25:167-179.
[26] Ebringerovã A,Hromãdkovã Z,Heinze T.Hemicellulose[J].Adv Polym Sci,2005.186:1-67.
[27] Harholt J,Ulvskov P,Søensen I,et al.2008.http://wiki.genomics.purdue.edu/index.php/Cell wall composition and glycosyltransferases involved in cell wall formation.
[28] Kohler A,Kauss H.Transfer of hydroxycinnamoyl residues to microsomal proteins from parsley[J].Phytochemistry,1997,44:225-228.
[29] Meier H,Reid J S G.Encyclopedia of Plant Physiology[M].Berlin:Springer,1982:418-471.
[30] Stone B A,Clarke A E.Chemistry and Biology of(1→3)-β-Glucans[M].Bundoora:La Trobe Univ Press,1992.
[31] Christensen U.(1,3;1,4)- β -D-glucan and arabinoxylan in grasses—biosynthesis,function and application[D].Copenhagen:Frederiksberg Univ,2009.
[32] Gibeaut D M,Pauly M,Bacic A,et al.Changes in cell wall polysaccharides in developing barley(Hordeum vulgare)coleoptiles[J].Planta,2005,221:729-738.
[33] Obel N,Porchia A C,Scheller H V.Dynamic changes in cell wall polysaccharides during wheat seedling development[J].Phytochemistry,2002,60:603-10.
[34] Carpita,N C,Defernez M ,Findlay K.,et al.Cell wall architecture of the elongating maize coleoptile[J].Plant Physiology ,2001,127:551-565.
[35] Fry,S C.Cellulases,hemicelluloses and auxin-stimulated growth:a possible Relationship[J].Physiologia Plantarum,1989,75:532-536.
[36] Fry S C,Mohler K E,Nesselrode B H W A,et al.Mixed-linkage(1→3.1→4)beta-D-glucan:xyloglucan endotransglucosylase,a novel wall-remodelling enzyme from Equisetum(horsetails)and charophytic algae[J].Plant J,2008,55:240-252.
[37] Sorensen I,Pettolino F A,Wilson S M,et al.Mixed-linkage(1→3.1→4)-beta-D-glucan is not unique to the Poales and is an abundant component of Equisetum arvense cell walls[J].Plant J,2008,54:510-521.
Taxonomically Restricted Features about the Structure of Hemicelluloses
Zhang Xiaomin
(Nanjing Institute for Comprehensive Utilization of Wild Plants ,Nanjing 210042,China)
Hemicellulose was defined by its structural charateristic.The detailed structure of the hemicelluloses and their abundance vary widely between different species and cell types.This paper summarized the structures and taxonomic distribution of hemicelluloses from charophytes to land plants.Furthermore,primary and secondary walls were compared.
hemicellulose;heteropolysaccharide;equatorial configuration;xyloglucan;xylan;mannosan;β -(1→3,1→4)-glucan
Q945
A
1006-9690(2012)05-0001-07
10.3969/j.issn.1006-9690.2012.05.0001
2012-03-12

