实验性高脂血症恒河猴模型的初步建立及分析
杨凤梅,李艳艳,鲁帅尧,赵 远,禹文海,陈丽雄,王俊斌,和占龙
(中国医学科学院 北京协和医学院医学生物学研究所,云南省重大传染病疫苗研发重点实验室,昆明 650118)
实验性高脂血症恒河猴模型的初步建立及分析
杨凤梅,李艳艳,鲁帅尧,赵 远,禹文海,陈丽雄,王俊斌,和占龙
(中国医学科学院 北京协和医学院医学生物学研究所,云南省重大传染病疫苗研发重点实验室,昆明 650118)
目的 建立实验性高脂血症恒河猴模型,为人类高脂血症研究提供理想动物模型。方法 设计高脂实验饲料配方并检测常规营养成分,用高脂饲料诱导实验性高脂血症恒河猴模型,分别在2个月、4个月、6个月后监测体重、血清总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)等指标,对其血脂指标的变化趋势进行分析。结果 模型组在实验2个月、4个月时的日采食量和摄入能量均低于对照组(P<0.05),但体重则无明显变化(P>0.05);而在实验6个月时日采食量和摄入能量与对照组无显著性差异(P>0.05),体重有显著性差异(P<0.05);模型组与对照组的 TC、TG、HDL-C、LDL-C在实验前和2个月比较无显著性差异(P>0.05);在4个月比较时TC、TG、LDL-C有显著性差异(P<0.05),而HDL无显著性差异(P>0.05);在6个月比较时 TC、LDL-C有显著性差异(P<0.05),并且 TC、LDL-C远远高于恒河猴血脂的正常参考值水平,而 TG、HDL-C则无显著性差异(P>0.05);变化趋势分析结果为,模型组 TC和 LDL-C水平有递增趋势、TG水平则出现了先递减后逐渐恢复的趋势、HDL-C水平未出现明显变化趋势。结论 模型组恒河猴具有高胆固醇血症和高低密度脂蛋白血症的特征,已经初步建立了实验性恒河猴高脂血症动物模型。
血脂;高脂血症;模型,动物;恒河猴
随着人类生活水平的日益提高,高脂血症的发病率也逐年增加,相关的医学研究表明动脉粥样硬化是导致心脑血管疾病的主要病理因素,而血脂代谢紊乱导致的高脂血症又是动脉粥样硬化重要的危险因素,可见高脂血症是脑卒中、冠心病、心肌梗死、猝死等心脑血管疾病的危险因素。因此,阐明高脂血症的发病机制,探索高脂血症的有效预防与治疗对其相关疾病的研究和控制具有重要意义。高脂血症动物模型不仅是研究人类高脂血症发病机理的有效工具,也是开展脂代谢异常及动脉粥样硬化研究的重要的手段。目前,用于高脂血症动物模型研究的实验动物主要有兔、大鼠、小鼠等,采用与人类遗传和生理生化指标都较为接近的恒河猴作为模型的在国内还未见报道[1-4]。因此,本实验选用恒河猴作为实验动物,用高脂饲料饮食诱导方法,初步建立实验性高脂血症恒河猴模型并对其血脂指标变化趋势进行分析,为人类高脂血症的研究提供理想动物模型。
1 材料与方法
1.1 实验动物
实验恒河猴来源于中国医学科学院医学生物学研究所医学灵长类研究中心,普通级恒河猴实验动物生产许可证号:SCXK(滇)2010-0006;实验过程在中国医学科学院医学生物学研究所动物实验设施中进行,实验动物使用许可证号为:SYXK(滇)2010-0009,并按实验动物使用的3R原则给予人道关怀。
1.2 仪器设备
移液器 (eppendorf 100 μL)、离心机 (Thermo LEGEND MICRO 21R)、罗氏全自动生化分析仪(P800)。
1.3 方法
1.3.1 实验饲料的设计与制作:实验组模型饲料的设计以高脂、高热量为特点,使用特殊预混料;因高脂导致饲料较难形成颗粒,通过特殊的加工工艺制作为颗粒饲料,以正常猴群饲料作为对照组,配方见表1,两种饲料的常规营养成分见表2。
1.3.2 动物分组及高脂血症模型的诱导:随机挑选正常饲养的成年8岁健康恒河猴共16只,分为两组每组8只,雌雄各半,分别为模型组和对照组。模型组饲喂模型饲料,对照组饲喂正常饲料,自由采食与饮水,测定日采食量和摄入能量,根据恒河猴体型大、善于运动、代谢旺盛等生理特点,本次实验以每两个月测定一次体重、血脂等指标进行监测。
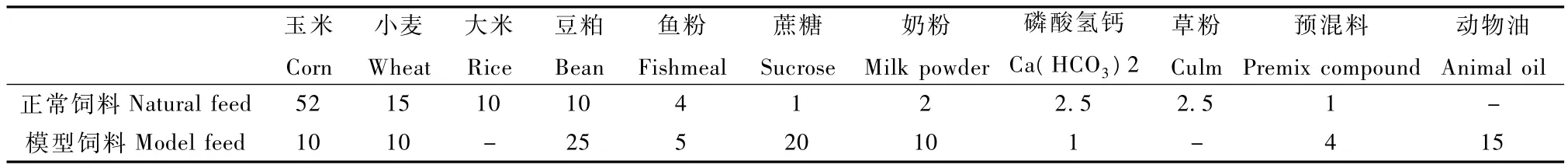
表1 模型饲料与正常饲料的配方(%)Tab.1 Formulation of model feed and natural feed(%)
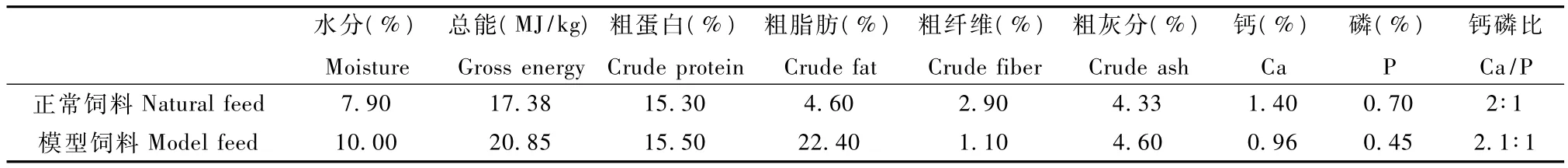
表2 模型饲料和正常饲料的常规营养成分Tab.2 Seven general nutrients of model feed and natural feed
1.3.3 血清样品采集:试验动物空腹12h以上,进行后肢静脉采血2mL,分装在一次性自动定量采血管中,3000r/min离心 30min,收集血清,标记后-20℃冻存备用。
1.3.4 血脂检测:使用罗氏全自动生化分析仪(P800)检测血清样品,TC、TG采用氧化酶法测定,HDL-C、LDL-C 采用直接法测定。
1.4 数据统计分析
2 结果
2.1 模型组和对照组在实验期间的日采食量及日摄入能量的测定结果(见表3)。测定结果表明,在实验2个月、4个月对照组恒河猴的日采食量和摄入能量均高于模型组(P<0.05),这应该是高脂饲料适口性较差以及油腻食物限制进食量等原因造成的结果,而在6个月时,模型组恒河猴的日采食量和摄入能量与对照组在统计学上无显著性差异(P>0.05)。
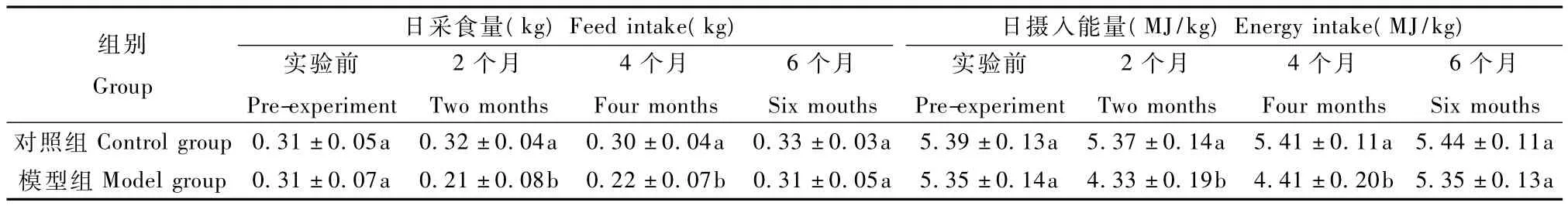
表3 恒河猴高脂血症模型组和对照组在试验期的日采食量及摄入能量测定结果Tab.3 Feed intake and Energy intake of the model group and the control group in experiment
2.2 模型组和对照组在实验期间的体重监测结果(见表4),体重监测结果显示,在实验前、2个月、4个月时,模型组与对照组比较无显著性差异(P>0.05),而在6个月时有显著性差异(P<0.05)。

表4 恒河猴高脂血症模型组和对照组体重监测结果(kg)Tab.4 Weight of the model group and the control group(kg)
2.3 模型组和对照组在实验期间的血脂四项(TC、TG、HDL-C、LDL-C)的监测结果(见表5),结果表明模型组与对照组的 TC、TG、HDL-C、LDL-C 在实验前和2个月比较无显著性差异(P>0.05),在4个月比较时 TC、TG、LDL-C 有显著性差异(P <0.05),而HDL-C没有显著性差异(P>0.05);模型组实验前和4个月时比较 TC、LDL-C呈显著上升(P<0.05),而TG则显著下降(P<0.05);在6个月比较时 TC、LDL-C 有显著性差异(P <0.05),并且 TC、LDL-C远远高于恒河猴血脂的正常参考值水平,而TG、HDL-C 则无显著性差异(P >0.05)。
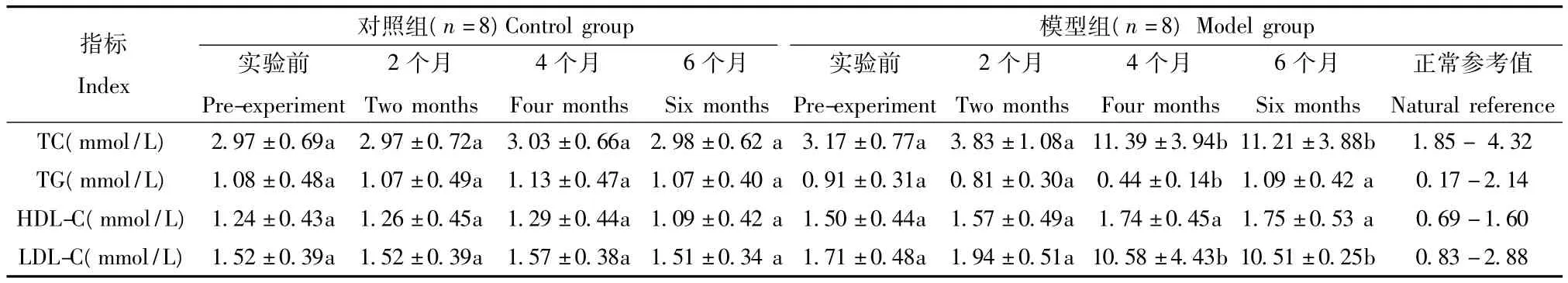
表5 恒河猴高脂血症模型组和对照组血脂四项监测结果Tab.5 Four indexes about lipids of the model group and the control group
2.4 血脂各项指标的分析结果表明,在实验过程中对照组血清 TC、TG、HDL-C、LDL-C 水平均无明显变化,模型组TC水平有递增趋势,并在4个月、6个月时显著增高(P<0.05)(见图1),具备了高胆固醇血症的特征;而TG水平在模型组则出现了先递减后逐渐恢复的趋势,在4个月时显著降低(P<0.05),在6个月时又恢复(见图2),这可能与受试动物胆固醇的摄入和日摄入能量的水平有关,具体机制尚未清楚;HDL-C水平在模型组未出现明显变化(见图3);LDL-C水平在模型组也有递增趋势,并在4个月、6个月时显著增高(P<0.05)(见图4),提示脂代谢紊乱导致了高脂血症。
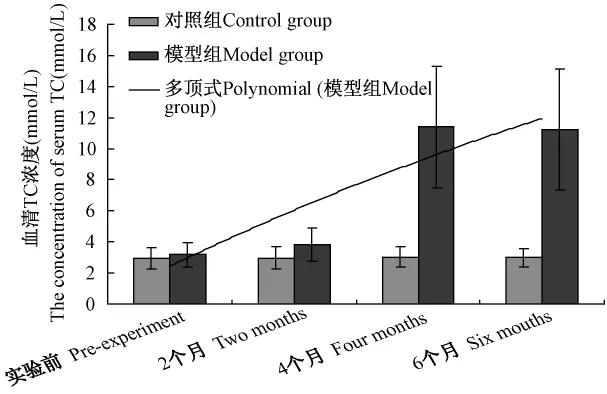
图1 血清TC变化趋势分析Fig.1 Analysis of mutative trend of TC

图2 血清TG变化趋势分析Fig.2 Analysis of mutative trend of TG
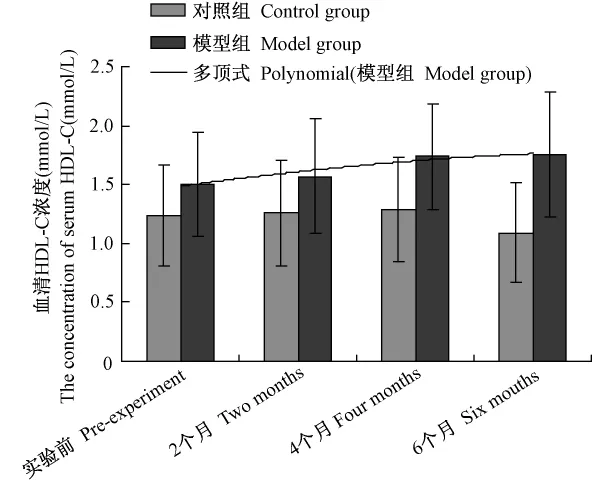
图3 血清 HD{L-C变化趋势分析Fig.3 Analysis of mutative trend of HDL-C
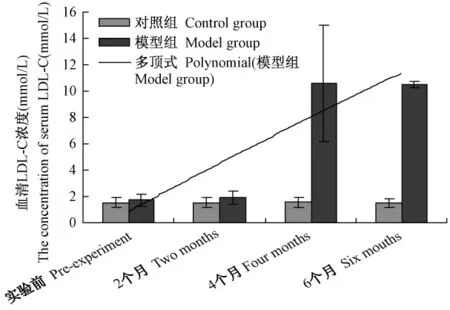
图4 血清LDL-C变化趋势分析Fig.4 Analysis of mutative trend of LDL-C
3 讨论
恒河猴是与人类在进化亲缘关系上仅次于黑猩猩的灵长类动物,具有与人类基因同源性高、免疫反应与人相似等优点,广泛应用于生物医学研究的各个领域。因此,本实验采用恒河猴作为高脂血症的模型动物在实验研究中有独特优势之处。本实验结果表明,采用高脂饲料诱导高脂血症动恒河猴型的过程中,在实验2个月、4个月时模型组的日采食量和日摄入能量均低于对照组,加之本实验所采用的实验猴是生长和代谢都较为稳定的成年猴,导致了试验猴的体重均无明显变化,但在实验6个月时,随着采食量与日摄入量的增加,体重也随之增加。在实验 4个月、6个月时模型组血清 TC、LDL-C明显高于对照组(P<0.05),并稳定维持在一个较高的水平,而 HDL-C无明显变化,这一结果与赵金明等[6]报道的观点相一致;而在4个月时血清TG并未升高,反而明显低于对照组,这与王静凤[7]、刘小美[8]、林卫华[9]报道的结果一致。造成这些结果的可能机制是高脂肪和高TC的摄入使动物体内血液的 TC含量剧增,出现 TC代谢障碍,进而引起机体的血脂代谢紊乱,直接导致LDL-C的代谢障碍并在体内蓄积,从而出现了高TC血症和高LDL-C血症。而实验前期实验组恒河猴血清TG明显降低,可能的机制是TC在体内剧增后促进了肝脏 TG合成,并通过降低β-氧化反应,抑制肝脏脂肪酸代谢和减少肝脏TG向血液分泌,导致血液中TG浓度降低[10];同时因前期高脂饲料组的恒河猴日摄入能量低于对照组,未在体内形成能力蓄积增加体内TG的合成,反而部分地增加了能量的代谢;在6个月时,模型组血清TG已逐渐恢复到正常水平,这可能是随着时间的推移,模型组恒河猴已适应高脂饲料,导致日进食量与日摄入能量的上升,所以血清TG逐渐恢复。
本实验结果说明,采用高脂饲料建立的恒河猴高脂血症动物模型前期表现为血清TC、LDL-C明显升高,血清TG先降后又逐渐恢复。根据高脂血症在临床上的分类,用高脂饲料建立的恒河猴高脂血症动物模型符合高 TC血症和高 HDL-C血症的特征[10-12],模型构建基本成功。通过各项指标分析,本次实验已经初步建立了实验性恒河猴高脂血症动物模型,可为人类部分高脂血症研究提供理想动物模型。同时将延长高脂饮食诱导动物模型的试验周期,观察随着时间的延长受试动物是否会逐步适应高脂饲料而增加采食量和摄入能量,并观察体重的变化趋势;同时观察TG的变化趋势和逆转点,是否会产生混合型高脂血症、高甘油三酯血症、低高密度脂蛋白血症等,结果将在后续的试验中作逐一报道。
[1]钟民涛,黄敏,卢静,等.长爪沙鼠速发型高脂血症模型的初步建立[J].中国实验动物学报,2006,14(3):217-221.
[2]吴韫宏,方显明.家兔实验性高脂血症模型的研究[J].广西中医学院学报,2004,7(2):1-2.
[3]李金莲,高南南,杨润梅.豚鼠高脂血症模型的建立及机制探讨[J].中国实验动物学报,2009,17(2):115-119.
[4]谢忠忱,黄广勇,陈华,等.五指山小型猪高脂血症模型的建立[J].中国比较医学杂志,2006,16(9):537-540.
[5]沈果,田军东,郭相保,等.野生太行山猕猴血液生理生化指标测定与分析[J].四川动物,2011,(2):254-257.
[6]赵金明,朱竞赫,陈 贺,等.不同配方高脂乳剂大鼠高脂血症模型的研究[J].中药药理与临床,2012,28(1):177-180.
[7]王静凤,逄龙,王玉明,等.两种海参对实验性高脂血症大鼠治疗作用的比较研究[J].中国海洋大学学报,2007,37(4):597-600.
[8]刘小美,方肇勤,潘志强,等.两种配方高脂饲料致高脂血症大鼠的证候比较[J].安徽中医学院学报,2008,27(2):33-37.
[9]林卫华,郑定仙,冯丁山,等.大鼠实验性高脂血症模型分析[J].中国热带医学,2010,10(3):324-325.
[10]Liu CH,Huang MT,Huang PC.Sources of Triacylglycerol Accumulation in Livers of Rats Fed a Cholesterol Supplemented Diet[J].Lipids,1995,30:527-531.
[11]FernandezmL.Guineapigsasmodelsforcholesteroland lipoprotein metabolism[J].J Nutrition,2001,131:10-20.
[12]Vander Hooqt CC,de Haan W,Westerp M,et al.Fenof ibrate in creases HDL-cholesterol by reducing cholesteryl ester transfer protein expression[J].J Lipid Res,2007,48(8):1763-1771.
Establishment and Analysis of Experimental Hyperlipidemia Model in Rhesus Monkey
YANG Feng-mei,LI Yan-yan,LU Shuai-yao,ZHAO Yuan,YU Wen-hai,CHEN Li-xiong,WANG Jun-bing,HE Zhan-long
(Institute of Medical Biology,Chinese Academy of Medical Sciences and Peking Union Medical College,Yunnan Key Laboratory of Vaccine Research and Development on Severe Infectious Diseases,Kunming,650118,China)
Objective To establish Rhesus monkey model of hyperlipidemia to provide reliable animal model for the study of human hyperlipidemia.Methods Designed high fat experimental feed formulations and detected its nutrients to feed Rhesus monkey to arouse hyperlipidemias.2 mouths、4 mouths、6mouths later,we monitored the body weight,serum total cholesterol(TC),triglyceride(TG),high-density lipoprotein cholesterol(HDL-C),low density lipoprotein cholesterol(LDL-C),and analyzed the trend of each index above.Results When it was 2 moths and 4 months later,the feed intake and energy intake of model group were lower than control group(P<0.05),but the body weight of model group was not significantly different from that of the control group(P > 0.05);When it was 6 moths,the feed intake and energy intake of model group was not significantly different from that of the control group,and the body weight of model group were significantly different from that of the control group(P <0.05);When it was 2 moths later,the indexes of TC,TG,HDL-Cand LDL-C of the model group were not significantly different from that of the control group(P > 0.05).When it was 4 moths later,the indexes of TC,TG,LDL-C of the model group were significantly different from that of the control group(P <0.05).When it was 6 moths later,the indexes of TC,LDL-C of the model group were significantly different from that of the control group(P < 0.05),and much higher than the normal levels,but the indexes of TG,HDL-C were not significantly different from that of the control group(P > 0.05).According to the monitoring,TC and LDL-C showed a increase trend,TG showed a gradual recovery after the first descending trend,and the HDL-C was not significantly changed.Conclusion Rhesus monkeys of the model group has a feature of high cholesterol and high low-density lipoprotein cholesterol.The paper has initialy established Rhesus monkey model of experimental hyperlipidemia.
Lipid;Hyperlipidemia;Model,animal;Rhesus monkey
R589.2;R332
A
1671-7856(2012)09-0031-05
10.3969.j.issn.1671.7856.2012.009.007
2012-08-25
云南省技术创新人才培养基金(2009CI117);云南省应用基础研究面上项目资助课题(2009ZC185M)。
杨凤梅(1982-),女,研究实习员,硕士,从事实验动物学研究,E-mail:yangfengmeihei@126.com。
和占龙(1972-),男,副研究员,硕士,硕士生导师,从事实验动物学研究,E-mail:hzl@imbcams.com.cn。

