抗草甘膦转基因大豆DNA标准分子构建及多重荧光PCR检测体系的建立
赖心田 刘小青 洪晓明 陈国培 杨国武
(深圳市计量质量检测研究院 广东深圳 518131)
1 前言
近十几年来,随着转基因作物及其加工产品在数量和应用上的逐渐增多,转基因产品及其安全性受到了越来越多的关注[1],同时也给转基因生物安全监管工作带来更大的挑战。不少国家已经对转基因食品进行了限量标识管理,我国也建立了转基因食品的标识管理目录,并纳入了检验检疫和质检部门的检测项目。
目前转基因大豆的检测主要是采用普通PCR和单重荧光定量PCR进行,然而随着TaqMan探针技术的发展[2,3],多重定量 PCR不仅能节省样品及试剂,同时也能实现一管多检的高效率[4-6]。此外,进行转基因作物及其产品的PCR检测使用重组质粒,可以长期稳定保存并与目的基因保持较高同源性,因此,将检测的目的基因片段克隆到质粒载体中制备成阳性参照物,不仅可以使阳性参照物长期稳定保存,而且使检测结果的准确性得到很大的提高[7]。
由于抗草甘膦转基因大豆外源基因的检测包括3个部分:花椰菜花叶病毒的CaMV35S启动子、胭脂碱合成酶的NOS终止子以及5-烯醇丙酮酸莽草酸 -3 - 磷酸合成酶基因 CP4 EPSPS[8],因此,本研究旨在构建稳定、可靠、易制备和保存的抗草甘膦转基因大豆阳性标准分子,建立抗草甘膦转基因大豆的多重荧光PCR检测体系,实现一次PCR反应完成筛选和特异性检测的过程。
2 材料与方法
2.1 材料
转基因抗草甘膦大豆标准品为美国孟山都公司的RRS转基因大豆GTS40-3-2。实验所用的PCR引物和荧光探针由上海生工生物工程公司合成和标记,所用的分子生物学试剂均购自大连宝生物生物工程公司。
2.2 方法
2.2.1 RRS 外源基因片段克隆
取适量RRS转基因大豆标准品,研磨成粉状,采用CTAB法提取大豆基因组,用紫外分光光度计测量其含量,并稀释至50ng/μL作为PCR扩增模板。在PCR扩增中,利用连接引物、CaMV35S、CP4 EPSPS和NOS引物将3个外源基因片段串联在一起并克隆至PMD-18T载体上,构建的质粒命名为PMD18T/SOY,并送上海生工测序。构建及检测中用到的引物[9]如表1所示。

表1 引物表
2.2.2 三重实时荧光PCR体系构建
CaMV35S,CP4 EPSPS,NOS 的荧光引物和探针序列[10]见表2。提取上述构建好的 PMD18T/SOY质粒,并用RNAse消化RNA后稀释至10ng为模板,同时设立空白对照,进行三重荧光PCR,引物和探针浓度均为20mmol/μL,通过调整Mg2+,酶的浓度,引物和探针的量,最终获得25μL如下的三重荧光的体系:2.5μL 10 × r - taq buffer,3μL dNTP 2ulMg2+,13.3μL ddH2O,0.4μL 各引物,0.2μL 各探针,0.2 μL r- taq 酶,1μL 10ng/μL 质粒。荧光PCR的反应条件为:95℃,3min;95℃,15s;60℃,34s;40cycle。

表2 实时荧光PCR引物及探针表
2.2.3 三重荧光定量PCR的检测限值测定
以10ng/μL的PMD18T/SOY质粒进行10倍梯度稀释,质粒浓度分别为 10、1、10-1、10-2、10-3、10-4、10-5、10-6ng/μL,采用 25μL 体系,体系同2.2.2,同时做阴性空白对照,进行三重荧光定量PCR检测限值的测定。
3 结果与分析
3.1 RRS外源基因片段克隆
通过设计的中间引物,将抗草甘膦转基因大豆的CaMV35S、CP4 EPSPS和NOS 3个外源基因融合在一起,采用CaMV35S正向引物和NOS反向引物,以PMD18T/SOY质粒为模板经过PCR扩增后,产物扩增片段碱基理论长度应为549bp,检测结果见图1。
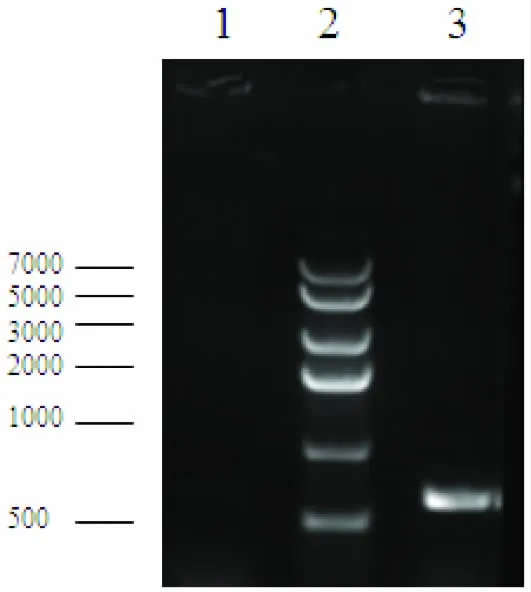
图1 PMD18T/SOY检测结果
图1 显示,扩增条带大小约为550bp,与理论长度一致。PMD18T/SOY质粒插入片断经测序分析与标准序列一致,证实PMD18T/SOY构建成功,可用于转基因定性检测及限值检测的阳性参照物。
3.2 三重实时荧光PCR体系建立及检测限值的测定
经过调整Mg2+、酶的浓度、引物和探针的量获得大于90%的高扩增效率和重复性一致的三重荧光PCR体系,采用构建好的 PMD18T/SOY质粒10ng为模板,获得的结果如图2所示。

图2 三重荧光PCR检测结果
从图2中可看出,CaMV35S、CP4 EPSPS和NOS的Ct值接近,空白无污染,建立的三重荧光PCR体系适合对以该质粒为阳性参照进行的转基因定性检测。此外,以10ng/μL的质粒为母液,并进行10倍梯度稀释进行CaMV35S、NOS和CP4 EPSPS三重荧光PCR检测限值分析,扩增曲线见图3。以质粒浓度的log值为横坐标,以Ct值为纵坐标,建立扩增基因的标准曲线图,见图4。

图3 三重荧光PCR CaMV35S、NOS和CP4 EPSPS检测限值测定结果

图4 三重荧光PCR CaMV35S、NOS、CP4 EPSPS基因标准曲线
图3 和图4显示,3个基因的荧光PCR每个循环呈等差的3-4Ct值增加,Ct值介于13-30之间,且这3个基因的荧光PCR检测限值均为10-3ng/μL,即能检测到1pg的DNA,灵敏度特别高。并且图4中CaMV35S、NOS和CP4 EPSPS的r2值分别为0.998、0.999、0.999,这也说明梯度稀释的质粒模板扩增线性相关性非常好。
4 讨论
使用PMD18T/SOY作为参比分子时,构建的多重荧光定量PCR体系灵敏度极高,可对抗草甘膦转基因大豆进行定性和定量检测。但是,高灵敏度的同时也带来一定的风险性,如果有微量转基因物质气溶胶存在,则很容易造成污染,使空白在Ct值为30多时有峰扬起,因此,需严格控制荧光定量PCR体系配制区与模板加样区的隔离,避免气溶胶等的存在,从而避免出现假阳性。
欧盟联合研究中心标准物质与测量研究所(Institute for Reference Materials and Measurements,IRMM或者ERM)提供的抗草甘磷转基因大豆GTS40-3-2标准物质是 5%、2%、1%、0.5%、0.1%和0%6个浓度梯度的种子粉末,由于不同种子在提取的DNA质量、纯度和复杂程度上很难保持一致,容易导致PCR扩增效率的差异,这都会对转基因成分定量分析的准确度产生一定的影响。此外,种子作为标准物质进行定量检测重复性难以控制,线性相关性也较差。在本研究中,将融合了抗草甘膦转基因大豆的CaMV35S、CP4 EPSPS和NOS 3个外源基因的质粒PMD18T/SOY作为标准物质分子,并在此基础上建立多重荧光PCR,实现一管多检,定量检测未知样品时可稀释到10-6,检测限值达10-3ng/μL,线性关系良好且范围宽,作为参比分子非常精确,在建立的多重荧光PCR中,它的r2均在0.998以上。同时,作为标准分子的质粒可以通过微生物进行大量培养,DNA易于扩增,可提供无限稳定量的标准物质,一个标准分子可以同时包含多个外源目的基因,并且纯度较高。因此与常规的从生物公司购买标准品相比,此方案更具有操作性,更能保证目的片段的扩增效率,降低了转基因检测的成本。
[1] 陈颖,徐宝梁,王曙光,等.实时荧光定量PCR技术在转基因玉米检测中的应用研究[J].作物学报,2004,30(6):602-607.
[2] 朱元招,尹靖东,王凤来,等.抗草甘膦转基因大豆PCR定量检测研究[J].中国农业大学学报,2005,10(3):25-29.
[3] 谭帅.转基因食品检测技术概述[J].大众商务,2009,5:206.
[4] 陈碧华,张建伟,王广印,等.转基因食品检测技术的应用与发展Ⅱ.检测技术的分类、比较、应用及检测步骤[J].食品科学,2008,29(11):705 -711.
[5] 曹泽鸿.转基因食品的检测方法[J].中国食品添加剂,2005,4:100-105.
[6] 赵锦,邓平建,刘建军,等.转基因食品多重定性PCR及实时荧光定量PCR检测方法的研究[J].中国卫生检验杂志,2004,14(4):412 -414.
[7] Burns M,Corbisier P,Wiseman G,et al.Comparison of plasmid and genomic DNA calibrants for the quantification of genetically modified ingredients[J].Eur Food Res Technol,2006,224(2):249-258.
[8] 陈碧华,张建伟,王广印,等.转基因食品检测技术的应用与发展Ⅰ.主要检测技术及其特点[J].食品科学,2008,29(10):698-705.
[9] SN/T 1195-2003大豆中转基因成分的定性 PCR检测方法[S].
[10] SN/T 1204-2003植物及其加工产品中转基因成分实时荧光PCR定性检验方法[S].

