利用异化金属还原菌和锰尾矿处理制药废水
冯雅丽,张茜, ,李浩然,王李娟, ,毕耜超,
(1. 北京科技大学 土木与环境工程学院,北京,100083;
2. 中国科学院过程工程研究所 生化工程国家重点实验室,北京,100190)
异化金属还原(Dissimilatory metal reduction)是指微生物利用金属氧化物作为呼吸作用最终电子受体的还原过程[1−2],异化金属还原菌种主要来自深海沉积物[3]和土壤[4]等,主要应用于微生物燃料电池[5]、生物浸矿[6−7]等方面。利用异化金属还原菌进行生物修复[8]已开始引起关注,相关研究集中在重金属的治理和有机污染物的降解两个方面[9],在废水处理方面的研究相对较少,主要集中于对单一有机物的降解,如芳香化合物[10]和偶氮染料[11]等,在制药废水处理方面未见报道。本文作者从厌氧活性污泥中分离出异化金属还原菌菌种,并对其进行驯化,利用实际制药废水作为底物,以锰尾矿作为氧化剂,考察不同矿用量、反应pH、反应温度等条件对废水处理效果的影响。利用微生物异化还原作用处理制药废水是一种环境友好、以废治废的方法,为废水处理提供了新的途径。
1 实验
1.1 实验材料
培养基成分[12]如下:KCl 0.1 g/L,NH4Cl 0.2 g/L,NaH2PO40.6 g/L,NaHCO32.5 g/L,Wolfe 微量维生素混合液、微量矿物元素混合液(参照美国菌种库ATCC的第1768号培养溶液)各10 mL/L,电子供体醋酸钠10 mmol/L,电子受体Fe(OH)3或锰尾矿按化学计量比例加入。Fe(OH)3由FeCl3和NaOH反应制取,经洗涤后于厌氧培养箱自然干燥保存。
1.2 实验方法
菌种培养方法:将配好的培养基调pH为6.8~7.2,分装入厌氧培养管中密封,于高压灭菌锅于121 ℃灭菌15 min。在厌氧培养箱中进行接种等操作,于30 ℃静置避光厌氧培养。
废水处理实验:在250 mL的锥形瓶中加入一定量废水、锰矿和菌液,通氮气10 min以去除溶液中的氧气,密封置于恒温水浴摇床中,控制反应温度和振荡速度,反应一定时间,定期取样检测。
1.3 分析方法
铁离子的测定采用邻菲罗啉分光光度法;锰离子的测定采用高碘酸钾氧化光度法;pH采用pHS−25型pH计测定;COD采用重铬酸钾滴定法测定。
2 结果与讨论
2.1 菌种的分离和驯化
对厌氧活性污泥中的菌种进行筛选分离,利用NaAc作为电子供体,Fe(OH)3为电子受体[13],接种活性污泥量为10%,Fe(III)被还原的反应见式(1)。经过8 d的厌氧培养,厌氧管中的砖红色Fe(OH)3沉淀变成黑色颗粒,此黑色颗粒具有明显的顺磁性,培养过程中溶液Fe2+浓度随时间变化关系见图1。
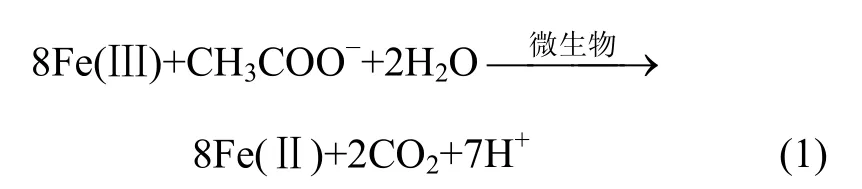
由图1可知:反应初期培养基中Fe2+含量随时间延长迅速增加,表明异化金属还原菌已经开始把Fe3+还原为Fe2+,而Fe2+浓度在3~4 d时达到峰值又逐渐下降,这是因为溶液中Fe2+沉积在Fe(OH)3颗粒表面并与其结合,厌氧管中的黑色颗粒就是反应后形成磁铁矿(Fe3O4)。
菌液的吸光度反映了菌液的浑浊程度,因此可以表征菌种的生长情况[14],测定波长为600 nm,吸光度与时间的关系见图2。由图2可知:随着培养时间的增长,菌液浓度逐渐增加,经过8 d的培养,菌液变得浑浊,说明菌体数目逐渐增多,认为已从活性污泥中分离筛选出异化金属还原菌,将悬浊液于700 r/min离心10 min,取上清液作为接种液。
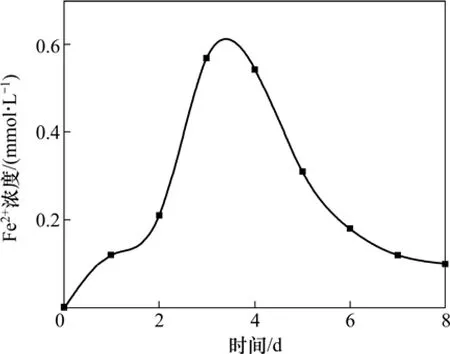
图1 菌种培养阶段菌液中Fe2+浓度的变化Fig. 1 Concentration changes of Fe2+ in microbic liquid during culturing
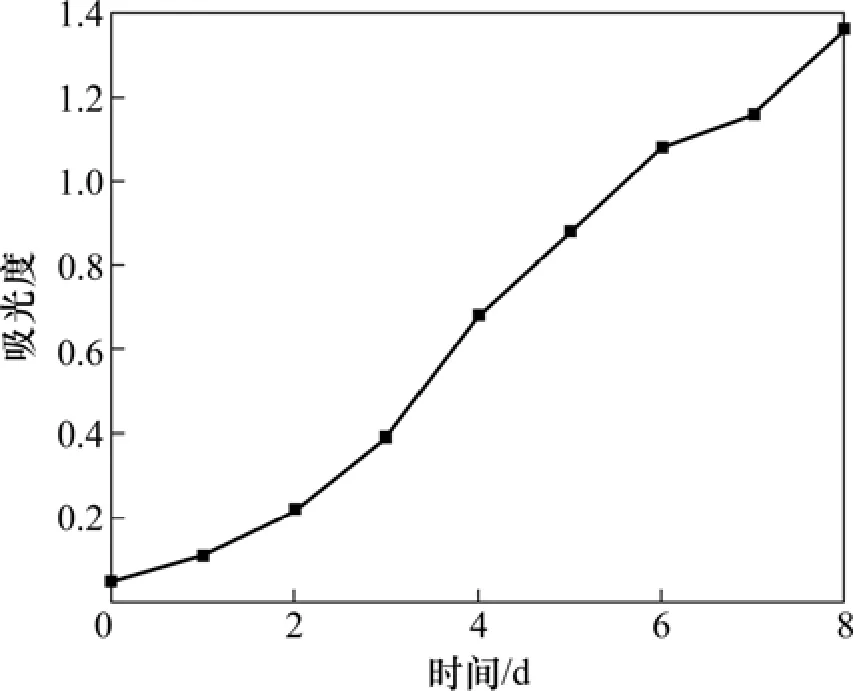
图2 菌种培养阶段中菌液吸光度的变化Fig. 2 Changes of absorbance of microbic liquid during culturing
菌种于培养基中连续培养3代,将富集的菌液接种到以锰尾矿作为电子受体的培养基中,进行菌种的耐矿性驯化试验。以 NaAc作为有机底物时,MnO2作为电子受体,异化金属还原菌还原锰尾矿的过程可用反应式(2)表示,驯化过程中Mn2+浓度如图3所示。
对高校书记校长任期内重大经济事项的决策审计,可采用跟踪法、重点法、公示法等等。对某项经济决策程序进行跟踪,查证领导在决策过程中是否做到程序合法、过程民主、结果科学。从最初的可行性调查开始,到决策过程、决策形成、决策实施、决策效益等情况进行调查,实质性检查决策的规范性、合法性、充分性以及决策执行进度及执行的效果。对一些特殊的经济决策事项可通过向社会公示的方法了解相关情况。重点关注高校的重大经济决策程序是否符合规定,内容是否违背政策法规,其产生的经济效益如何,有无因决策失误造成重大的经济损失。

由图3可见:经过10 d的驯化,Mn2+总浓度逐渐上升,尾矿中的 Mn4+被还原为 Mn2+,表明异化还原菌已逐渐适应锰尾矿。取驯化后的悬浊液于700 r/min离心 10 min,得到的上清液作为之后实验的接种液保存。
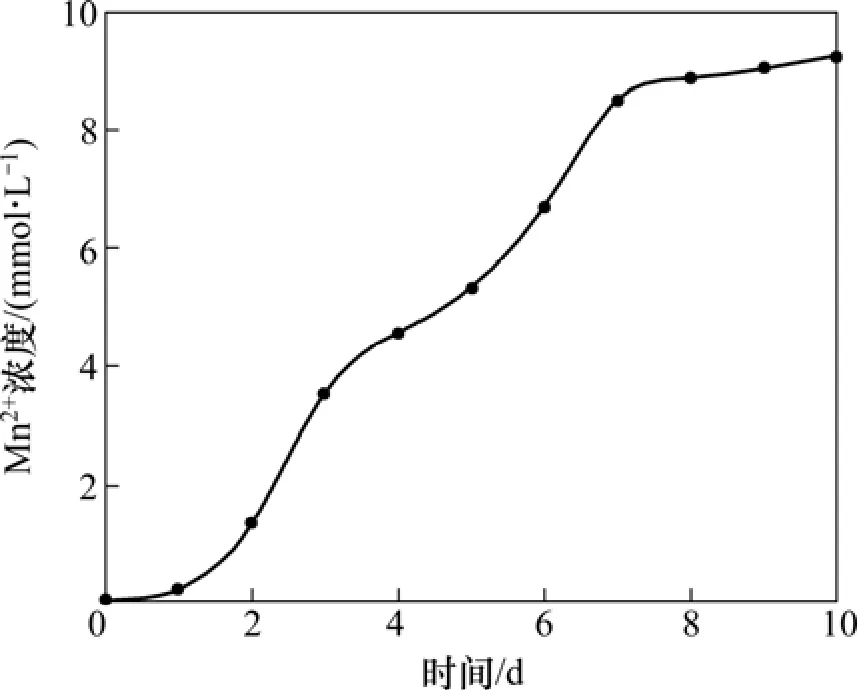
图3 菌种驯化阶段菌液中Mn2+浓度与时间的关系Fig.3 Relationship between concentration of Mn2+ and time during domestication
2.2 锰尾矿用量的影响
菌种已经可以适应尾矿,将其应用于实际废水的处理,以废水中有机物作为电子供体,以 COD浓度表征有机物含量。实验条件为:反应温度30 ℃,振荡速度170 r/min,接种量10%,pH=7.0,尾矿加入量分别为0.5,1.0,2.0和5.0 g/L,反应过程中不同投矿量条件下废水COD与时间的关系见图4。
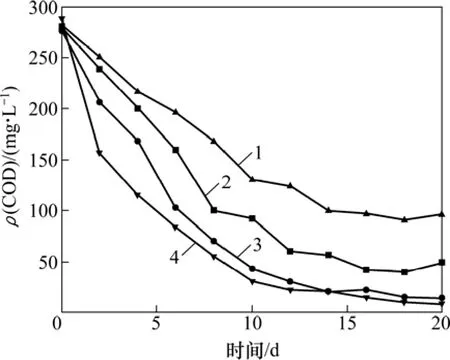
图4 不同尾矿用量下废水COD浓度与时间的关系Fig.4 Relationship between COD concentration and time at different tailings dosages
由图4可知:对于不同尾矿用量的废水处理,随着时间的延长COD均呈下降趋势,开始时COD下降迅速,因为尾矿粒径小,具有一定的吸附作用,而吸附发生的速度快,在 20 h左右吸附达到饱和,之后COD逐渐下降主要是微生物的异化还原作用。当锰尾矿用量为0.5 g/L时,处理效果明显低于其他用量,因为MnO2作为反应物直接参与氧化还原反应,当其用量不足时,由于缺少电子受体,氧化还原反应不能继续进行,造成处理效果较差。锰尾矿用量为2.0 g/L和5.0 g/L时,在反应的20 d时间内,COD始终呈下降趋势,说明Mn4+含量足够维持反应进行,随着氧化还原反应的进行,有机物被微生物同化,因此 COD逐渐降低。然而锰尾矿投加量2.0 g/L和5.0 g/L的两组在反应后期的处理效果比较相近,可能是因为制药废水成分复杂,含有多种微生物无法降解的有机物,当反应达到平衡后,出水 COD即为不可降解有机物的浓度。由于两者处理效果相差较小,反应中取最佳锰尾矿用量为2.0 g/L。
2.3 pH的影响
反应温度30 ℃,振荡速度170 r/min,接种量10%,锰尾矿用量为2.0 g/L,调pH分别为3,5,7和9,反应过程中废水COD与时间的关系见图5。
由图 5可知:pH对处理效果的影响并不十分显著,溶液呈酸性时处理效果不如碱性时好,pH在中性和碱性条件下,处理效果相近,考虑到进水 pH为 7左右,所以处理时可以不用调节pH。
环境pH变化时,微生物细胞膜等结构性质会发生变化,因而对其生长及代谢造成影响,同时细胞内酶的活性也受到影响,从而对微生物的活性造成影响。另一方面,Mn2+在不同pH溶液中的存在形式不同,Mn2+在酸性条件下可以溶解在溶液中,测定COD时,水样中Mn2+具有还原性,使COD测量值偏高。当溶液 pH达到中性至碱性时,Mn2+以 MnCO3等固态形式沉积在尾矿中,不会对水样造成二次污染。
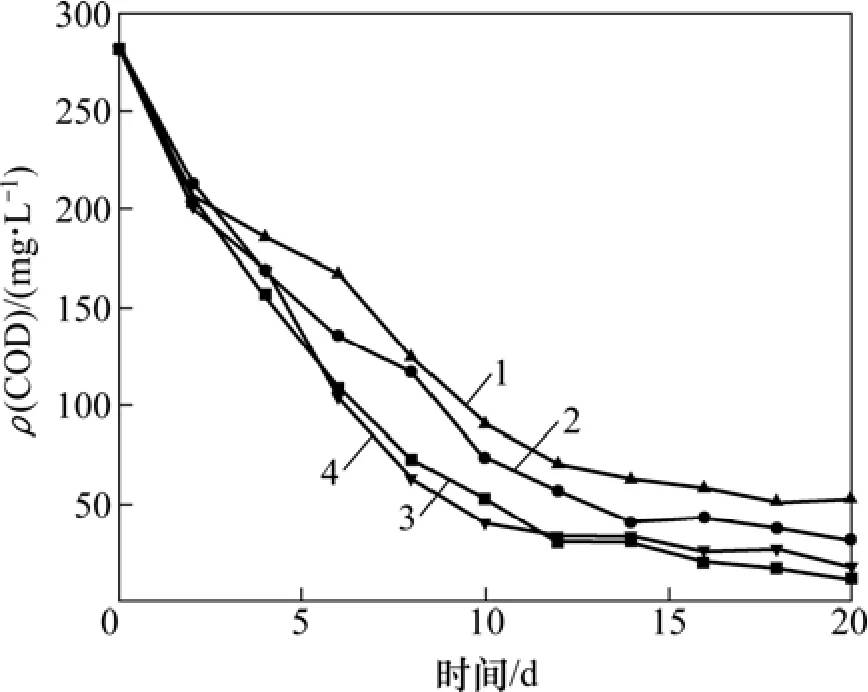
图5 不同pH下废水COD浓度与时间的关系Fig. 5 Relationship between COD concentration and time under different pH
2.4 温度的影响
振荡速度170 r/min,接种量10%,锰尾矿用量为2.0 g/L,pH为7,反应温度分别为25,30,35和40 ℃,反应过程中COD与时间关系见图6。
由图6可知:在反应温度为25 ℃和40 ℃时,处理效果明显下降,而30 ℃时处理效果最好,所以最适宜温度取30 ℃。与pH对处理效果的影响原因相似,温度对微生物的活性有所影响,因为菌种分离自活性污泥,中温厌氧消化反应温度范围是30~38 ℃,所以菌种在此温度范围内活性最高,反应速率最快,过高或过低的温度,都会使菌体的活性下降,从而导致处理效果降低。
总结上述单因素实验结果,得到反应最佳反应条件为:反应温度30 ℃,振荡速度170 r/min,接种量10%,锰尾矿用量2.0 g/L,pH=7。由图6中30 ℃的数据可以看出:COD随时间延长先迅速减小,后趋于平衡,反应进行到第10天,COD去除率为84.7%,出水COD可由进水的282.6 mg/L降至43.2 mg/L,已达到化学合成类制药工业水污染物排放标准(GB 21904—2008)中特别排放限值的相关标准(ρ(COD)<50 mg/L),同时结合处理效果和运行成本等情况,反应时间取10 d。
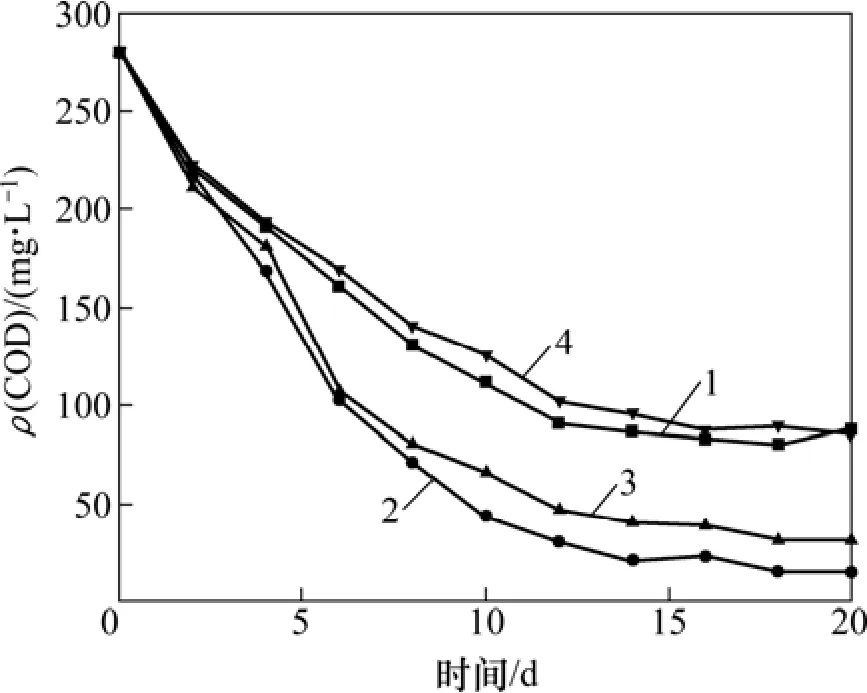
图6 不同温度下废水COD浓度与时间的关系Fig. 6 Relationship between COD concentration and time at different temperatures
2.5 反应机理初探
在最佳反应条件下,进行接菌对照实验,每隔一定时间取样测定出水 COD(见图7),讨论异化金属还原菌在废水处理中的作用。

图7 接菌和不接菌对照实验结果Fig. 7 Comparison of experimental results with or without inoculation
由图7可以看出:在反应开始的1 d内,两组实验中 COD的下降量基本相同,表明此时异化金属还原菌还未起作用,处理废水的主要作用是锰尾矿的吸附作用。第1天之后接菌组的COD开始迅速下降,至10 d以后基本达到平衡,而不接菌组的COD下降十分有限,在5 d左右甚至有回升的现象,至10 d以后才又缓慢下降。因此可知:从第2天开始,异化金属还原菌开始起作用,利用废水中有机物为底物进行反应,而不接菌对照组只存在吸附作用,物理吸附速率快,在1 d左右的时间达到饱和,后又发生脱附现象导致COD升高。
对异化金属还原菌处理废水的机理进行研究,在最佳反应条件下,定期测定溶液中Mn2+含量和固体中Mn2+含量,检测结果见图8。
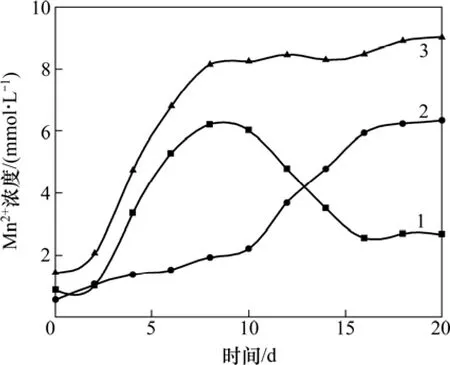
图8 反应中Mn2+浓度变化Fig. 8 Changes of concentration of Mn2+ in reaction process
由图8可知:反应过程中总Mn2+的浓度先逐渐增加,后期趋于平衡,通过计算锰尾矿中MnO2的转化率可达95%以上。在厌氧条件下,微生物通过呼吸作用,将电子由有机物传递到锰尾矿,Mn4+得到电子被还原成Mn2+,有机物被微生物利用合成自身所需的能量,同时产生有机酸、CO2和水等[15]。溶液中 Mn2+含量在前6 d呈上升趋势,后又逐渐下降,固体中Mn2+浓度逐渐上升,这是因为溶液中Mn2+与CO32−结合生成 MnCO3,MnCO3在水中的溶解度很小,但溶于有机酸,因此反应前几天溶液中Mn2+浓度增加,随着反应的进行,有机酸进一步被微生物降解,生成的MnCO3逐渐沉积吸附在锰尾矿固体表面,造成溶液Mn2+浓度降低和固体Mn2+浓度升高。
微生物还原过程使锰尾矿的结构发生改变,反应前后锰尾矿粉末的扫描电镜见图9。由图9可知:反应前锰尾矿为粉末状,矿物粒径小,反应后矿物明显粒径增加,呈颗粒状,使其比表面积减小,提高了表面电子交换的能力[16],生成的颗粒物相比粉末状态更容易从废水中沉淀分离。反应中起主导作用的是吸附生长在颗粒表面的微生物,这些细胞通过自身分泌的多糖类高分子物质互相连接,形成致密的生物膜[17],从而加速反应的进行。

图9 反应前后锰尾矿扫描电镜图Fig.9 SEM images of manganese tailings before and after reaction
3 结论
(1) 从厌氧活性污泥中分离出异化金属还原菌,经过8 d的培养,Fe(OH)3被还原并生成Fe3O4,经过驯化后菌种已可以利用锰尾矿处理制药废水;
(2) 利用异化金属还原菌处理制药废水,最佳反应条件为反应pH=7,锰尾矿用量2.0 g/L,接种量10%,反应温度30 ℃,振荡速度170 r/min,经过10 d的反应,COD可由进水的282.6 mg/L降为43.2 mg/L,可达到GB21904—2008的相关标准;
(3) 异化金属还原菌利用锰尾矿处理制药废水的过程分为两个阶段,反应初期主要是锰矿的吸附作用,后期为异化金属还原菌参与的异化还原反应。
(4) 利用异化金属还原菌还原锰尾矿的同时处理制药废水,反应条件为厌氧,操作简单,易于管理,并可达到以废治废的目的,是一种新型的环境友好的废水处理方式。
[1] Lovley D R, Holmes D E, Nevin K P. Dissimilatory Fe(III) and Mn(IV) reduction[J]. Advances in Microbial Physiology, 2004,49: 219−286.
[2] Fredrickson J K, Gorby Y A. Environmental processes mediated by iron-reducing bacteria[J]. Current Opinion in Biotechnology,1996, 7(3): 287−294.
[3] Nickel M, Vandieken V, Bruchert V, et al. Microbial Mn(IV)and Fe(II) reduction in northern Barents Sea sediments under different conditions of ice cover and organic carbon deposition[J]. Deep-Sea Research Part II: Topical Studies in Oceanography, 2008, 55(20/21): 2390−2398.
[4] HE Jiang-zhou,QU Dong. Dissimilatory Fe(III) reduction characteristics of paddy soil extract cultures treated with glucose or fatty acids[J]. Journal of Environmental Sciences, 2008, 20(9):1103−1108.
[5] 刘志丹, 连静, 杜竹伟, 等. 利用异化金属还原菌构建含糖微生物燃料电池[J]. 生物工程学报, 2006, 22(1): 131−137.LIU Zhi-dan, LIAN Jing, DU Zhu-wei, et al. Construction of sugar-based microbial fuel cells by dissimilatory metal reduction bacteria[J]. Chinese Journal of Biotechnology, 2006, 22(1):131−137.
[6] WU Ling-ling, Beard B L, Roden E E, et al. Influence of pH and dissolved Si on Fe isotope fractionation during dissimilatory microbial reduction of hematite[J]. Geochimica et Cosmochimica Acta, 2009, 73(19): 5584−5599.
[7] GUO Min-rong, LIN Yu-man, XU Xu-ping, et al. Bioleaching of iron from kaolin using Fe(III)-reducing bacteria with various carbon nitrogen sources[J]. Applied Clay Science, 2010, 48(3):379−383.
[8] 任南琪, 马放, 王爱杰. 污染控制微生物学[M]. 哈尔滨: 哈尔滨工业大学出版社, 2002: 386−387.REN Nan-qi, MA Fang, WANG Ai-jie. Microbiology of environmental engineering[M]. Harbin: Harbin Institute of Technology Press, 2002: 386−387.
[9] 刘丽红, 谢桂琴, 王晓萍. 异化金属还原菌及其应用[J]. 哈尔滨师范大学自然科学学报, 2008, 24(3): 81−84.LIU Li-hong, XIE Gui-qin, WANG Xiao-ping. Dissimilatory metal reduction bacteria and its application[J]. Natural Sciences Journal of Harbin Normal University, 2008, 24(3): 81−84.
[10] Kazumi J, Haggblom M M, Young L Y. Degradation of mono-chlorinated aromatic compounds under iron reducing conditions[J]. Appl Environ Microbio., 1995, 61: 4069−4073.
[11] 许玫英, 林培真, 孔祥义, 等. 中国希瓦氏菌D14T的Fe(II)还原特性及其影响因素[J]. 微生物学报, 2005, 45(3): 463−457.XU Mei-ying, LIN Pei-zhen, KONG Xiang-yi, et al.Characterization and influence factors of Fe(II) reduction of Shewanella cinica D14T[J]. Acta Microbiologica Sinica, 2005,45(3): 463−457.
[12] FENG Ya-li, ZHOU Liang, ZHU Xue-yuan, et al. Three paths to reduce ferric oxides taken by Geobacter metallireducens[J].Journal of University of Science and Technology Beijing, 2006,28(6): 524−529.
[13] Finneran K T, Johnsen C V, Lovley D R. Rhodoferax ferrireducens sp. Nov., a psychrotolerant, facultatively anaerobic bacterium that oxidizes acetate with the reduction of Fe(III)[J].International Journal of Systematic and Evolutionary Microbiology, 2003, 53(3): 669−673.
[14] 孔祥义, 许玫英, 陈绵才, 等. 脱色希瓦氏菌S12的铁还原性能研究[J]. 微生物学通报, 2006, 33(3): 98−103.KONG Xiang-yi, XU Mei-ying, CHEN Mian-cai, et al.Investigation of the Fe3+reduction properties of Shewanella decolorationis S12[J]. Microbiology China, 2006, 33(3):98−103.
[15] WANG Xun, LI Ya-dong. Hydrothermal reduction route to Mn(OH)2and MnCO3nanocrytals[J]. Materials Chemistry and Physics, 2003, 82: 419−422.
[16] Kostka J E, WU Jun, Nealson K H, et al. The impact of structural Fe(III) reduction by bacteria on the surface chemistry of smectite clay minerals[J]. Geochimica et Cosmochimica Acta,1999, 63(22): 3705−3713.
[17] 李浩然, 冯雅丽, 周良, 等. 微生物异化还原金属氧化物的机理及应用[J]. 中国矿业大学学报, 2007, 36(5): 680−683.LI Hao-ran, FENG Ya-li, ZHOU Liang, et al. Mechanism and application of microbial dissimilatory reduction metal oxide[J].Journal of China University of Mining & Technology, 2007,36(5): 680−683.

