干细胞因子及受体c-kit对A375细胞增殖和凋亡影响的体外研究
吴冬梅,岑 瑛
干细胞因子及受体c-kit对A375细胞增殖和凋亡影响的体外研究
吴冬梅,岑 瑛

目的 利用基因工程方法建立稳定表达干细胞因子受体(SCF/c-kit)的恶性黑素瘤A375细胞株,再给予外源性SCF/c-kit,观察其对A375细胞增殖、凋亡的影响。方法 通过脂质体转染技术构建稳定表达c-kit的黑素瘤细胞株(hc-kit/A375),给予A375细胞和hc-kit/A375细胞外源性SCF,将所有的细胞分为A375组、A375-SCF组、hc-kit/A375组和hc-kit/A375-SCF组。应用MTT法及流式细胞仪分析细胞的增殖和凋亡,并应用酶联免疫吸附法(ELISA)和免疫组化方法检测肿瘤细胞血管内皮生长因子(VEGF),基质金属蛋白酶(MMP)-9及肿瘤坏死因子(TNF)-α的表达。结果 ①通过脂质体介导能将c-kit-pcDNA3.1 neo重组质粒成功转染入黑素瘤细胞,建立稳定表达c-kit的黑素瘤细胞株hckit/A375,hc-kit/A375细胞中c-kit表达明显增加。②给予外源性SCF后,细胞的生长受到抑制,以培养后第5天尤为显著;细胞的凋亡率明显增加,S期比例降低,且hc-kit/A375-SCF组尤明显。③转染后细胞及加入SCF干预组VEGF、MMP-9分泌减少,而TNF-α的分泌增加。结论 通过脂质体转染和G418筛选成功构建稳定表达c-kit的A375细胞株;通过增加A375细胞中SCF/c-kit的表达能改变肿瘤细胞对VEGF、MMP-9、TNF-α的分泌,抑制肿瘤细胞的增殖,促进其凋亡。
黑素瘤,转移性;干细胞因子;受体,干细胞因子;稳定转染;A375细胞
[J Pract Dermatol, 2012, 5(4):193-198]
近年来,许多研究发现黑素瘤的发生、发展及转移与多种分子相关,如p53,bcl-2,Fas/Fasl,血管内皮生长因子(VEGF),基质金属蛋白酶(MMP)-9,干细胞因子受体/c-kit(SCF/c-kit)等。干细胞因子(stem cell factor,SCF)、肥大细胞生长因子 (mast cell growth factor,MGF)等,是1990年以来发现的一种重要的造血生长因子,主要由骨髓基质细胞 (包括脂肪细胞、成纤维细胞和内皮细胞)产生[1-3]。SCF通过与其受体的相互作用发挥其生物学活性。干细胞因子受体即c-kit,属于3型受体酪氨酸激酶亚家族,c-kit蛋白相对分子质量为 145 000,又称CD117。SCF/c-kit信号通路在黑素瘤中起着重要作用,SCF通过与其配体c-kit的相互作用,对黑素细胞的存活、分化、增殖和移行等方面起调节作用。
本研究利用基因工程的方法建立稳定表达c-kit的恶性黑素瘤细胞A375细胞株,然后给予外源性SCF,观察其对肿瘤细胞生物活性的影响,从而为恶性黑素瘤的临床治疗提供一个新的思路。
1 材料和方法
1.1 材料
人黑素瘤细胞系细胞A375,由四川大学华西医院移植免疫实验室提供。A375细胞低表达c-kit;重组质粒c-kit-WT pcDAN3.1 neo(ATCC公司,美国);脂质体lipofectine2000(Invitrogen公司,美国)。
1.2 方法
1.2.1 细胞系及其培养 人黑素瘤细胞系细胞A375在含10%(体积分数)小牛血清的RPMI 1640培养基于体积分数为5%的CO2、37 ℃条件下培养。
1.2.2 c-kit质粒的提取及构建稳定表达c-kit的A375细胞株 将重组质粒c-kit-WT pcDAN3.1 neo进行扩增,提取质粒,用XhoⅠ及Bam H1限制性内切酶进行酶切鉴定后,用lipofectine2000脂质体转染方法将c-kit转染A375细胞,并通过G418进行抗性筛选阳性克隆。采用有限稀释法获得稳定表达c-kit的A375细胞,并通过RT-PCR和流式细胞仪检测转染后A375细胞中c-kit的表达。
1.2.3 细胞分组 本实验将细胞分为4组:A375组(A组)为标准A375细胞;A375-SCF组(AS组)为标准A375细胞+10 ng/ml SCF;hc-kit/A375组(H组)为稳定转染hc-kit的A375细胞;hc-kit/A375-SCF组(HS组)为稳定转染hc-kit的A375细胞 + 10 ng/ml SCF。
1.2.4 细胞增殖、凋亡的分析 将A375细胞和hckit/A375细胞接种于24孔板,每孔5×103个细胞,37 ℃、5%CO2孵箱中培养4 h,待细胞贴壁、伸展;按上述分组,AS组和HS组中每孔加入10 ng/ml的rhSCF;此后8 d连续用MTT法测定各组细胞的增殖情况,于酶标比色计492 nm波长处测量吸光度值(A值)。每组3个复孔,取平均值,并绘制每组细胞的生长曲线。
取细胞汇合度达90%以上,拟传代的A375细胞和hc-kit/A375细胞,按前述分组接种于50 ml培养瓶中,AS组和HS组中加入10 ng/ml的rhSCF,37 ℃、5%CO2孵箱培养3 d,制成细胞悬液,用Annexin V/FITC双染色法检测细胞的凋亡率。
将处于对数生长期的A375细胞和hc-kit/A375细胞以相同的细胞浓度(5×104个/ml)分别接种于6孔板中,每种细胞均接种6孔,其中3孔加入10 ng/ ml的SCF,在37 ℃、5%CO2培养箱中培养72 h后收集细胞,PI染色,用流式细胞仪对细胞周期进行分析。
1.2.5 ELISA检测细胞中VEGF、MMP-9及肿瘤坏死因子(TNF)-α的水平 按分组分别收集各组细胞的培养上清,置于15 ml离心管中,1 000 r/min离心4 min,取上清液,分装于EP管中,20 ℃保存。用VEGF、MMP-9及TNF-α ELISA试剂盒测定各组细胞的VEGF、MMP-9及TNF-α的水平。
1.3 统计学方法
采用SPSS13.0统计软件进行统计学分析,数据结果用均数±标准差(x¯ ±s)表示,所有实验组间差异用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 构建稳定表达c-kit的黑素瘤细胞株hc-kit/A375
采用c-kit-WT pcDNA3.1 neo重组质粒转染A375细胞后,用G418进行筛选获得野生型人c-kit受体的细胞株hc-kit/A375细胞。提取hc-kit/A375细胞总RNA,进行逆转录反应,以反应产物为模板,P1、P2为上下游引物进行RT-PCR,扩增出hc-kit cDNA第700~1 302 bp片段,而未转染的A375细胞则没有扩增出相应大小的片段,证明在 RNA水平检测到外源性hc-kit受体的转录(图1)。
用流式细胞仪分析hc-kit/A375细胞表面hc-kit受体的表达情况,结果hc-kit/A375细胞表面hc-kit受体分布明显多于未转染细胞,A组c-kit的表达为0.526±0.288,H组c-kit的表达为1.70±0.541(P<0.05)(图2),提示转染后得到的细胞株表面c-kit受体的表达明显增强,说明c-kit被成功转染入A375细胞。
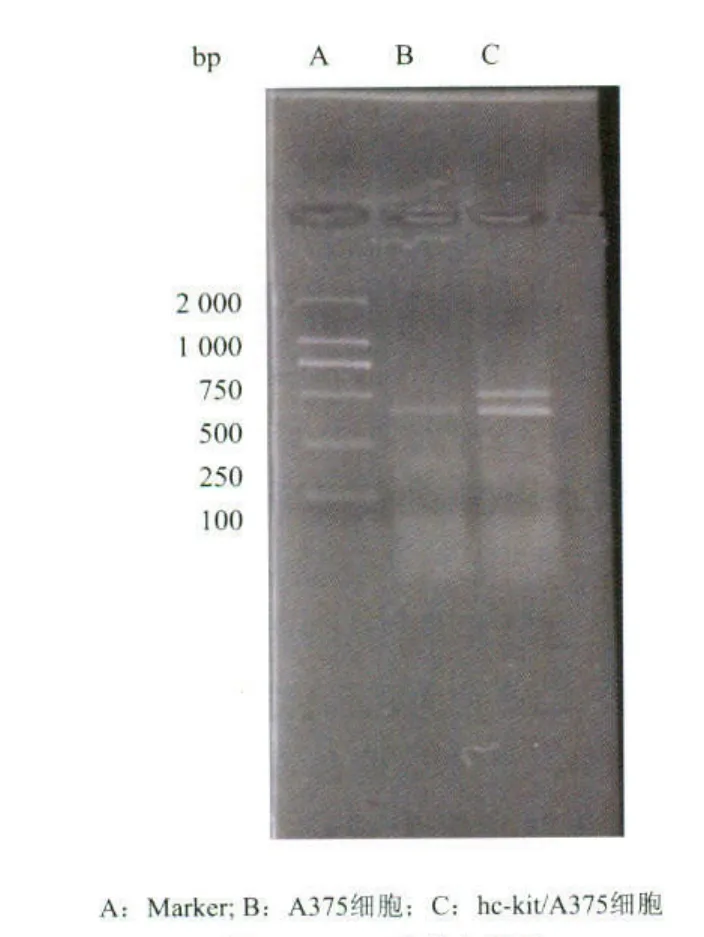
图1 RT-PCR产物电泳图
2.2 各组细胞的增殖曲线
采用MTT法检测转染前后及rhSCF干预前后8 d细胞的增殖情况(图3)。生长曲线显示转染后细胞(hc-kit/A375)的增殖能力明显低于未转染细胞(A375)。加入10 ng/ml的rhSCF后转染前及转染后A375细胞的增殖能力明显低于无干预组,且转染后细胞(hc-kit/A375)的增殖能力明显低于其他各组细胞。生长至第5天时,H组、HS组、AS组与对照A组间的差异均有统计学意义(P均<0.05)。其中HS组细胞的增殖能力减弱最明显,与其他各组相比较差异均有统计学意义(P<0.05)。这说明通过转染增加黑素瘤细胞中c-kit的表达能有效抑制肿瘤细胞的增殖,而加入外源性的SCF后该作用明显增强。
2.3 细胞凋亡的检测
各组细胞在相同的培养条件下培养3 d后,用Annexin/PI双染色法检测细胞的凋亡情况,结果显示,转染后hc-kit/A375细胞的凋亡率为2.7%,明显高于未转染组A375细胞(0.9%)。加入10 ng/ml的rhSCF后转染前及转染后A375细胞的凋亡率(分别为1.6%,8.5%)明显高于A组(0.9%),且转染后细胞(hc-kit/A375)的凋亡率为8.5%,明显高于其他各组细胞(图4)。这说明通过转染增加黑素瘤细胞中c-kit的表达,能有效促进肿瘤细胞的凋亡; 而加入外源性的SCF后该作用明显增强。

图2 流式细胞仪分析A375细胞及hc-ki t/A375细胞表面c-ki t表达水平
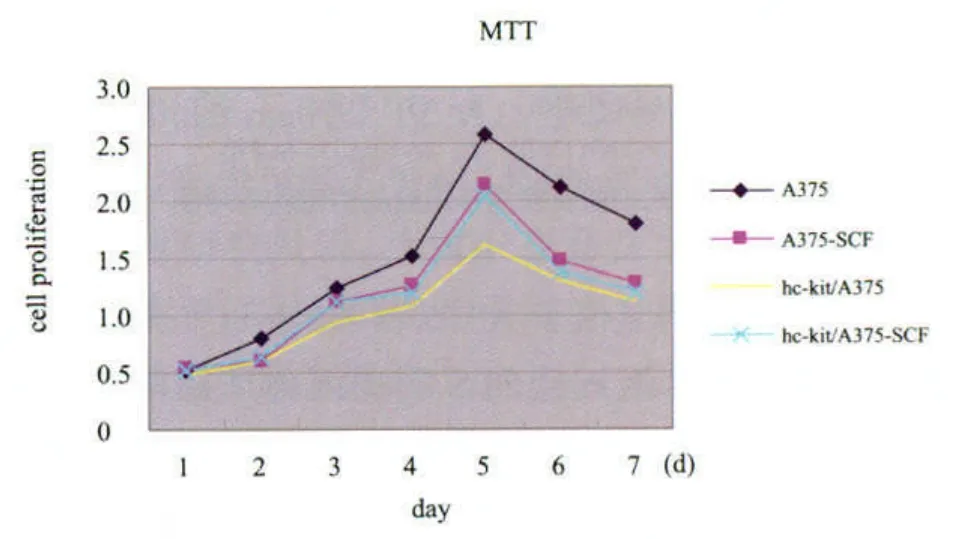
图3 M TT法检测各组细胞生长曲线
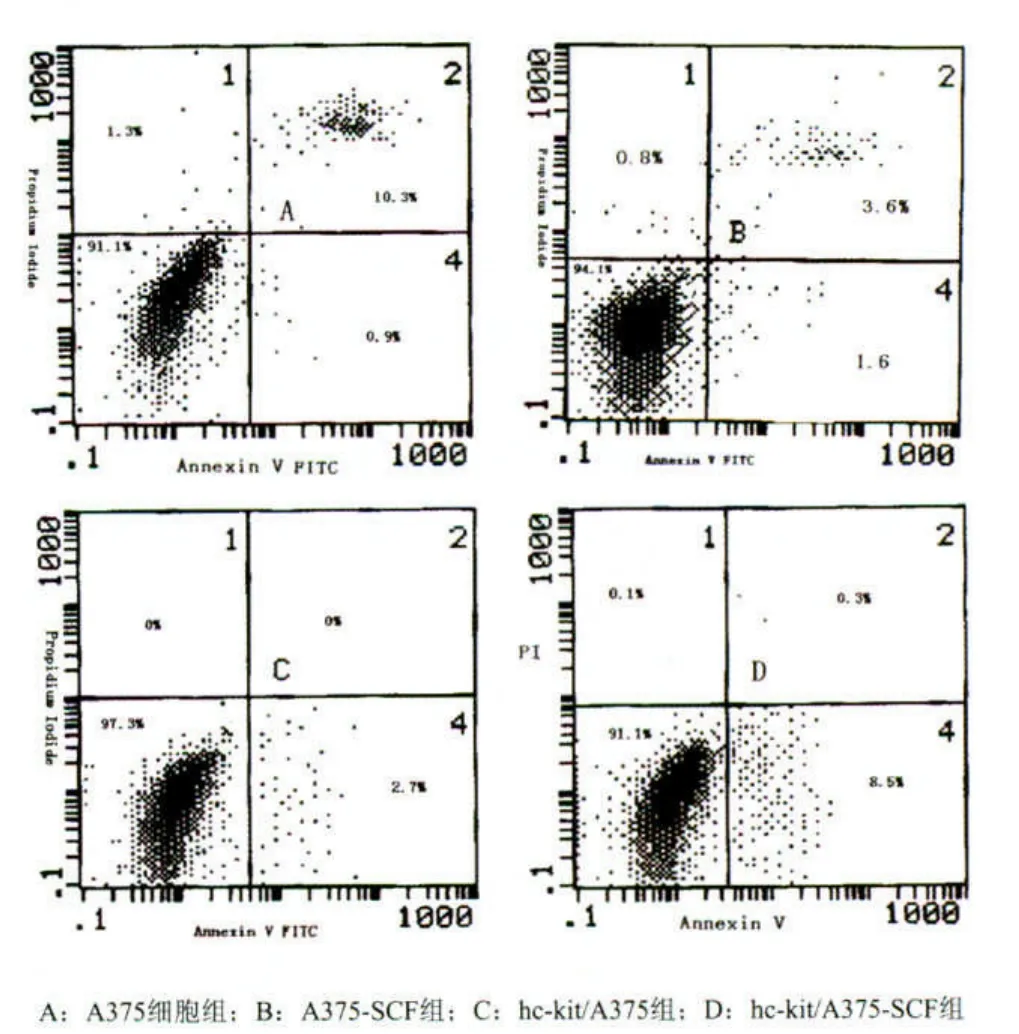
图4 流式细胞仪检测各组细胞的凋亡情况
2.4 细胞周期的检测
流式细胞仪对细胞周期的检测结果见图5。各细胞S期在细胞周期中所占比例依次为:A375(41.5%)>A375-SCF(39.3%)> hc-kit/A375(32.2%)>hc-kit/ A375-SCF(30.6%)。hc-kit/A375细胞的S期在细胞周期中所占比例明显低于A375和A375-SCF细胞,而hc-kit/A375-SCF组细胞的S期在细胞周期中所占比例最低,提示hc-kit/A375和hc-kit/A375-SCF组细胞的增殖活跃程度受到明显抑制。
2.5 细胞VEGF、MMP-9及TNF-α的表达
未转染的A375细胞培养上清液中可以检测到大量VEGF和MMP-9的表达,分别为(698.75± 45.01) pg/ml和(12.75±1.71) ng/ml。而在转染后的hckit/A375细胞培养上清液中VEGF和MMP-9的表达明显降低,分别为(174.37±39.69) pg/ml和(7.75±2.63) ng/ml。加入rhSCF进行干预后,两者的表达均有明显降低,各组间比较,P均<0.05,差异有统计学意义。
未转染细胞的A375培养上清液中仅检出极少量的TNF-α表达,在稳定转染c-kit的A375细胞培养上清液中检测出少量TNF-α。加入外源性rhSCF进行培养后,TNF-α的表达明显增加(表1)。
3 讨论
3.1 构建稳定表达c-kit的A375细胞株
本实验使用Invitrogen公司生产的lipofectine 2000介导c-kit-WT pcDNA3.1 neo重组质粒转入体外培养的A375细胞,虽然在本实验中未对转染率进行直接检测,但通过G418抗性筛选14 d后,我们获得了多株阳性克隆,这间接说明通过该阳性脂质体介导取得了良好的转染效果。而RT-PCR和流式细胞仪检测发现转染后A375细胞中c-kit表达增加,更加证实了这一点。G418是一种氨基糖苷类抗生素,其结构与新霉素、庆大霉素、卡那霉素相似,在分子遗传试验中,是稳定转染最常用的抗性筛选试剂。
研究表明,c-kit在黑素细胞的增殖和分化中起着重要的调节作用,且随着黑素瘤的生长和转移,c-kit的表达逐渐减弱甚至缺失[4-6]。这一事实在体外培养的各类黑素瘤细胞中也得到了证实,大多数的人黑素瘤细胞株均不表达c-kit。本实验中选用的黑素瘤细胞A375具有较强的增殖和转移能力,且在体外培养条件下无c-kit的表达。而本实验通过流式细胞仪分析发现, A375 细胞中也有少量c-kit表达,这与国外学者的研究结果不同[6]。但本实验A375细胞中c-kit的浓度很低,这与我们研究所需的高表达c-kit的肿瘤细胞仍有本质的区别,因此并不影响本研究结果。
目前,关于SCF/c-kit对转移性黑素瘤的作用研究主要是通过瞬时转染的方法进行的。瞬时转染获得的细胞只能在数天内进行研究,无法对c-kit的长期作用进行研究。而我们成功构建了稳定表达c-kit的A375细胞,并在后续的研究中证明该细胞传10代后和反复冻融仍有明显的c-kit表达。这在目前关于SCF/c-kit对黑素瘤的研究中罕见报道,也为我们建立研究rhSCF/c-kit信号转导途径在黑素瘤的发生和发展中作用的细胞模型提供了可行性依据。
3.2 SCF/c-kit对黑素瘤细胞增殖的影响
c-kit在正常黑素细胞及良性黑痣中的表达呈强阳性;而在转移性黑素瘤的细胞中常常缺乏c-kit的表达,且c-kit的表达与肿瘤之间呈负相关[4-6]。本实验中所选用的黑素瘤细胞A375属于恶性程度较高的黑素瘤细胞,在体外实验证实仅有少量的c-kit表达,这与其恶性程度相一致。而本实验中所构建的稳定表达c-kit的A375细胞株,c-kit的表达明显增加,且该细胞的的生物学性质发生改变,主要表现在:①生长曲线:我们发现hc-kit/ A375细胞的增殖较未转染组细胞A375受到抑制,且在细胞生长至第5 d时,其抑制作用达到顶点。而给予外源性的SCF后细胞的增殖同样受到抑制,且当SCF与c-kit均增加时,对细胞增殖的抑制作用尤为明显。②细胞周期:hc-kit/A375细胞的DNA合成期(S期)在细胞周期中所占比例明显低于A375和A375-SCF细胞的S期,而hc-kit/A375-SCF组细胞的S期在细胞周期中所占的比例最低,而DNA合成期所占比例反映了细胞的增殖强弱。因此本研究结果提示hc-kit/A375和hc-kit/A375-SCF组细胞的增殖明显弱于A375细胞。由此可见,单独的SCF或c-kit均能抑制黑素瘤细胞的增殖,这与国外学者的研究结果一致。本研究对SCF,c-kit单独作用及两者共同作用下黑素瘤细胞A375 的增殖进行了研究和对比,使SCF及c-kit对肿瘤细胞的作用有更全面的认识。实验发现在两者共同作用下,能更有效地抑制细胞的增殖。
表1 各组细胞VEGF、M M P-9和TN F-α的表达比较 (±s)
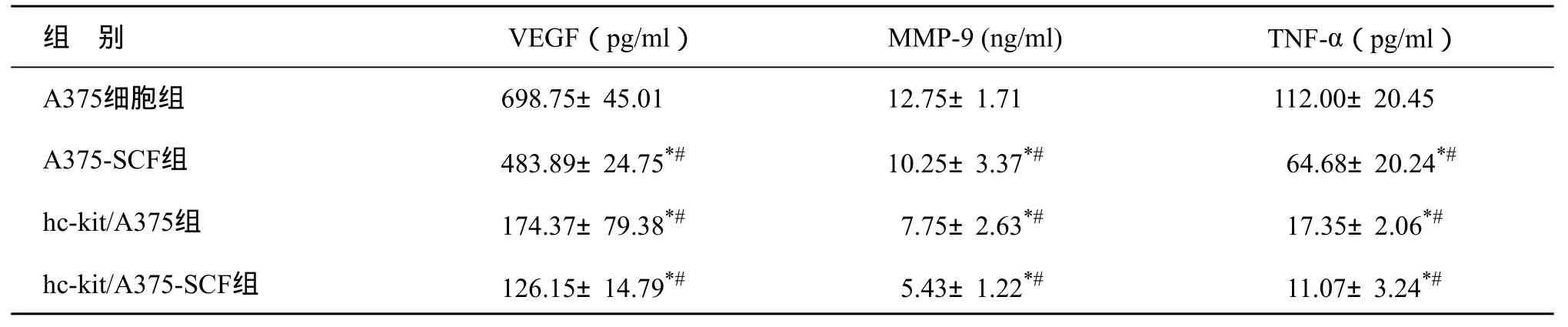
表1 各组细胞VEGF、M M P-9和TN F-α的表达比较 (±s)
注:与A375细胞组比较,*P<0.05;组间比较,#P<0.05
组 别 VEGF(pg/ml)MMP-9 (ng/ml) TNF-α(pg/ml)A375细胞组698.75±45.0112.75±1.71112.00±20.45 A375-SCF组483.89±24.75*#10.25±3.37*#64.68±20.24*#hc-kit/A375组 174.37±79.38*#7.75±2.63*#17.35±2.06*#hc-kit/A375-SCF组126.15±14.79*#5.43±1.22*#11.07±3.24*#
SCF/c-kit抑制细胞增殖的作用机制尚不清楚,可能与下列因素有关:①SCF可通过调节蛋白激酶C(PKC)的活性诱导细胞凋亡,从而抑制c-kit表达阳性的黑素瘤细胞增殖。②SCF/c-kit信号可能负责控制黑素瘤细胞黏连分子(MCAM) 的合成。MCAM 在黑素瘤细胞表达上调通常伴有肿瘤细胞增殖加速和转移。细胞丢失 c-kit受体后,MCAM便得以表达,进而使黑素瘤发生恶变、增生[7]。③SCF通过下调与黑素瘤生长有关的细胞因子的表达,如IL-7、IL-8、IL-10、GM-CSF及TGF-β等,从而抑制黑素瘤的增生速度[8],这一点在本实验中也得到了证实。本实验结果提示SCF/c-kit可能通过抑制细胞的DNA合成抑制细胞的增殖。
3.3 SCF/c-kit对黑素瘤细胞凋亡的影响
细胞凋亡异常在大多数恶性肿瘤的发病学上具有重要地位[9]。大量研究表明恶性黑素瘤与其他恶性肿瘤相比,其肿瘤细胞的自发凋亡水平较低,提示其凋亡不足与其侵袭、转移及治疗耐受性相关[10]。在本实验中,增加A375细胞c-kit的表达后,细胞的凋亡率明显增加。在SCF与c-kit的共同作用下,能更有效地促进细胞的凋亡,这与国外学者的研究结果一致[11]。
细胞凋亡功能的失调在影响黑素瘤的生物学行为上起重要作用。而大多数凋亡信号途径依赖于TNF-α。TNF-α是由炎性细胞分泌的细胞因子,通过与细胞膜表面TNF-α受体结合,激活细胞内信号传导系统,引起多种正常细胞及肿瘤细胞的凋亡[12,13]。在本实验中,在c-kit及SCF的作用下, A375细胞分泌的TNF-α增加,这可能是SCF/c-kit促进黑素瘤细胞凋亡的机制之一。
3.4 SCF/c-kit对黑素瘤细胞VEGF和MMP-9表达的影响
肿瘤的发生、发展是一个多阶段、多因素参与调控的漫长过程,在这过程中恶性肿瘤必须依靠机体的血液供应进行生长,同时通过降解细胞外基质(extracellular matrix,ECM)引起转移及浸润性生长。在这个过程中VEGF[14]和MMPs起着重要作用[15]。
大量研究发现,VEGF在恶性黑素瘤中的表达随着肿瘤恶性程度的增加而增加,且在肿瘤的生长、转移和浸润中起重要的作用[16,17]。在肿瘤浸润、转移的过程中,ECM是癌细胞脱落游走的主要障碍。恶性肿瘤的浸润很大程度上依赖于肿瘤细胞外周基质成分的降解,研究表明 MMPs在这一过程中起关键作用。MMPs是一组具有高度同源性的能降解基膜等基质成分的水解酶,MMPs在很多恶性肿瘤中均有较高水平的表达,发挥降解细胞外基质等作用,并与许多肿瘤细胞的浸润呈正相关。其中,MMP-9因能降解基膜和多种细胞外基质成分而倍受关注。同样MMP-9在恶性黑素瘤中的表达与肿瘤的转移性侵袭成正相关。
目前关于SCF/c-kit对转移性黑素瘤的生长、转移抑制作用机制的研究尚不多,有研究证实SCF/c-kit可能通过抑制MCAM抑制黑素瘤转移[7]。但肿瘤的转移和多种因素有关,其中肿瘤细胞通过自分泌或旁分泌的形式分泌细胞因子起着重要的作用。本研究显示,黑素瘤细胞A375中VEGF和MMP-9的表达明显高于稳定表达c-kit的A375细胞,同时在SCF干预后,两者的表达均明显降低。这一结果提示SCF/ c-kit可能通过下调肿瘤细胞VEGF和MMP-9的表达,抑制黑素瘤的生长和转移。
[1] Martin FH, Suggs SV, Langley KE, et a1. Primary structure and functional expression of rat and human stem cell factor DNAs [J]. Cell, 1990, 63(1):203-211.
[2] Anderson DM, Lyman SD, Baird A, et a1. Molecular cloningof mast cell growth factor, a hematopoietin that is active in both membrane bound and soluble forms [J]. Cell, 1990, 63(1):235-243.
[3] Zsebo KM, Williams DA, Geissler EN, et a1. Stem cell factor is encoded at the Sl locus of the mouse and is the ligand for the c-kit tyrosine kinase receptor [J]. Cell, 1990, 63(1):213-224.
[4] Stefanou D, Batistatou A, Zioga A, et al. Immunohistochemical expression of vascular endothelial growth factor (VEGF) and C-KIT in cutaneous melanocytic lesions [J]. Int J Surg Pathol, 2004, 12(2):133-138.
[5] Potti A, Moazzam N, Langness E, et al. Immunohistochemical determination of HER-2/neu, c-Kit (CD117), and vascular endothelial growth factor (VEGF) overexpression in malignant melanoma [J]. J Cancer Res Clin Oncol, 2004, 130 (2):80-86.
[6] Guerriere-Kovach PM, Hunt EL, Patterson JW, et al. Primary melanoma of the skin and cutaneous melanomatous metastases: comparative histologic features and immunophenotypes [J]. Am J Clin Pathol, 2004, 122 (1):70-77.
[7] Karlen S, Braathen LR. Regulation of the melanoma cell adhesion molecule gene in melanoma: modulation of mRNA synthesis by cyclic adenosine monophosphate, phorbol ester, and stem cell fFactor/c-kKit signaling [J]. J Invest Dermatol, 1999, 113(5):711-719.
[8] Francesca P, Gianni G, Benedetta S, et al. Stem cell factor affects tumour progression markers in metastatic melanoma cells [J]. Clin Exp Metastasis, 2006, 23(3-4):177-186.
[9] Favrot M, Coll JL, Louis N, et al. Cell death and cancer: replacement of apoptotic genes and inactivation of death suppressor genes in therapy [J]. Gene Ther, 1998, 5(6):728-739.
[10] Soengas MS, Lowe SW. Apoptosis and melanoma chemoresistance [J]. Oncogene, 2003, 22(20):3138-3151.
[11] Huang S, Luca M, Gutman M, et al. Enforced c-KIT expression renders highly metastatic human melanoma cells susceptible to stem cell factor-induced apoptosis and inhibits their tumorigenic and metastatic potential [J]. Oncogene, 1996, 13(11):2339-2347.
[12] Chopra DP, Menard RE, Januszewski J, et al. TNF-alphamediated apoptosis in normal human prostate epithelial cells and tumor cell lines [J]. Cancer Lett, 2004, 203(2):145-154.
[13] Fukui T, Matsui K, Kato H, et al. Significance of apoptosis induced by tumor necrosis factor-alpha and/or interferon-gamma against human gastric cancer cell lines and the role of the p53 gene [J]. Surg Today, 2003, 33(11):847-853.
[14] Lee JC, Chow NH, Wang ST, et a1. Prognostic value of vascular endothelial growth factor expression in colorectal cancer patients [J]. Eur J Cancer, 2000, 36(6):748-753.
[15] 孔灵玲, 杨建文, 崔文. 基质金属蛋白酶及其肿瘤关系的研究进展 [J]. 济宁医学院学报, 2003, 26(1):64-66.
[16] Salven P, Heikkilä P, Joensuu H. Enhanced expression of vascular endothelial growth factor in metastatic melanoma [J]. Br J Cancer, 1997, 76(7):930-934.
[17] Claffey KP, Brown LF, del Aguila LF, et al.Expression of vascular permeability factor/vascular endothelial growth factor by melanoma cells increases tumor growth, angiogenesis, and experimental metastasis [J]. Cancer Res, 1996, 56(1):172-181.
The effect of SCF and its receptor c-kit on A375 cell proliferation and apoptosis in vivo
WU Dong-mei,CEN Ying
Sichuan Academy of Medical Sciences & Sichuan Provincial People’s Hospital, Chengdu 610031, China
ObjectiveTo establish malignant melanoma cells A375 which stably expressing the human stem cell factor receptor c-kit and observe the effect of exogenous SCF/c-kit on cell growth and apoptosis.MethodsBy liposomal transfection technology, cell line which stably expressing c-kit receptor(hc-kit/A375) was established. Then exogenous SCF was given to A375 cells and hc-kit/A375 cells, all the cells were divided into four groups: A375 group, A375-SCF group, hc-kit/A375 group and hc-kit/A375-SCF group, then the cell growth and apoptosis were observed by MTT method and fl ow cytometry. ELISA and immunohistochemistry staining were used to confi rm the effect of SCF/c-kit on expression of VEGF, MMP-9, TNF-α.ResultThe recombinant plasmid c-kit-pcDNA3.1 neo was successfully transfected into melanoma cells, and the cell line hc-kit/A375 which stably expressing c-kit was established. C-kit expression was signifi cantly increased in the cell line hc-kit/A375. After exogenous SCF was given, the cell growth was restrained, especially in the fifth day; cell apoptosis rate significantly increased; S phase ratio was reduced, and the hc-kit/A375-SCF group was especially apparent. ELISA analysis and immunohistochemitry staining of the cells confi rmed that SCF/c-kit can reduce the expression of VEGF and MMP-9 of A375 cell, contrarily the expression of TNF-a increased.ConclusionThrough the liposome transfection and G418 selection we successfully established A375 cells which stably expressing c-kit; increased expression of SCF/c-kit in A375 cell can depress the cell growth and enhance the cell apoptosis by increasing the expression of TNF-α and reducing the expression of VEGF, MMP-9.
Malignant melanoma,metastasis;Stem cell factor;Receptor c-kit;Stable transfection;Cell,A375
R393;R739.5
A
1674-1293(2012)04-0193-06
2012-05-05
2012-06-26)
(本文编辑 耿建丽)
610031 成都,四川省人民医院皮肤外科(吴冬梅);四川大学华西医院烧伤整形科(岑瑛)
吴冬梅,博士,主治医师,研究方向:皮肤肿瘤的诊断和基因治疗、瘢痕的综合治疗,E-mail: sunsearch@163.com
岑瑛,E-mail: 191376086@qq.com
- 实用皮肤病学杂志的其它文章
- 烟酸缺乏症一例
- 2012~2013年国内·国际会议消息

