猪毛菜液泡膜SsNHX1基因的克隆及功能验证
张春玉,宋 凯,高立宏,,郭立泉,李望丰,刘立侠
(1.长春职业技术学院食品与生物技术分院,吉林 长春 130033;2.东北师范大学生命科学学院,吉林 长春 130024;3.长春师范学院生命科学学院,吉林 长春 130032)
土壤盐渍化是威胁农作物生产的非生物胁迫因素之一[1].在盐胁迫条件下,高等植物主要是通过Na+/H+逆向转运蛋白来实现Na+外排,抗拒盐离子毒害[2-4].随着人们相继在多种植物及酵母的生物膜上观察到Na+/H+逆向转运蛋白的活性[5-6],有关质膜Na+/H+逆向转运蛋白的研究受到学术界的广泛关注.高等植物的一些盐胁迫应答反应的分子机制与酵母细胞具有相似性,因此,利用酵母系统来分离鉴定功能保守的高等植物基因被认为是一条行之有效的快捷途径[7-9].
近年来,关于植物中Na+/H+逆向转运蛋白的研究已有很多报道,但是关于盐地植物猪毛菜(Salsola collina Pall)Na+/H+逆向转运蛋白基因的研究报道却很少.本研究首次成功地从盐生植物——猪毛菜中克隆了液泡膜型Na+/H+逆向转运蛋白基因SsNHX1,并对其耐盐能力进行了验证,这对挖掘盐地植物优质耐盐基因资源具有重要意义.
1 实验部分
1.1 材料与试剂
猪毛菜采自于吉林省西部盐碱地区.酵母表达载体pPIC9和菌株GS115购于Invitrogen公司;克隆载体pMD18-T购于大连宝生物公司TaKaRa公司;DNA限制性内切酶,Taq酶,T4DNA连接酶,RNA PCR kit,DNA凝胶回收试剂盒,质粒提取试剂盒,DNA Marker购自大连宝生物公司.PCR引物合成和基因测序均由上海生工生物公司完成.
1.2 实验方法
1.2.1 SsNHX1基因编码区克隆
根据SsNHX1基因全序列设计引物I(含Bam HI酶切位点)和J(含Eco RI酶切位点),序列如下:
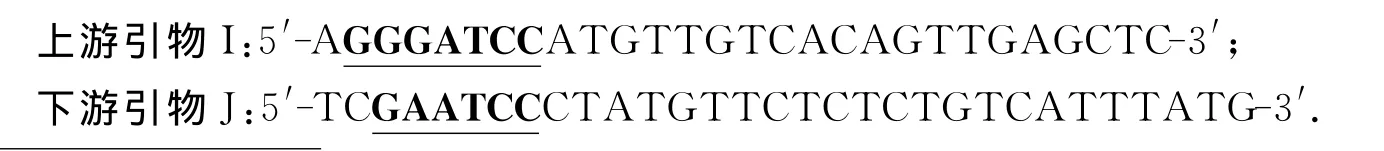
提取猪毛菜叶片RNA,通过逆转录获得其cDNA,再进行PCR扩增,获得了SsNHX1基因的编码区序列,将之连接在pMD18-T载体上,转化大肠杆菌,并进行鉴定及测序.将含有BamHI和EcoRI酶切位点的pMD18-T命名为pMD18-T1.
1.2.2 酵母重组表达载体pPIC-SsNHX1的构建
将含有目的基因的pMD18-T1载体和表达载体pPIC9用Bam HI和Eco RI分别进行双酶切;试剂盒回收目的片段和载体片段,连接2h;取10μL连接产物转化,氨苄青霉平板筛选转化子;用Bam HI和Eco RI酶切验证重组质粒,命名为pPIC-SsNHX1.
1.2.3 重组酵母转化子的获得
(1)重组载体的线性化和酵母的转化
酶切表达载体pPIC-SsNHX1,凝胶回收目的片段;取20μL目的片段,加入100μL酵母感受态细胞,将二者混匀后,转入电转环,冰上放置10min,放入基因导入仪中(宁波,新芝JY-2000-1B),调节其电压为1500V,电容为50μF,电阻为200Ω.电转化酵母细胞7.2ms,立即加入700μL预冷的1mol/L山梨醇,混匀,混合物吸出至离心管中,30℃缓慢摇动1h;分别取100,200μL涂MD平板,充分吸干水分后,封口于30℃培养箱中倒置培养,2~3d后观察转化子生长情况.同时,取未转化的酵母感受态细胞涂MD平板作负对照.
(2)重组酵母转化子的表型鉴定
取培养在MM和MD培养基中(2~3d)的酵母转化子(直径3nm)观察表型大小[9-10].
(3)重组酵母转化子的分子生物学鉴定
酵母重组子液体MD中30℃过夜培养,提取酵母基因组DNA,以引物1做PCR检测.
(4)重组酵母转化子的耐盐实验
将重组酵母转化子和空白酵母共同转到含有0.5mol/L NaCl的YPD固体平板上,30℃培养2~3d.计算菌落的直径和生长速率.
2 结果和分析
2.1 酵母表达载体pPIC-SsNHX1的构建
我们从猪毛菜基因组中克隆了1700bp的SsNHX1基因编码区全序列(两侧有Eco RI和Bam HI酶切位点),如图1-A所示.将其连接到pMD18-T载体后进行测序,连接结果见图1-B.用Bam HI和Eco RI将SsNHX1基因卸载下来,回收后连接到酵母表达载体pPIC9的Bam HI和Eco RI位点中,同时将酵母表达载体pPIC9的信号肽替换掉,结果见1-C.酵母表达载体pPIC-SsNHX1示意图见图1-D.
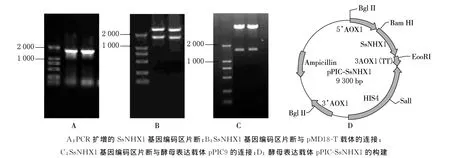
图1 酵母表达载体pPIC-SsNHX1构建
2.2 重组酵母转化子pPIC9-SsNHX1的获得
用BglⅡ酶切重组的毕赤酵母表达载体pPIC9-SsNHX1,使其切线性化,利用电转法将目的基因转入到酵母基因组中获得转化子.由于转化子中有组氨酸基因,而野生型的毕赤酵母GS115为组氨酸基因缺陷型,所以转化子在不含组氨酸的选择培养基MD上能正常生长.3d后挑取8个酵母单克隆菌落,分别挑至MM和MD培养基进行对比培养,鉴定表型.如果二者酵母菌生长相似、菌落大小差不多,说明目的片段为单点插入整合,表型为His+Mut+;如果在MD培养基上生长的菌落明显比MM培养基上的大,说明基因片段为双点替换整合,表型为His+Muts.我们挑取的8个酵母转化子,经过MM和MD培养基对比培养发现,从表型上看绝大部分是His+Mut+型,只有第4个菌落为His+Muts型,结果如图2所示.
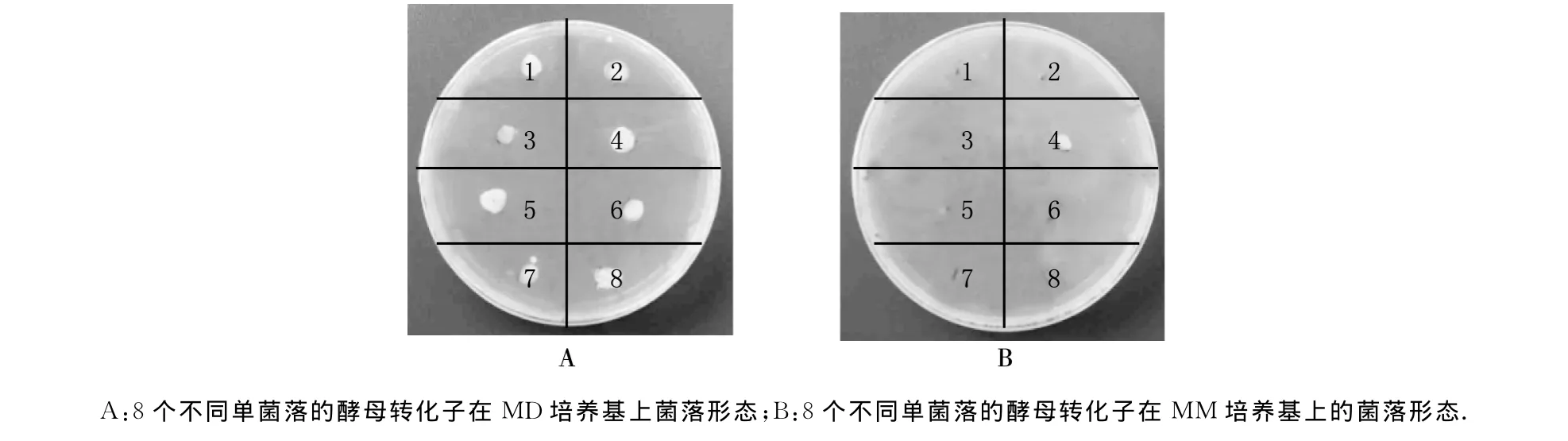
图2 猪毛菜SsNHX1酵母转化子在MD和MM培养基上的生长表型鉴定
2.3 酵母转化子的分子生物学鉴定
参照毕赤酵母表达手册方法提取上述7个His+Mut+型酵母转化子的总DNA,利用PCR扩增进行检测,方法和扩增程序如前所述,结果如图3所示.由图3可见,7份酵母转化子均为阳性,此结果表明外源目的基因已经成功整合到酵母GS115基因组中.
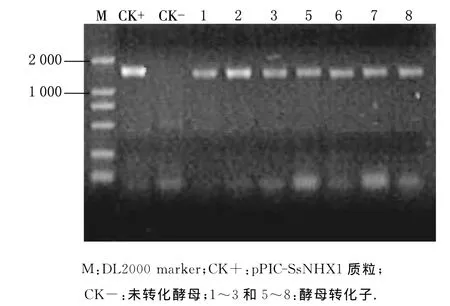
图3 酵母转化子的PCR鉴定结果

图4 酵母转化子在盐胁迫条件下的生长情况
2.4 重组酵母转化子的耐盐实验
为了验证猪毛菜SsNHX1基因在酵母中是否能发挥耐盐功能,30℃条件下,将4个转化子和空白对照酵母培养在含有0.5mol/L NaCl的YPD固体平板中,培养2~3d后观察,结果如图4所示.从图4我们可以看出,重组酵母转化子的生长速率和菌落直径均明显高于对照,这初步表明猪毛菜SsNHX1基因能够有效地提高酵母转化子的耐盐能力.
3 结论
本研究首次从盐生植物猪毛菜中克隆了液泡膜型Na+/H+逆向转运蛋白基因SsNHX1(EU073422),并以酵母为表达载体,获得了阳性转化子.耐盐实验表明整合有猪毛菜SsNHX1基因的酵母在含有0.5mol/L NaCl的培养基中,与对照相比有更高的生长速率.这与滨藜液泡膜Na+/H+逆向转运蛋白基因(AgNHX1)、棉花液泡膜Na+/H+逆向转运蛋白基因(GhNHX1)和小麦液泡膜Na+/H+逆向转运蛋白基因(TaNHX1)在酵母中表达的研究结果相似[7,9,11].这充分证明了猪毛菜液泡膜Na+/H+逆向转运蛋白基因在真核生物酵母的耐盐胁迫中起到了重要的作用.
[1]BRAY E A,BAILEY-SERRES J,WERETILNYK K.Biochemical and molecular biology of plants[J].American Society of Plant Physiologists,Rockville,2000:1158-1249.
[2]GAXIOLA R A,LI J,UNDURRAGA S,et al.Fink GR drought-and salt-tolerant plants result from overexpression of the AVP1H+-pump[J].Proc Natl Acad Sci USA,2001,98:11444-11449.
[3]PARDO J M,CUBERO B,LEIDI E,et al.Alkali cation exchangers:roles in cellular homeostasis and stress tolerance[J].Exp Bot,2006,57:1181-1199.
[4]马清,包爱科,伍国强,等.质膜 Na+/H+逆向转运蛋白与植物耐盐性[J].植物学报,2011,46(2):206-215.
[5]WU C A,YANG G D,MENG Q W,et al.The cotton GhNHX1gene encoding a novel putative tonoplast Na+/H+antiporter plays an important role in salt stress[J].Plant Cell Physiol,2004,45(3):600-607.
[6]FUKUDA A,NAKAMURA A,TAGIRI A,et al.Function,intracellular localization and the importance in salt tolerance of a vacuolar Na+/H+antiporter from rice[J].Plant Cell Physiol,2004,45(2):146-159.
[7]YU J N,HUANG J,WANG Z N,et al.An Na+/H+antiporter gene from wheat plays an important role in stress tolerance[J].J Biosci,2007,32(6):1153-1161.
[8]李望丰,刘立侠.SsNHX1基因在紫花苜蓿中的表达及耐盐性探讨[D].长春:东北师范大学,2010.
[9]OHTA M,HAYASHI Y,NAKASHIMA A,et al.Introduction of a Na+/H+antiporter gene from Atriplex gmelini confers salt tolerance to rice[J].FEBS Lett,2002,532:279-282.
[10]HAMADA A,SHONO M,XIA T,et al.Isolation and characterization of a Na+/H+antiporter gene from the halophyte Atriplex gmelini[J].Plant Mol Biol,2001,46:35-42.

