壳寡糖作用于巨噬细胞的机制初探
麻 攀,于炜婷,魏 鹏,许青松,白雪芳,杜昱光*
1中国科学院大连化学物理研究所1805组,大连 116023;2中国科学院研究生院,北京 100049
壳寡糖作用于巨噬细胞的机制初探
麻 攀1,2,于炜婷1,2,魏 鹏1,2,许青松1,白雪芳1,杜昱光1*
1中国科学院大连化学物理研究所1805组,大连 116023;2中国科学院研究生院,北京 100049
研究壳寡糖对免疫系统中巨噬细胞作用的具体机制。结合流式细胞仪和激光共聚焦实验检测壳寡糖与巨噬细胞相互作用,通过凝胶阻滞实验在体外验证壳寡糖的胞内定位。实验结果证明壳寡糖与巨噬细胞相互作用过程如下,先与细胞膜结合,然后进入细胞内,最后定位在细胞核的核酸(DNA/RNA)上。
壳寡糖;巨噬细胞;DNA;RNA
巨噬细胞是机体内具有强大吞噬功能的细胞,广泛分布于全身各处组织内。它不仅担负着机体的非特异性防御功能,不断清除外源异物、体内衰老以及变异细胞,并且还可以作为抗原呈递细胞将特异性免疫应答和非特异性免疫应答相连从而辅助机体免疫。几丁质的脱乙酰降解产物壳寡糖因其不但具有几丁质、壳聚糖的许多生理活性之外,如抗菌[1],抗氧化[2],抗肿瘤[3,4]和免疫调节[5]等,还具有分子量小、毒性低、水溶性好等几丁质和壳聚糖所不具备的优点,因此已经越来越受到人们的青睐。本实验通过相应方法验证了壳寡糖与巨噬细胞的相互作用机制以及壳寡糖在巨噬细胞胞内定位,这将为今后相关的研究提供了较好的理论依据。
1 材料和方法
1.1 主要药品试剂、仪器
壳寡糖:本实验室生产(聚合度2-8,脱乙酰度大于95%),RAW264.7巨噬细胞株(上海细胞库),RPMI1640细胞培养液(sigma),胎牛血清(杭州四季青),2-AMAC(sigma),CO2培养箱(德国 Heraeus公司),离心机(德国 Heraeus公司),激光共聚焦(Leica SP2型),流式细胞仪(BD FACSVantage SE)。
1.2 实验方法
1.2.1 细胞培养
RAW264.7细胞用含有10%胎牛血清的RPMI1640培养液(加入100 U/ml青霉素和100 U/ml链霉素),在条件为5%CO2浓度,37℃的CO2培养箱中培养,三天传一代。
1.2.2 流式细胞仪检测壳寡糖与巨噬细胞的结合
选取处于对数生长期的细胞(1×105个/mL),用0.1 M PBS洗三遍,离心(1000 rpm,5 min)回收细胞。壳寡糖用荧光标记物2-AMAC标记[6],以下简称之为2-AMAC-COS。将回收的细胞分别与2-AMAC或2-AMAC-COS在4℃下孵育15 min。壳寡糖竞争组则将细胞与2-AMAC-COS在4℃下孵育15 min后,再与未标记壳寡糖4℃下孵育15 min,用4%多聚甲醛固定液固定,进行流式细胞仪检测,激发波长为488 nm,发射波长为520 nm。全过程在避光条件下进行。
1.2.3 激光共聚焦检测壳寡糖与巨噬细胞相互作用
将处于对数生长期的巨噬细胞(1×105个/ mL)等量地接种到盖玻片上,让其贴壁24 h形成细胞单层。取出带有细胞单层的盖玻片用0.1 M PBS洗三遍后,分别与2-AMAC或2-AMAC-COS在37℃下孵育指定的时间。PBS洗三遍,用4%多聚甲醛固定液固定后,进行激光共聚焦检测,激发波长为488 nm,发射波长为520 nm。全过程在避光条件下进行。
1.2.4 DNA/RNA结合实验
用CTAB法提取细胞总基因组DNA,Trizol试剂盒(宝生物,大连)提取细胞总RNA。分别用300 ng基因组DNA或1 μg总RNA与壳寡糖以相应比例在室温下孵育30 min后,用琼脂糖凝胶电泳进行检测。DNA组用0.5%琼脂糖凝胶检测,RNA组用1%琼脂糖凝胶检测。RNA组全过程用具均用DEPC水处理以去除RNA酶降解影响。DNA组中已用RNA酶处理去除RNA干扰。
1.2.5 数据处理
所有数据结果均重复三遍以上以确保准确性。
2 结果和讨论
2.1 壳寡糖与巨噬细胞的结合

流式细胞仪检测发现壳寡糖与巨噬细胞有较明显地结合作用。图1.A显示,用荧光标记物2-AMAC标记壳寡糖后,让其与巨噬细胞在4℃下结合15 min,荧光峰明显右移,荧光值显著增强,表明荧光标记壳寡糖明显地结合到巨噬细胞上。当用未标记的壳寡糖竞争这种结合作用后,发现可以显著竞争掉荧光标记壳寡糖与巨噬细胞的结合(图1.B),表明壳寡糖与巨噬细胞的这种结合作用是可逆的。
2.2 壳寡糖与巨噬细胞的相互作用
发现壳寡糖可以与巨噬细胞可逆地结合后,我们更希望直观地看到壳寡糖与巨噬细胞的相互作用的过程,因此我们用激光共聚焦实验来进行下一步验证。如图2所示,随着时间的递进,壳寡糖与巨噬细胞的相互作用是一种有序的过程。首先,壳寡糖结合到细胞的表面,随着时间延长,壳寡糖进入到细胞质中,最后定位到细胞核内(如图中箭头所示)。而荧光标记物2-AMAC只是弥散在细胞内,并且其荧光强度要明显低于2-AMAC-COS。因为其分子量较小,它可能是通过被动扩散的方式进入细胞内的,而2-AMAC-COS则可能是一种受体介导的方式。壳寡糖进入细胞的方式我们会在接下来的实验中继续验证。
2.3 壳寡糖与核酸(DNA/RNA)的体外结合作用
在图2中我们发现壳寡糖可以明显地定位在核内,因此,我们想证明壳寡糖是定位在核内的哪些部位。我们用凝胶阻滞实验(gel-retardation assay)在体外验证了壳寡糖与DNA/RNA的结合作用。图3指出壳寡糖能明显地阻止核酸在胶内的迁移,并且这种阻止作用随着壳寡糖与核酸比例的增加而逐渐增强,壳寡糖与DNA的结合效果要好于RNA。表明壳寡糖在细胞核内是定位在核酸上。当然,也不排除其有可能也会定位在某些核内蛋白上,在接下来的实验中,我们也会做相应的验证。
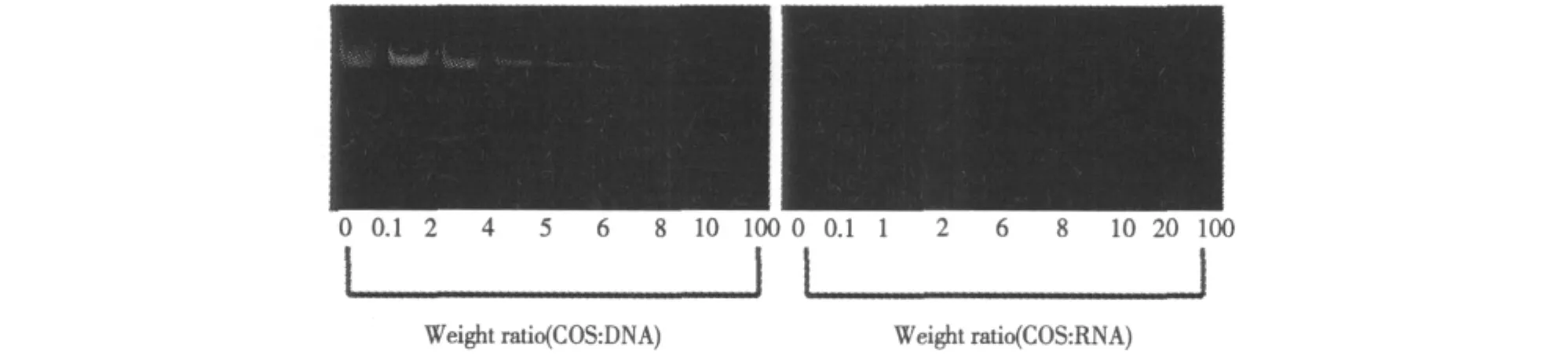
图3 壳寡糖与DNA/RNA体处结合作用Fig.3 The binding between COS and DNA/RNAin vitro
3 结论
本实验验证了壳寡糖与巨噬细胞相互作用的机制以及其在巨噬细胞内的定位情况。它是以一种有序的方式作用于细胞,首先与细胞膜可逆地结合,然后进入到细胞质中,最后定位在核内的核酸(DNA/RNA)上。
1 Qin CQ,Li HR,Xiao Q,et al.Water-solubility of chitosan and its antimicrobial activity.Carbohydr Polym,2006,63: 367-374.
2 Huang RH,Rajapakse N,Kim SK.Structural factors affecting radical scavenging activity of chitooligosaccharides(COS) and its derivatives.Carbohydr Polym,2006,63:122-129.
3 Xu QS,Dou JL,Wei P,et al.Chitooligosaccharides induce apoptosis of human hepatocellular carcinoma cells via upregulation of Bax.Carbohydr Polym,2008,4:509-514.
4 Xu QS,Wei P,Dou JL,et al.Studies on the Inhibitory effects of oligochitosan on SMMC-7721 cells of hepatocarcinoma.Nat Prod Res Dev(天然产物研究与开发),2009,21:152-154.
5 Dou JL,Tan CY,Du YG,et al.Effects of chitooligosaccharides on rabbit neutrophils in vitro.Carbohydr Polym,2007,69:209-213.
6 Zhao XM,She XP,Yu W,et al.Effects of oligochitosans on tobacco cells and role of endogenous nitric oxide burst in the resistance of tobacco to Tobacco mosaic virus.J Plant Pathol,2007,89:55-65.
Mechanisms of Chitosan Oligosaccharides Acting on Macrophage
MA Pan1,2,YU Wei-ting1,2,WEI Peng1,2,XU Qing-song1,BAI Xue-fang1,DU Yu-guang1*
1Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian 116023,China;2Graduate School of Chinese Academy Sciences,Bejing 100049,China
The molecular mechanisms of chitosan oligosacchrides(COS)acting on macrophages in immune system were investigated here.Through Laser Scanning Confocal Microscopy(LSCM)and Flow cytometric analysis,we examined the interaction between COS and macrophages.Gel-retardation experiment was used to investigate the location of COS in the nucleus.The results suggested that the interaction between COS and macrophages was followed in proper sequence.First,COS bound to the plasma membrane of macrophage cells before entering into the cytoplasm,and lastly,it was located on DNA/RNA in the nucleus.
chitosan oligosaccharides(COS);macrophage;DNA;RNA
R392.12
A
1001-6880(2012)05-0660-03
2010-11-26 接受日期:2011-04-08
国家科技重大专项课题(2009ZX095010)新药研究开发关键技术研究
*通讯作者 Tel:86-411-84379060;E-mail:articles1805@gmail.com

