烟草青枯病病圃土壤微生物多样性初步分析
蔡刘体 ,商胜华 ,胡重怡 ,王丽丽 ,刘艳霞 ,汪汉成 ,杨兴明 ,石俊雄*
1.贵州省烟草科学研究所,贵阳市金阳新区云潭北路 550081
2.南京农业大学资源与环境科学学院,南京市卫岗童卫路1号 210095
烟草青枯病是烟草的重要病害之一,几乎分布于世界上所有的烤烟种植区,其中热带和亚热带烟区发病尤为严重[1]。在我国,烟草青枯病是危害南方烟区烟叶生产的主要病害,一旦发病往往会造成整株死亡,造成重大经济损失[2-3]。目前,在烟叶生产过程中尽管采用化学药剂防治[4-6]、生物防治[7-9]、合理轮作[8,10-11]、种植抗病品种[12-14]、调整土壤微生物和调整烟苗移栽期等综合措施来防治烟草青枯病[15],但仍无法有效控制该病的发生。在烟草青枯病生物防治研究方面,目前主要是利用青枯菌的拮抗微生物来防治烟草青枯病,虽然筛选拮抗微生物及其在实验室或温室中拮抗试验效果不错的研究报道较多[16-18],但是在大田生产上却鲜有应用成功的报道。主要原因之一是植烟土壤是一个复杂的生态系统,耕作层土壤中微生物众多,包含细菌、真菌和病毒等,其微生物的多样性和复杂性对青枯菌的拮抗微生物定殖和扩繁有一定影响。因此,分析烟草青枯病土壤中微生物的群落结构,将有利于拮抗微生物的定殖、扩繁和拮抗作用的发挥。目前,对土壤微生物群落的分析,尤其是快速分析非常困难[19],随着分子生物学和生物信息学的快速发展以及PCR(Polymerase Chain Reaction)技术的日趋成熟,一些建立在 PCR技术基础上的分子生物学分析方法如变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)[20]、末端 限制性片段多态性(terminal restriction fragment length polymorphism,T-RFLP)和16S保守区域片段文库的构建[21]等技术已经发展起来。这些方法不需要培养、分离和纯化微生物,也不受微生物是否可在实验室培养的限制,解决了传统微生物多样性分析中的一些分离培养方面的问题。本研究利用微生物保守区域片段文库构建,初步分析了烟草青枯病土中细菌、真菌的多样性,旨在为利用青枯病拮抗菌有效防治该病害提供依据。
1 材料与方法
1.1 材料
烟草青枯病土壤取自贵州省烟草科学研究所福泉烟草青枯病病圃。五点混合法采集土壤样品,取土壤表层8~20 cm的土层,过0.2 mm筛,去除杂质。
微生物保守区域片段的扩增引物(表1)由上海生工生物有限公司合成;琼脂糖凝胶回收试剂盒、DNA Marker、dNTPs、DNA聚合酶、连接酶、克隆载体等试剂购自大连宝生物(TAKARA)有限公司;序列测定由上海生工生物有限公司完成。

表1 用于微生物保守区域扩增的引物信息Tab.1 The informtion of primers used to amplify themicrobial conservative fragments
1.2 方法
1.2.1 土壤总DNA的提取和检测
采用玻璃珠均质和液氮研磨法相结合以及SDS-CTAB法,提取病圃土壤中微生物DNA,用纯化试剂盒纯化获得DNA。
采用琼脂糖凝胶电泳法检测土壤微生物总DNA和PCR扩增产物。
1.2.2 PCR扩增与DNA纯化
以土壤微生物总 DNA为模板,8f,926r;338F,518R为引物对进行PCR扩增。反应体系总体积为25.0 μL,其中模板(土壤DNA)1.0 μL,正向引物和反向引物(10 μmol/μL)各1.0 μL,10×PCR Buffer(含有Mg2+)2.5 μL,dNTP(2.5 mmol/μL)1.0 μL,Taq(5 U/μL)0.2 μL,蒸馏水补体积至25.0 μL;反应程序:95℃预变性5 min;94℃变性40 s,55℃变性50 s,72℃延伸1 min,32个循环;最后,72℃ 延伸10 min。
按照TAKARA公司凝胶回收试剂盒说明书操作,对PCR扩增产物进行回收,用琼脂糖凝胶电泳检测回收产物。
1.2.3 微生物多样性初步分析
保守区域文库中检测为阳性的单克隆由上海生工生物公司测序。获得的序列信息通过NCBI数据库(www.ncbi.nlm.nih.gov)及EzTaxon网站(www.eztaxon-e.org)进行在线分析和比对。
2 结果与分析
2.1 烟草青枯病土壤微生物总DNA提取
琼脂糖凝胶电泳检测提取纯化后的土壤微生物总DNA,结果显示提取的DNA大小约在2.0~10.0 kb范围之间,通过DNA试剂盒的纯化,可以降低土壤中腐植酸以及多酚类等化合物对PCR反应的影响。
2.2 烟草青枯病土壤微生物16S-rRNA和ITS保守序列文库构建
以纯化的DNA为模板,用细菌特异性8f和926r引物、真菌特异性338F和518R引物,经过PCR扩增,获得与预期片段大小一致的条带,分别在1000 bp和300 bp左右。分别用8f,926r引物;338F,518R引物扩增的产物构建文库,从文库中随机挑取部分单菌落,用PCR方法检测其携带的片段,部分琼脂糖电泳检测结果如图1所示,图1表明随机挑取的大多数单菌落携带有目的条带。阳性克隆的序列的测定由上海生工生物有限公司完成。
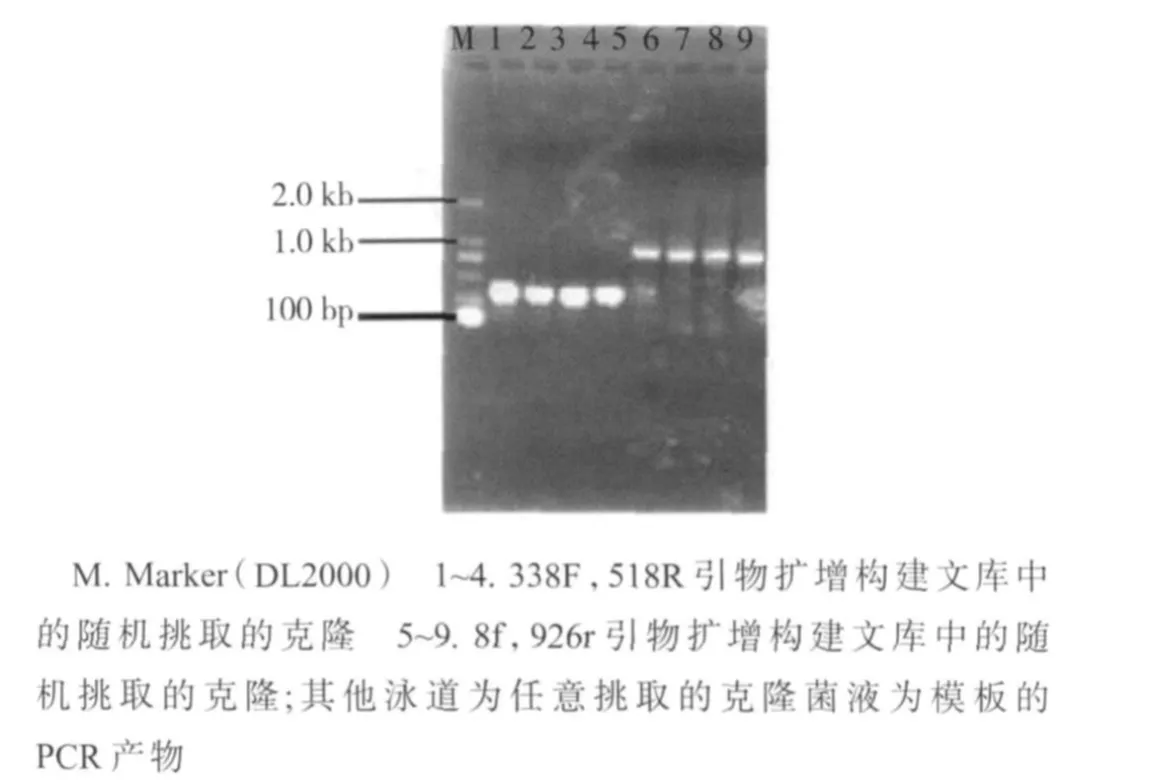
图1 PCR检测随机挑取的单克隆菌落的插入片段Fig.1 Detection of the insert fragments by PCR from some clones selected randomly
2.3 烟草青枯病土壤细菌类和真菌类微生物的多样性
烟草青枯病土壤中获得的细菌类信息如表2所示,结果显示,土壤中含有假单胞杆菌属类和鞘氨醇杆菌类等丰富细菌类微生物种类,其中包含部分不可培养假单胞杆菌、芽孢菌等细菌,还有部分序列通过比对没有获得相似性比较高的信息。表3结果显示烟草青枯病土壤中真菌类包括黑霉菌,腐质霉属真菌,尖孢镰刀菌及一些不可培养的真菌,其中霉菌类和不可培养的真菌类包括的菌类比较丰富。

表2 烟草青枯病病圃土壤微生物中部分细菌信息Tab.2 Partial bacteria information of soil microbes from tobacco bacterial wilt disease nursery

表3 烟草青枯病病圃土壤微生物中部分真菌类信息Tab.3 Partial fungi information of the soil microbes from tobacco bacterial wilt disease nursery
3 小结与讨论
土壤中微生物群落的快速分析比较困难,采用遗传物质水平上分析微生物的多样性,既克服了以往用传统培养技术来分析土壤微生物费时费力的缺点,又可挖掘不可培养的微生物信息,因此末端限制性片段多态性、变性梯度凝胶电泳等分子手段已广泛地应用于环境微生物多样性分析,以及微生物生态研究和检测[22-23]。但这些不依赖培养的分子生物学分析方法都依赖于所提取的土壤微生物总DNA的质量[24-26]。土壤中含有腐植酸、多酚类化合物、重金属等多种生物活性抑制物,可能影响土壤DNA的提取质量,抑制DNA聚合酶的活性从而影响土壤微生物多样性的分析,如果提取的DNA质量不高,如含有腐植酸或多酚类化合物,将影响后续微生物多样性分析的效果。SDS和CTAB都可用于细胞裂解,用SDS-CTAB法提取土壤总DNA,既可达到裂解效果,还有助于去除腐殖酸,有利于提高所提取DNA的质量。本试验采用SDS-CTAB法获得了2.0~10.0 kb范围片段的DNA,经过纯化后用于PCR扩增的模板,PCR扩增效果比较好。烟草青枯病病圃土壤微生物群落中含有伯克霍尔德氏菌(Burkholderia fungorum)、假单胞杆菌属类(Pseudomonas graminis)、黑 霉 菌(Aspergillus niger)、尖 孢 镰 刀 菌 属(Fusarium oxysporum)等丰富的细菌类和真菌类微生物,也包括部分不可培养的微生物。
通过保守区域文库构建,虽然通过测序获得了部分的微生物遗传信息,但仍然只是土壤中的部分信息。一方面可能是测序样本还不够多的原因,另一方面跟微生物保守区域文库质量本身有很大的关系[27-28]。本研究只对细菌和真菌保守区域构建文库,对土壤中的其它微生物(古生菌和病毒类)还不能全面认识,烟草青枯病土壤中微生物多样性和可能发生的变化,尚需采用文库构建与 DGGE 技术[20,29]、T-AFLP 技术[30]、高通量测序技术[31-32]或微生物芯片技术[33]相结合,综合分析土壤中微生物多样性的构成,这方面有待进一步试验。
[1]Hayward A C. Biology and epidemiology of bacterial wilt caused by Ralstonia solanacearum[J].Annu Rev Phytopathol,1991,29:65-87.
[2]陈瑞泰,朱贤朝,王智发,等.全国16个主产省(区)烟草侵染性病害调查报告[J].中国烟草科学,1997(4):1-7.
[3]孔凡玉.烟草青枯病的综合防治[J].烟草科技,2003(4):42-43,48.
[4]罗战勇,陈元生,周会光.防治烟草青枯病的药剂筛选试验[J].广东农业科学,2000(1):42-43.
[5]陈永惠,黄福新.烟草青枯病药剂防治试验[J].广西植保,1996(4):23-25.
[6]卢洪兴,曾军,邱志丹.烟草青枯病发生与药剂防治研究[J].福建省农科院学报,1996,11(3):41-45.
[7]Fujie M,Takamoto H,Kawasaki T,et al.Monitoring growth and movementofRalstonia solanacearum cellsharboring plasmid pRSS12 derived from bacteriophage Ф RSS1[J].J Biosci Bioeng,2010,109(2):153-158.
[8]Jones J B,Jackson L E,Balogh B,et al.Bacteriophages for plant disease control[J].Annu Rev Phytopathol,2007,45:245-262.
[9]郭坚华,孙平华,吴云波.植物细菌性青枯病的生物防治机制和途径[J].中国生物防治,1997,13(1):42-46.
[10]张竹青,罗宽,高必达.七株抗青枯病菌生防菌的初步鉴定[J].湖南农业大学学报,2002,28(6):512-513.
[11]董春,董成刚,赵青峰.利用拮抗细菌防治烟草青枯病初步研究[J].广东农业科学,1996(5):28-30.
[12]黄福新,陈永惠,周兴华.烟草青枯病综合防治研究[J].广西农业科学,1997(1):32-35.
[13]朱贤朝,王彦亭,王智发.中国烟草病虫害防治手册[M].北京:中国农业出版社,2001.
[14]匡传富,罗宽.烟草品种对青枯病抗病性及抗性机制的研究[J].湖南农业大学学报,2002,28(5):395-398.
[15]纪成灿,方树民,顾钢.烟草品种抗青枯病鉴定中的相关因素分析[J].中国烟草科学,2000(2):1-4.
[16]Lwin M,Ranamukhaarachchi S L.Development of biological control of Ralstonia solanacearum through antagonistic microbial populations[J].International Journal of Agriculture&Biology,2006,8(5):657-660.
[17]张深,吴洪田,霍沁建,等.烟草青枯病拮抗菌的筛选及抑菌活性的测定[J].烟草科技,2007(6):56-58.
[18]Wang A A,Zhao Z F,Liu Z Z,et al.Effect of K1,K2 anti-bacterial agents on tobacco Ralstonia Solanacearum[J].Engineering,2010(2):930-934.
[19]Marsh T L,Saxman P,Cole J,et al.Terminal restriction fragment length polymorphism analysis program,a webbased research tool for microbial community analysis[J].Applied and Environmental Microbiology,2000,66(8):3616-3620.
[20]Fischer S G,Lerman L S.DNA fragments differing by single basepairsubstitutionsareseparated in denaturing gradient gels:Correspondence with melting theory[J].Proc Natl Acad Sci USA,1983,80(6):1579-1583.
[21]Liu W T,Marsh T L,Cheng H,et al.Characterization of microbial diversity by determining terminal restriction fragment length polymorphisms of genes encoding 16S rRNA[J].Applied and Environmental Microbiology,1997,63(11):4516-4522.
[22]孙庆华,柏耀辉,赵翠,等.DGGE、T-RFLP、LH-PCR对两种活性污泥的微生物种群多样性分析的比较[J].环境工程学报,2009(8):1365-1370.
[23]张汉波,段昌群,屈良鹄.非培养方法在土壤微生物生态学研究中的应用[J].生态学杂志,2003(5):131-136.
[24]Degrange V,Bardin R.Detection and counting of nitrobacter populations in soil by PCR[J].Appl Environ Microbiol,1995,61(6):2093-2098.
[25]邢薇,左剑恶,林甲,等.20℃ EGSB反应器中颗粒污泥的微 生 物 种 群 结 构 分 析[J].环 境 科 学 ,2008,29(9):2558-2563.
[26]胡磊,杨广,尤民生.茶园土壤微生物总DNA不同提取方法的比较[J].基因组学与应用生物学,2010(2):361-368.
[27]Hu Y,Fu C,Yin Y,et al.Construction and preliminary analysis of a deep-sea sediment metagenomic fosmid library from Qiongdongnan Basin,South ChinaSea[J].Mar Biotechnol,2010,12(6):719-727.
[28]Castro A P,Quirino B F,Allen H,et al.Construction and validation of two metagenomic DNA libraries from Cerrado soil with high clay content[J].Biotechnol Lett,2011,33(11):2169-2175.
[29]Saubusse M,Millet L,Delbes C,et al.Application of single strand conformation polymorphism-PCR method for distinguishing cheese bacterial communities thatinhibit Listeria monocytogenes[J].International Journal of Food Microbiology,2007,116(1):126-135.
[30]Osborn A M,Moore E R,Timmis K N.An evaluation of terminal restriction fragment length polymorphism(T-AFLP)analysis for the study of microbial community structure and dynamics[J].Environmental Microbiology,2000,2(1):39-50.
[31]Schloss P D.A high-throughput DNA sequence aligner for microbial ecology studies[J].PLoS ONE,2009,4(12):1-9.
[32]Zaneveld J R,Parfrey L W,Van Treuren W,et al.Combined phylogenetic and genomic approaches for the high-throughput study of microbial habitat adaptation[J].Trends Microbiol,2011,19(10):472-482.
[33]Nichols D,Cahoon N,Trakhtenberg E M,et al.Use of ichip forhigh-throughputin situ cultivation of"uncultivable"microbial species[J].Appl Environ Microbiol,2010,76(8):2445-2450.

