磁共振波谱分析在颅脑胶质瘤分级中的应用研究
李伟 龙晚生 梁英林 罗学毛 兰勇 蔡小琴 广东省江门市中心医院放射科 (江门 529030)
神经胶质瘤是颅内最常见的原发性肿瘤,其诊断与治疗一直是临床的难题,磁共振成像(Magnetic Resonance Imaging ,MRI)已成为评价胶质瘤的首选影像学方法,它在胶质瘤分级和间接评估肿瘤生物学行为及预后方面有一定作用。氢质子磁共振波谱分析(Proton Magnetic Resonance Spectroscopy, 1H-MRS)是利用核磁共振J-耦合和化学位移现象分析特定原子核及化合物的方法,是目前唯一能评价人体器官代谢、生物化学变化及化合物定量的无创性研究方法。本研究对49例脑胶质瘤行三维多体素或单体素波谱分析,评价各级胶质瘤的MRS表现及对胶质瘤进行分级。
1.材料与方法
1.1 临床资料
2008年1月~2010年6月临床收治的胶质瘤患者病例49例,男29例,女20例,年龄29~79岁,平均48.3±10.5岁,其中低级别胶质瘤22例(I级胶质瘤8例、Ⅱ级胶质瘤14例),高级别胶质瘤27例(Ⅲ级胶质瘤15例、Ⅳ级胶质母瘤12例),所有病例均经活检病理或手术证实。
1.2 仪器与方法
采用Philips Achieva 1.5T双梯度超导磁共振扫描仪,梯度场强为66mT/m和33mT/m,梯度切换率为90mT/m/s和180mT/m/s,SENESE头部8通道正交鸟笼式线圈,扫描包括常规MRI平扫、增强扫描和MRS。
常规MRI平扫:T1WI轴位和矢状位扫描,TR/TE=690/15ms,层数20,层厚5mm,层间距1mm,视野23cm,激励次数(NEX) 2,矩阵192×256;T2WI轴位扫描,TR/TE=4200/90ms,层数20,层厚5mm,层间距1mm,视野23cm,激励次数1,矩阵192×256;T2WI轴位FLAIR扫描,TR/TE=11000/135ms,TI=1800ms,层数20,层厚5mm,层间距1mm,视野23cm,激励次数1,矩阵256×256。
常规MRI增强扫描:T1WI轴位、矢状位和冠状位扫描,TR/TE=690/15ms,层数20,层厚5mm,层间距1mm,视野23cm,激励次数2,矩阵192×256;脂肪抑制STIR序列T1WI轴位和冠状位扫描,TI=150ms,TR/TE=690/15ms,层数20,层厚5mm,层间距1mm,视野23cm,激励次数2,矩阵192×256。
MRS成像:在常规MRI平扫以后增强扫描前进行,有单体素和三维多体素化学位移成像(chemical shift imaging,CSI ) MRS 方法,均采用点解析波谱 (point resolved selective spectroscopy,PRESS) 技术。及化学位移选择饱和法(chemical shift selecting saturation ,CHESS) 进行压水压脂。多体素的参数为TR=1500ms,TE=144ms,视野120mm×120mm,兴趣区80mm×80mm,25个采集点,体素容积为10mm×10mm×10mm,激励次数1,成像时间4min15s。单体素的参数为TR=2000ms,TE=144ms,体素容积为15mm×15mm×15mm,激励次数128,成像时间4min36s。
1.3 数据处理
MRS原始数据采集后在操作台进行后处理,程序包括:水参照后处理(去除残余水)、过滤、零充填插值、傅立叶转换、频率飘移矫正、基线矫正、相位矫正、曲线适配8个步骤。
在横轴面图像上取肿瘤最大层面,分别在强化的瘤体部分和瘤周水肿区( T2WI上呈高信号,增强扫描时无强化) 及对侧半球远离肿瘤的正常脑区设置兴趣区( Region of Interest,ROI),每个采样点根据病变大小选择1~3个体素进行测量,取平均值以减少误差。MRS评价指标包括氮-乙酰天门冬氨酸(N-acetyl aspartate, NAA)、肌酸(Creatine, Cr)和胆碱复合物(Choline, Cho)的峰值高度及比值。并对各种病变的波谱特点进行回顾性分析,以探讨3种肿瘤的MRS特征。
1.4 统计学处理
使用SPSS 13.5统计分析软件包。采用t检验对瘤体强化区、水肿区的NAA、Cho 、Cr、NAA/Cho、NAA/Cr、Cho/Cr分别与正常脑组织区进行比较。采用单因素方差分析,比较瘤体强化区和水肿区各项代谢物值在4种级别胶质瘤之间的差异,并对有统计学意义的结果进一步行两两比较。检验水准α= 0.05。
2.结果
2.1 胶质瘤常规MR表现
22例低级别(I、II级)胶质瘤中,位置分布在颞叶6例,额叶6例,额颞叶4例,颞顶叶3例,顶叶2例,第四脑室1 例。其中I级8 例,分别为毛细胞型星形细胞瘤和室管膜下巨细胞星形细胞瘤,毛细胞型星形细胞瘤MR 平扫囊性部分T1WI 呈低或等信号,T2WI 呈高信号,实质部分信号与脑实质信号相似或高于后者,增强扫描为典型的境界清楚的囊性加强化的壁结节(图1),室管膜下巨细胞星形细胞瘤平扫和增强都可以表现不均质,增强后显著强化;II级14例,分别为纤维型星形细胞瘤、弥漫型星形细胞瘤和少突胶质细胞瘤,其在T1WI 呈低信号,T2WI 呈高信号,增强无显著变化,如出现强化则提示可能发展为恶性。22例中17例肿瘤境界清楚,5例肿瘤境界欠清楚。
27例高级别(III、IV级)胶质瘤,位置分布在颞叶6例,额叶8例,基底节区5例,顶叶4例,枕叶2例,岛叶1例,位于丘脑1例,胼胝体压部1例。其中III级胶质瘤15例,分别为间变型星形细胞瘤、间变少突胶质细胞瘤、少突2室管膜瘤和胶质瘤病;IV级胶质瘤12例,为多形性胶质母细胞瘤和胶质肉瘤。27例高级别胶质瘤中T1WI像呈低、等混杂信号22例,呈稍低信号5例;T2WI像肿瘤呈不均匀高信号;20例肿瘤境界不清楚,7例肿瘤境界较清楚。16例肿瘤通过胼胝体膝部和压部累及双侧。增强扫描24例出现显著不规则环形强化(图2),3例肿瘤呈轻度不规则强化。
2.2 不同级别胶质瘤的谱线特征
低级别胶质瘤(I、II级)的MRS表现主要为轻度抬高的Cho 峰(或升高不明显)、中度降低的NAA峰 和变化不明显的Cr峰,基本不出现Lip峰(图1);III级胶质瘤的MRS表现主要为在瘤体强化区明显升高的Cho 和明显降低的NAA峰及变化不一致的Cr 峰,Cho峰抬高程度明显大于低级别胶质瘤(I、II级)患者,瘤周水肿区Cho 峰明显升高,但较瘤体强化区要低,Cr 峰和NAA 峰较正常组织要低,也比瘤体强化区要低一些;IV级胶质瘤在瘤体强化区的MRS表现为明显升高的Cho峰和明显降低的NAA 峰及变化不一致的Cr峰,Cho峰值抬高程度大于III级胶质瘤,在1.09ppm处可出现抬高的Lip 峰(图2),在瘤周水肿区仍表现为明显升高的Cho 峰,其抬高程度低于瘤体强化区,而高于III级胶质瘤的瘤周水肿区,Cr峰较正常组织要低,也比瘤体强化区要低 (表 1)。

图1. I级胶质瘤患者,毛细胞型星形细胞瘤,图1A为T1WI增强扫描轴位像,可见典型的囊性病变及强化的壁结节,口为MRS采集的位置,图1B为其波谱图,NAA峰下降不明显,Cho峰升高,Cr未见明显改变

图2. IV级胶质瘤患者,毛细胞型星形细胞瘤,图2A为T1WI增强扫描轴位像,肿瘤外围明显不规则强化,中央不强化,口处为MRS采集的位置,图2B为其波谱图,NAA峰下降明显,Cho峰高尖,表明肿瘤细胞增生迅速,Cr峰略有下降
2.3 MRS 的测量及统计学结果
低级别(I、II级)和高级别(III、IV级)胶质瘤的瘤体强化区和瘤周水肿区与对侧正常区NAA、Cho 、NAA/Cho、NAA/Cr 均有差异 (P<0.05),而且肿瘤级别越高,差异越明显;而Cr、Cho/Cr就没有差异(P>0.05)(表1)。低级别(I、II级)与高级别(III、IV级)胶质瘤的NAA/Cho、NAA/Cr有差异(P<0.05),其他代谢物就没有差异(P>0.05),但I级与II级和III与IV级,也就是高级别、低级别组内分类的所有代谢物没有差异(P>0.05)(表 2)。
2.4 多种磁共振方法鉴别高低级胶质瘤的比较
对49例高低级别胶质瘤患者进行MRS分析后,发现以瘤体强化区的代谢物NAA/Cho<0.55为阈值,瘤周水肿区的代谢物NAA/Cho<1.18为阈值来鉴别高低级别胶质瘤具有很高的灵敏度和特异性(表3);MRI 联合采用MRS 鉴别高级胶质瘤的敏感度、特异度、阳性预测值、阴性预测值均大于单独采用MRI 的各项指标(表4) 。

表1 各级别胶质瘤不同位置代谢物含量

表2 各级别胶质瘤瘤体区代谢物两两比较
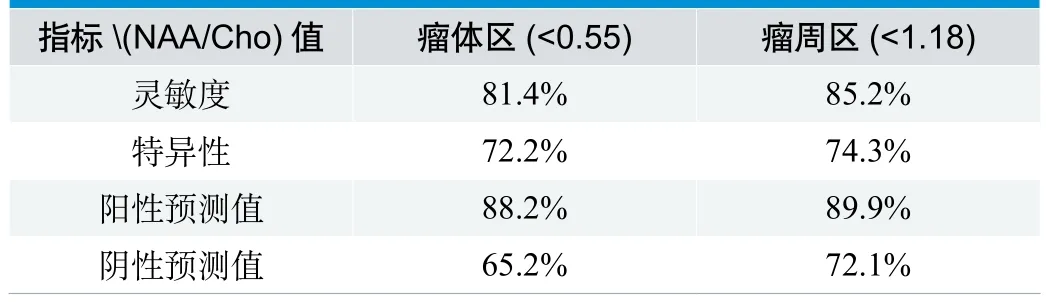
表3 MRS (NAA/Cho)区分高低级胶质瘤的阈值设定
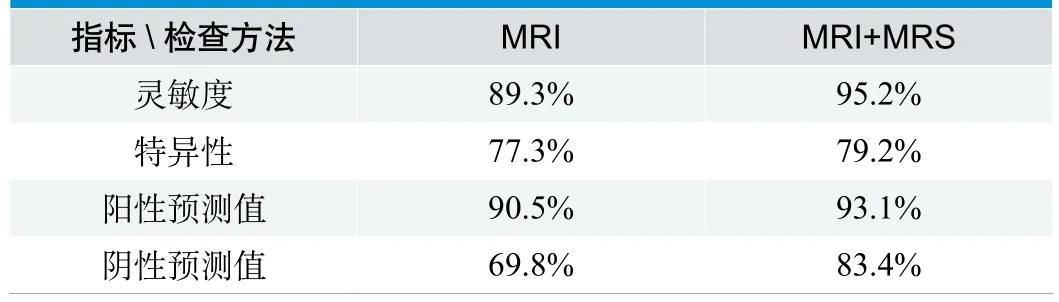
表4 不同磁共振方法区分高低级胶质瘤的比较
3.讨论
3.1 胶质瘤的病理生理特点
胶质瘤分级及侵袭方式:胶质瘤具有不同于中枢神经系统其他肿瘤的生理机制,无论级别高低均无明显包膜,呈浸润性生长,主要有4 种方式:①瘤细胞单个或成簇状侵袭邻近脑组织;②沿血管、室管膜下基膜、软脑膜分布;③沿白质纤维侵袭; ④通过脑脊液远处波散。因此胶质瘤较其他中枢神经系统肿瘤的侵袭性更强,且随着级别的增高侵袭的范围增大,根据肿瘤细胞对周围脑组织的侵袭程度和范围来鉴别胶质瘤是有依据的[1]。
胶质瘤瘤周水肿产生的机制:脑胶质瘤瘤周水肿的发生机理十分复杂,一般认为其不单纯为血管源性水肿还包括细胞毒性水肿[2]。胶质瘤内肿瘤新生血管血脑屏障不完整,其程度与病理分级有关,低级别胶质瘤(I、II级)内血管内皮结合较紧密,血脑屏障良好,高级别胶质瘤(III、IV级)内血管内皮结合不良,同时瘤细胞恶性度越高,分泌的生物活性因子,如血管内皮生长因子、一氧化氮合酶等越多,水肿越严重。多数学者认为胶质瘤级别越高,水肿区相对越大,肿瘤细胞浸润越广泛[3]。本研究中在瘤周水肿区与对侧正常区NAA、Cho、NAA/Cho、NAA/Cr值均有差异(P<0.05),而且肿瘤级别越高,差异越明显,进一步说明了胶质瘤对周围组织的浸润程度随级别增高而增高。
3.2 胶质瘤的MRS表现
脑胶质瘤与对侧正常脑组织1H-MRS 不同,表现为NAA 显著下降,Cr 轻度下降,Cho显著升高。随着脑胶质瘤恶性度的升高,NAA呈下降趋势,Cho呈升高趋势,并出现异常增高的Lac峰,但Lac 峰出现于各级别脑胶质瘤中,其峰值无显著性差异,瘤体强化区与对侧正常区NAA、Cho、NAA/Cho、NAA/Cr值有差异(P<0.05),与文献报道基本一致[4]。NAA 主要存在于神经元内,是神经元的内标志物。正常波谱中,NAA 是最高峰,现已证实,肿瘤内NAA 浓度降低是由于神经元的缺失或正常神经元功能下降所致,常提示肿瘤侵犯神经元导致神经元减少或功能受损,被破坏和被肿瘤细胞代替所致[5]。本研究组中,高级别胶质瘤与低级别胶质瘤的NAA/Cho、NAA/Cr值有显著性差异(P<0.05),说明高级别胶质瘤神经元的破坏程度远远大于低级别胶质瘤。
脑胶质瘤1H-MRS 的NAA/Cho、NAA/Cr值下降,较对侧明显下降(P<0.05)。大多数实质性脑胶质瘤可出现胆碱含量的增高,反映了肿瘤组织内细胞膜转换和细胞增殖的增加。因此胆碱的增高可提示细胞的快速增殖,与肿瘤的增生活跃有关。Carpinelli 等[6]在离体脑肿瘤的1H-MRS研究发现,胶质母细胞瘤的NAA/Cho、NAA/Cr值明显高于星形细胞瘤。Cr 波峰是由总肌酸中的甲基组构成,主要由肌酸(Cr) 和磷酸肌酸(PCr)组成,是能量储存、利用的重要化合物。在脑内Cr和PCr的总量较恒定,可将Cr波峰作为参照物,得到其他波谱与Cr的相对比值,从而进行比较。与正常侧对比,瘤体强化区的Cr值变化不一,总体以Cr 值下降较轻为主。
3.3 MRS对瘤周区的鉴别
MRS比传统影像学检查能较早地探测到肿瘤的周围浸润情况,为手术或放、化疗方案的制定提供有价值的信息。常规MRI 扫描肿瘤周围区形态未发生改变,但组织学检查已有肿瘤细胞浸润到相对正常的周围脑组织。本研究发现,在平扫和增强MRI 显示的病灶外1~2 cm范围内,MRS表现为Cho升高、NAA降低,同时代谢图证实了肿瘤细胞对周围组织的浸润。Burt scher等[7]的研究也证实MRS 的这种能力,并提出这一表现有助于颅内非侵袭性病变的鉴别及指导立体定向活检。肿瘤周围区Cho的异常升高仅见于高度恶性脑胶质瘤,表明肿瘤组织向邻近正常脑组织的浸润生长,可作为高度恶性胶质瘤的1H-MRS特征性表现。根据以往的病理检查结果,本研究将肿瘤强化区周围直径在1.5cm范围内邻近的脑白质定为肿瘤周围区。Croteau等[8]的研究证实了肿瘤周围区的存在,并认为恶性脑胶质瘤并不是局限性肿瘤病变,常常可沿有髓轴突、小血管以及蛛网膜下腔在脑内种植播散。因此,肿瘤周围区高大的Cho峰的出现为高度恶性胶质瘤的特征性表现,提示肿瘤的侵袭性生长特性。MRS 的这种分辨能力可能对传统影像学的“病灶”概念提出挑战。但由于当前波谱的体素仍较大,因此要确定病灶周围浸润的确切范围尚有待于MRS分辨率的进一步提高[9]。
3.4 MRS对高、低级别胶质瘤的鉴别
本研究显示,不仅低、高级别脑胶质瘤和对侧正常脑组织的NAA、Cho 、NAA/Cr、NAA/Cho值存在显著性差异(P<0.05),而且低级别脑胶质瘤和高级别脑胶质瘤的NAA/Cr、NAA/Cho值亦存在显著性差异(P<0.05)。脑胶质瘤是起源于脑内的肿瘤,由异常增生的胶质类细胞组成,在生长过程中,肿瘤细胞浸润正常神经元,从而导致在MRS 图上NAA 明显降低,Cr 轻度下降,Cho 显著升高,因此NAA/Cr、NAA/Cho值下降,Cho/Cr值升高。由此利用NAA/Cr、NAA/Cho值可以区分正常脑组织、低和高级别脑胶质瘤,与其他文献报道大致相同[10-11]。Poptani等[11]认为高级别脑胶质瘤较低级别脑胶质瘤的NAA/Cho、NAA/Cr值明显降低,而Cho/Cr变化不明显,且Lip 波出现提示为恶性脑胶质瘤。Tamiya等[10]报道Cho/Cr值升高是由于恶性脑胶质瘤中肿瘤细胞分裂增殖活动失控,细胞膜转换的增强导致Cho峰升高。Tedeschi等[12]发现在随访的脑胶质瘤患者中,病情进展病例的Cho升高率>45%,而病情稳定病例Cho升高率<35%,无一例Cho无改变或下降。笔者认为,Cr轻度下降也是导致Cho/Cr升高的原因。
Cho在绝大多数脑胶质瘤中是增加的,但在各组间Cho/Cr值较NAA/Cr值的差别要小,低、高级别脑胶质瘤的NAA/Cr、NAA/Cho值存在显著性差异(P<0.05)。Cho是细胞膜磷脂代谢的中间产物,是髓鞘形成、细胞代谢和胶质增生的指标,其浓度升高反映肿瘤细胞膜的转换增强[13]。
笔者还观察到,低、高级别脑胶质瘤中均可见到异常增高的Lac峰,且峰值无显著差异。因此,Lac峰的存在不能反映肿瘤的良、恶性,但其峰值的增高可反映肿瘤的缺氧程度。Tarnawski 等[14]研究51 例III、IV级脑胶质瘤的预后与MRS 的关系,发现Lac/NAA值> 2时,患者1年生存率为20 % ,而Lac/ NAA值< 2 时,患者1年生存率为85 %,二者的显著差异提示MRS 可评价脑胶质瘤的预后。Lip 峰也有助于辨别低、高级别脑胶质瘤。Negendank 等[15]报道在41%的高级别脑胶质瘤中可见Lip 峰,低级别脑胶质瘤中出现的概率仅为16% ,且Lip 峰值有显著差异。良性肿瘤中的Lip 类型和恶性脑胶质瘤不同,如多形性胶质母细胞瘤采用短TE的MRS 序列检查时,在1.3ppm处可检测到明显的Lip信号,而用同样的序列就不能发现纤维型星形细胞瘤的中性Lip信号,这就提示结合长TR和短TE的MRS序列能评估Lip大分子的代谢比率,有助于鉴别良、恶性脑胶质瘤。Poptani 等[11]认为将NAA/Cho、NAA/Cr值和Lip峰同时运用于脑胶质瘤的分级诊断是非常可靠的方法。
与正常脑组织侧对比,肿瘤区的Cr值一般下降较轻。在正常脑1H-MRS中,Cr紧连Cho右侧,是第三高的波峰,Cr波峰值非常稳定,常用来作对照值,本研究亦采用此方法。由于肿瘤组织中NAA下降,Cho升高,因此NAA/Cho值能反映肿瘤区的化合物含量的变化。随着肿瘤恶性度的升高,NAA/Cho值更加降低,本组低、高级别脑胶质瘤的NAA/Cho值存在显著性差异(P<0.05)。NAA/Cho值在低级别脑胶质瘤组与高级别脑胶质瘤组重叠部分最小,说明NAA/Cho值在分级诊断中最敏感。
由于NAA/Cho在高、低级胶质瘤的瘤体及瘤周区差异均有显著性意义,因此,在MRS中依据NAA/Cho寻求阈值区分高、低级胶质瘤,发现瘤体强化区的NAA/Cho<0.55为阈值,瘤周水肿区的NAA/Cho<1.18为阈值来鉴别高、低级别胶质瘤具有很高的灵敏度和特异性。
4.结论
根据不同磁共振方法对高低级胶质瘤进行鉴别,MRI联合MRS比单独采用MRI的各项指标要高。MRS对高、低级胶质瘤的鉴别具有较高的临床价值,MRI联合MRS可以更有效地鉴别高低级胶质瘤,帮助临床早期正确地诊断,指导临床制订有效的治疗计划,延长患者的生存时间,改善患者的预后。
[1]Lin CL ,Lieu AS ,Lee KS ,et al. The Conditional Probabilities of Survival in Patients with Anaplastic Ast rocytoma or Glioblastoma Multiforme[J]. Surg Neurol ,2003 ,60 (5):402-406.
[2]王志群,李坤成,王亮,等. 磁共振波谱对脑肿瘤的鉴别诊断价值[J].放射学实践,2007,22 (2):132-135.
[3]Vigneron D, Bollen A, McDermott M , et al. Three-dimensional Magnetic Resonance Spectroscopic Imaging of Histologically Conf i rmed Brain Tumors[J]. Magn Reson Imaging ,2001 ,19 (2): 89-101.
[4]鱼博浪,王斐,郭世萍,等.1H-MRS 在星形细胞肿瘤诊断中的应用[J].实用放射学杂志,2005,21(6):572-575.
[5]Lara A, Brandao ,Romeu C, Dominggues.刘筠译. MR Spectroscopy of the Brain[M].天津:天津科技翻译出版公司,2005:61
[6]Carpinelli G,Carapella CM, Palombi L, et al. Differentiation of glioblastoma multiforme from astrocytomas by in vivo 1H-MRS analysis of human brain tumors [J].Anticancer Re ,1996,16(3):1559-1563.
[7]Burt seher IM, Skagerberg G, Geljer B ,et a1. Proton MR spectroscopy and preoperative diagnostic accuracy: an evaluation of intracranial mass lesions aracterized by stereotactic biopsy f i ndings [J].AJNR,2000,21(1):84-93.
[8]Croteau D, Searpace L, Hearshen D,et a1.Correlation between magnetic resonance spectroscopy imaging and image guided biopsies: semiquantitative and qualitative histopathological analyses of patients with untreated glioma [J].Neurosurgery,2001, 49(4):823.
[9]龚才桂,王小宜,刘慧,等. 1H-MRS 对低级别和高级别脑胶质瘤鉴别诊断的作用及病理相关性研究[J].临床放射学杂志,2006,25 (6):502-506.
[10]Tamiya T, Kinoshita K, Ono Y, et al. Proton magnetic resonance spectroscopy reflect cellular proliferative activity in astrocytomas[J]. Neuroradiology , 2000, 42:333
[11]Poptani H, Gupta RK, Roy R, et al. Characterization of intracranial mass lesions with in vivo proton MR spectroscopy.[J]AJNR AmJ Neuroradiol, 1995,16:1593.
[12]Tedeschi G, Lundbom N , Raman R ,et al. Increased choline singal coinciding with malignant degeneration of cerebral gliomas: a serial Proton magnetic resonance spectroscopy imaging study[J]. Neurosurgery, 1997,87:516.
[13]Nelson SJ , Nat DR. Imaging of brain tumors after therapy[J]. Neuroimaging Clinic N Am, 1999, 9: 80.
[14]Tarnawski R, Sokol M, Pieniazek P, et al.1H-MRS in vivo predicts the early treatment outcome of postoperative radiotherapy for malignant gliomas[J]. Int J Radiat Oncol Biol Phys , 2002, 52:127.
[15]Negendank W, Sauter R. Proton magnetic resonance spectroscopy in patients with glial tumors: a multicenter study[J].Neurosurg, 1996, 84:449.

