两亲性壳聚糖包覆紫杉醇脂质体的制备及体外释放研究
刁雨辉1,霍美蓉2,吕 霖2,周建平2*
1南京市鼓楼医院,南京 210009;2中国药科大学药剂教研室,南京 210009
紫杉醇(Paclitaxel,PTX)是从红豆杉科红豆属(Taxus)植物的树皮中提取得到的一种四环二萜类化合物,对卵巢癌、乳腺癌、头颈部癌、非小细胞性肺癌及前列腺癌疗效显著[1]。由于紫杉醇在水中溶解度极低(<1 μg·mL-1),口服几乎不吸收,目前临床用制剂,如Taxol誖(美国Bristol Myers Squibb公司)、Anzatax誖(澳大利亚Faulding公司)以及国产的紫素誖、泰素誖等,均以聚氧乙烯蓖麻油-无水乙醇(50∶50,v/v)作为紫杉醇复合溶媒,临用前生理盐水或5%葡萄糖注射液稀释至0.3~1.2 g·L-1静脉注射。该制剂存在诸多缺陷,如药物由于溶剂转换析出、处方中的Cremophor EL引起严重过敏反应及对组织毒性等[2]。因此,研究不含Cremophor EL并能提高紫杉醇生物利用度的其它液体制剂成为当前的热点[3-4]。脂质体作为一种新型纳米药物转运系统,能改变其体内的药代动力学行为,降低不良反应和提高疗效,已被用于抗肿瘤药物制剂的开发[5]。但由于脂质体混悬液在贮存期间易发生聚集、融合、药物渗漏及天然磷脂易氧化、水解问题,难以满足药物制剂稳定性的要求。因此,本课题组尝试将前体脂质体技术和高分子材料包覆修饰技术相结合以解决这一难题。
壳聚糖(Chitosan)是甲壳质(Chitin)脱乙酰基的产物,作为自然界唯一大量存在的高分子碱性氨基多糖,与合成高分子材料相比,其具有来源广泛、价格低廉、性质稳定、无刺激、无致敏、无致突变、良好的生物相容性和生物可降解性、低免疫原性和生物活性等优点[6]。壳聚糖分子链上带有大量活性氨基和羟基,易于化学修饰。近年来,国内外已有将壳聚糖通过电荷吸附于脂质体表面作为包衣材料的报道[7-9]。本文设计开发一类新型的两亲性壳聚糖衍生物 N-辛基-N,O-羧甲基壳聚糖(N-octyl-N,O-carboxymethyl chitosan,OCC)包覆修饰脂质体,其中,疏水烷基链通过疏水作用可插入脂质体的磷脂双分子层,增加了多糖包覆修饰的稳定性;而羧甲基壳聚糖亲水链则游离于脂质体表面可显著增加脂质体的亲水性,并可减少药物的泄露。本文将系统评价OCC包覆修饰紫杉醇脂质体的理化性质及体外释药行为。
1 仪器与试剂
1.1 仪器
Shimadzu LC-2010C高效液相色谱仪(日本岛津公司);Nano-ZS90粒径仪、Nano-ZS90粒径仪(英国Malvern公司);Hitachi JEM-2100透射电子显微镜(日本);Netzsch DSC 204差热扫描分析仪(德国耐驰仪器制造有限公司);ZRS-8G智能溶出仪(天津大学仪器厂);电子天平(德国Sartorius电子分析天平有限公司,分度值0.01 mg)。1.2 药品与试剂
PTX(重庆美联制药有限公司);大豆磷脂(注射级,上海太伟制药);N-辛基-N,O-羧甲基壳聚糖(OCC,本实验室合成,壳聚糖分子量20 kDa,脱乙酰度90%,辛基取代度10.3%,羧甲基取代度121.6%);透析袋(MWCO 3500,上海绿鸟科技发展有限公司);5%葡萄糖注射液(Glu,中国大冢制药有限公司);甲醇(色谱纯,江苏汉邦科技有限公司);无水乙醇(国药集团化学试剂有限公司);人血浆(南京紫竹林血站提供)。
2 方法与结果
2.1 紫杉醇脂质体的制备
紫杉醇前体脂质体按照本课题组授权专利制备[10]。将紫杉醇、磷脂、聚乙二醇修饰剂按照一定比例溶解于乙醇,即得紫杉醇前体脂质体溶液。临用前,将适量紫杉醇前体脂质体溶液缓慢滴入5%葡萄糖溶液中振摇3 min,即得紫杉醇脂质体混悬液PTX-LP。
2.2 OCC包覆紫杉醇脂质体的制备
将适量紫杉醇前体脂质体溶液缓慢滴入不同浓度(0.1%、0.2%和0.5%)的OCC 5%葡萄糖溶液,振摇10 min,使OCC充分包裹脂质体,制得多糖包覆脂质体混悬液PTX-LP-OCC。
2.3 HPLC分析[11]
采用RP-HPLC法测定紫杉醇含量。色谱条件∶色谱柱为 Lichrospher C18(416 mm ×250 mm,5 μm);流动相为甲醇-水(75∶25);流速为 1 mL·min-1;柱温为30℃;检测波长为227 nm。
2.4 包封率、粒径及表面电荷的测定
由于紫杉醇在水介质中溶解度非常低,因此水介质中的游离药物和载入脂质体中的药物量相比可以忽略不计。本文采用以下方法测定PTX包封率:PTX-LP和PTX-LP-OCC混悬液以0.8 μm滤膜过滤,取续滤液 50 μL,甲醇稀释定容,按“2.3”项下HPLC方法测定续滤液中药物含量。包封率按下列公式计算:

分别取PTX-LP和PTX-LP-OCC脂质体混悬液适量,以动态光散射法(Dynamic Light Scattering,DLS)测定粒径大小、分布及Zeta电位。
PTX-LP和PTX-LP-OCC包封率、粒径及Zeta电位结果如表1所示。脂质体对紫杉醇具有优越的包封效果,包封率达到89.5%,粒径为236.5 nm;不同量OCC包裹脂质体后,紫杉醇包封率没有明显的变化(P>0.05),但是粒径及表面电荷随着OCC修饰量的增加显著增加。当修饰量达到0.5%时,脂质体放置一段时间即有明显药物沉淀,可能是由于过多烷基链插入脂质双层而造成脂质体的不稳定,因此,后续研究皆以0.2%为修饰量。
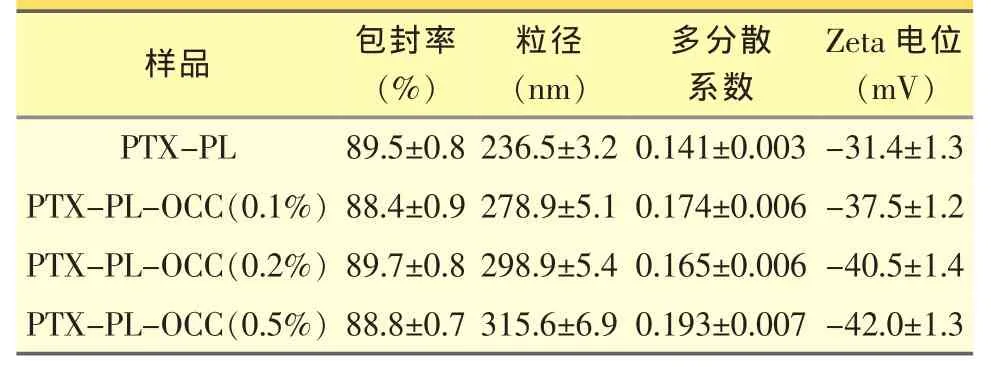
表1 PTX-LP及PTX-LP-OCC理化性质(n=3)
2.5 形态学观察
分别取 PTX-LP和 PTX-LP-OCC(0.2%)脂质体混悬液适量,滴到专用铜网上,用滤纸小片吸去残余液体,干燥后用日立JEM-2100透射电镜观察形态,如图1所示。PTX-LP及PTX-LP-OCC(0.2%)皆呈规整球形,粒径分布均匀,与PTX-LP相比,PTX-LP-OCC的粒径明显增大,并可观察到OCC包覆在紫杉醇脂质体的外层,该结果进一步证实OCC已成功包覆修饰于脂质体表面。
2.6 差示扫描热分析(differential scanning calorimetry,DSC)

图 1 PTX-LP(A)及 PTX-LP-OCC(B)透射电镜图谱
取紫杉醇原料、空白脂质体冻干粉、PTX与空白自组装脂质体冻干粉的物理混合物、PTX-LP冻干粉、OCC以及PTX-LP-OCC冻干粉适量,以10℃·min-1的升温速率加热,温度范围50~350℃,氮气氛进行DSC分析,结果如图2所示。紫杉醇熔点在218℃(图2a),空白脂质体熔点在 102.4℃(图 2b),两者混合物同时具有两者特征峰(图2c),而含药的脂质体不含药物信号峰(图2d),表明药物可能以无定形或者固态溶液的形式完全被包裹在脂质双分子层之间。PTX-LP-OCC在163.9℃出现OCC的吸热峰(图3e,f),而在200~240℃之间未见药物吸热峰,表明OCC修饰不会引起药物从脂质体中泄露,而磷脂吸热峰从100℃左右降至51.1℃,这可能由于OCC与脂质体的磷脂双分子层发生了较强的相互作用所致。

图2 紫杉醇原料(a)、空白脂质体冻干粉(b)、紫杉醇原料和空白脂质体冻干粉物理混合物(c)、PTX-LP冻干粉(d)、OCC(e)及PTX-LP-OCC冻干粉(f)差示扫描热分析图谱
2.7 稳定性考察
2.7.1 稀释稳定性 取适量的紫杉醇前体脂质体溶液分别注入5%Glu和0.2%OCC中形成PTXLP 及 PTX-LP-OCC(0.2%),药物终浓度为 0.7 mg·mL-1,于 0、1、2、4、6、8 h 测定粒径大小,以不同时间点的粒径大小及脂质体中药物含量变化对时间作图,评价两制剂的稀释稳定性,结果如图3所示。在考察时间内,PTX-LP及 PTX-LP-OCC(0.2%)粒径及药物含量都没有明显变化。
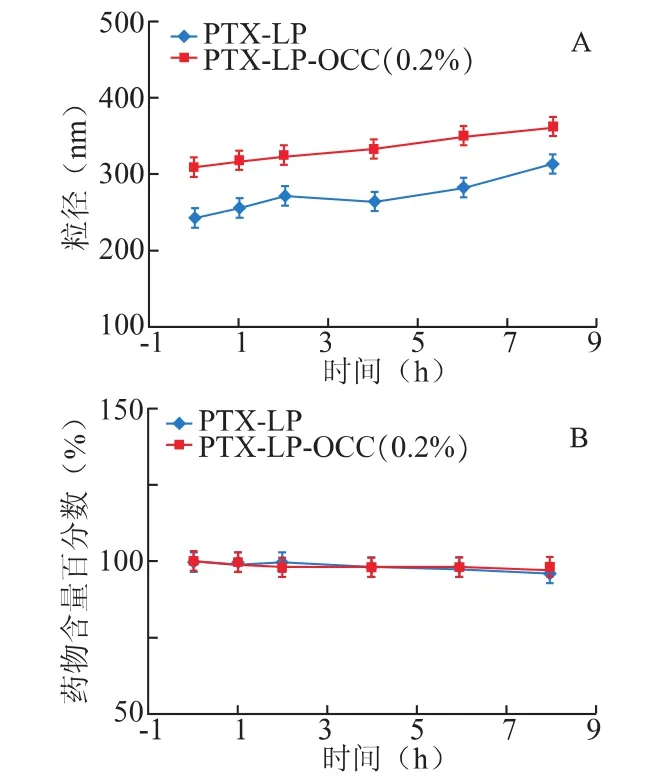
图3PTX-LP及PTX-LP-OCC稀释稳定性
2.7.2 血浆中稳定性 取适量的紫杉醇前体脂质体溶液分别注入5%Glu和0.2%OCC中形成PTX-LP及 PTX-LP-OCC(0.2%),取 0.5 mL与等体积人血浆混合后于37℃孵育,不同时间点离心(3000 r·min-1,5 min),取上清液 50 μL 用甲醇定容,10000 r·min-1离心10 min,测得药量为Mt,另取0时间点上述样品,按同法操作测得药量为M0,以(M0-Mt)与M0的比值评价血浆中的稳定性,结果如图4所示。PTX-LP-OCC(0.2%)在血浆中具有更好的稳定性,药物泄露速度明显缓于PTX-LP,PTXLP在24 h及48 h药物泄露了57.2%及60.2%,而PTX-LP-OCC药物仅泄露了36.5%及44.2%。
2.8 体外释药动力学
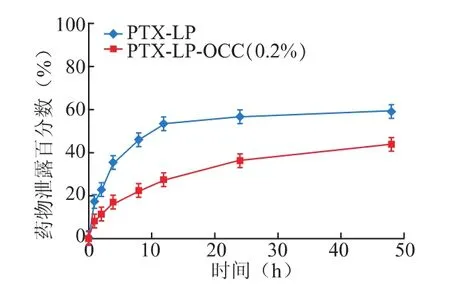
图4 PTX-LP及PTX-LP-OCC血浆中稳定性(n=3)
采用全体液平衡反向透析法考察PTX-LP及PTX-LP-OCC(0.2%)的体外释放动力学[12-13]。具体方法为:将0.2 mL紫杉醇前体脂质体溶液分别用5%1 mL Glu和0.2%OCC 1 mL稀释,分别取1 mL上述脂质体溶液加入400 mL溶出介质中(pH 7.4磷酸盐缓冲液),将透析袋内置2 mL溶出介质(透析袋提前在释放介质中饱和12 h),并固定于搅拌桨上,37℃水浴搅拌。取0 h透析袋外溶出介质溶液 1 mL,甲醇定容至 5 mL,10000 r·min-1离心 10 min后,取上清液进HPLC色谱仪,所得峰面积记为A0。在 2、3、4、6、8、12、24 h 分别取透析袋内溶液0.1 mL,同时补充0.1 mL溶出介质。将样品溶液与0.4 mL甲醇混合后 10000 r·min-1离心 10 min,取上清液进HPLC色谱仪,色谱条件如“2.3”项所述。所得峰面积记为An,各时间点的释放度通过An/A0×100%计算,每个样品平行操作6份,以释放度的平均值对时间绘制释放度曲线,结果如图5所示。PTX-LP-OCC(0.2%)比PTX-LP具有更为缓慢的释放速度,PTX-LP 4 h及 24 h分别释放 78.2%及97.2%,而 PTX-LP-OCC(0.2%)4 h及 24 h分别释放19.4%及79.3%。
3 讨 论

图5 PTX-LP及PTX-LP-OCC体外累计释放曲线(n=6)
3.1 本文成功制备了两亲性壳聚糖衍生物OCC包覆修饰紫杉醇脂质体。紫杉醇脂质体系采用前体脂质体技术制备,即将PTX、磷脂、聚乙二醇修饰剂按照一定比例溶解于乙醇,临用前以5%Glu溶液复溶,可实现脂质体对紫杉醇的良好包载(包封率接近90%),DSC结果证实药物以无定形形式存在于脂质体内部。将多糖衍生物OCC溶于5%葡萄糖,配成不同浓度溶液复溶前体脂质体,即可制得多糖包覆修饰的脂质体,结果表明OCC对脂质体包覆修饰对药物的包封并无显著影响(P>0.05),但粒径和表面负电荷显著增加(P<0.05),说明带负电荷的羧甲基壳聚糖成功覆盖于脂质体表面。透射电镜及DSC结果亦进一步证实了OCC和脂质体之间存在较强的相互作用,多糖已成功包覆修饰于脂质体外周。
3.2 OCC对脂质体的修饰系通过OCC疏水烷基链插入到脂质体脂质双层实现,然而疏水烷基链的插入有可能造成脂质双层不稳定性增加,从而导致载体不稳定或药物泄露。因此本文以PTX-LP为对照,考察了PTX-LP-OCC(0.2%)的稀释稳定性以及血浆中稳定性。鉴于PTX临床静脉滴注浓度为0.3~1.1 mg·mL-1,滴注时间一般小于 8 h,因此,本文将无多糖修饰脂质体以及有多糖修饰脂质体分别稀释至0.7 mg·mL-1,并考察两者在8 h内稳定性。结果表明,两者粒径和含药量皆并无显著改变,说明OCC的包覆修饰并不影响脂质体的稀释稳定性,且在静脉滴注时间内保持稳定。将两种脂质体和血浆孵育,PTX-LP-OCC(0.2%)在血浆中药物泄露速度明显缓于PTX-LP,表明 PTX-LP-OCC(0.2%)在体内更稳定,这可能是由于两亲性多糖衍生物包覆脂质体而起到良好的保护作用,从而减少了药物在血浆中的泄露。
3.3 纳米溶液的体外释放实验常采用正相透析法。由于纳米载体装于透析袋中难以与释放介质充分接触,与静脉给药的临床方式存在一定差异,因此本文以PTX-LP为对照,采用全体液平衡反向透析法评价了PTX-LP-OCC(0.2%)的体外释放行为,更好的模拟了生理环境,所得的释放动力学参数更接近体内的真实情况。从图5可看出,PTX-LP在释放初期存在明显的突释现象,4 h药物释放量即高达78.2%,其药物突释可能是由于脂溶性的药物主要存在于脂质体的脂质双层间,而脂质双分子层具有流动性,从而造成药物的快速释放,过高的突释效应为安全用药带来了隐患;而PTX-LP-OCC突释现象显著改善,前4 h释放量仅为19.4%,释放也更为缓慢,24 h仅释放79.3%,这可能一方面由于有多糖对脂质体的包覆修饰,对脂质体有一定的保护作用,另一方面增加了药物从脂质体扩散释放出来的难度。PTX-LP-OCC更加平缓的释药曲线有助于提高用药的安全性和维持有效血药浓度时间。
[1]Yoncheva K,Calleja P,Agüeros M,et al.Stabilized micelles as delivery vehicles for paclitaxel[J].Int J Pharm,2012,436(1-2)∶258-64.
[2]Pham AQ,Berz D,Karwan P,et al.Cremophor-induced lupus erythematosus-like reaction with taxol administration∶a case report and review of the literature[J].Case Rep Oncol,2011,4(3)∶526-30.
[3]雷景邦,刘旭海,万瑾瑾,等.注射用紫杉醇纳米制剂的研究进展[J].中国新药与临床杂志,2010,6:406-9.
[4]净晓龙,陈建明.紫杉醇给药系统的研究进展[J].中国新药与临床杂志,2011,9,650-7.
[5]Kumar P,Gulbake A,Jain SK.Liposomes a vesicular nanocarrier∶ potential advancements in cancer chemotherapy [J].CritRevTherDrug CarrierSyst,2012,29(5)∶355-419.
[6]Bernkop-Schnürch A,Dünnhaupt S.Chitosan-based drug delivery systems[J].Eur J Pharm Biopharm,2012,81(3)∶463-9.
[7]陈新梅.壳聚糖包覆的人参皂苷Rg3脂质体的制备及质量评价[J]. 中国现代药物应用,2011,3(1):4-5.
[8]Kowapradit J,Apirakaramwong A,Ngawhirunpat T,et al.Methylated N-(4-N,N-dimethylaminobenzyl)chitosan coated liposomes for oral protein drug delivery[J].Eur J Pharm Sci,2012,47(2)∶359-66.
[9]Goncalves MC,Mertins O,Pohlmann AR,et al.Guterres SS. Chitosan coated liposomes as an innovative nanocarrier for drugs[J].J Biomed Nanotechnol,2012,8(2)∶240-50.
[10]周建平,仝新勇,谭 燕,等.一种紫杉醇自组装前体脂质体及其制备方法 [P].中国专利授权号CN 100563715C.
[11]霍美蓉,周建平,魏 彦,等.紫杉醇壳聚糖聚合物胶束的制备及表面电荷对其在小鼠体内组织分布的影响[J]. 药学学报,2006,41(9):867-72.
[12]张 洪,成 蓓.大黄素固体脂质纳米粒的制备及理化性质研究[J]. 中国药师,2010,3:326-9.
[13]田大丰,李 英,俞红凯,等.辛伐他汀自乳化胶囊的体内外评价[J].中国新药杂志,2007,20:1698-701.

