Toll样受体4参与介导黄曲霉毒素G1对大鼠肺泡Ⅱ型上皮细胞的致损伤作用
杨 红,陈成水
Toll样受体4参与介导黄曲霉毒素G1对大鼠肺泡Ⅱ型上皮细胞的致损伤作用
杨 红,陈成水
目的 在基因水平上探讨Toll样受体4(TLR4)参与介导黄曲霉毒素G1(AFG1)对肺泡Ⅱ型上皮细胞的致损伤生物学效应,及其作用机制和途径。方法 分离、纯化、培养大鼠肺泡Ⅱ型上皮细胞并配置3个不同浓度的AFG1液体。实验随机分为正常组、实验组、溶剂对照组,每组6个样本。正常组加入同等量的无菌生理盐水;实验组加入不同浓度的AFG1液(高、中、低浓度分组),溶剂对照组加入同等量的二甲基亚砜(DMSO),终浓度为0.4 ml/ L;同时处理24 h后在上述5组提取细胞mRNA,采用RT-PCR法检测各组TLR4 mRNA、NF-κBmRNA、TNF-αmRNA和IL-6mRNA的表达水平。结果 正常组肺泡Ⅱ型上皮细胞上TLR4 mRNA、NF-κBmRNA、TNF-αmRNA和IL-6mRNA的表达量较低。实验组经AFG1液作用后,各项指标的表达量显著高于正常组(P<0.05)和溶剂对照组(P<0.05),且呈浓度依赖性增高。溶剂对照组各项指标的表达量与正常对照组相比,无显著性差异(P>0.05)。结论TLR4→NF-κB→炎症介质信号转导通路参与AFG1对AT-Ⅱcells的损伤作用。
肺泡Ⅱ型上皮细胞;肺损伤;黄曲霉毒素G1;Toll样受体4;核因子(NF)-κB
已有研究在整体水平和细胞水平上证实了黄曲霉毒素G1(AFG1)对大鼠肺组织和肺泡Ⅱ型上皮细胞(AT-IIcells)结构和功能的急性影响和损伤的生物学效应[1]。通过RT-PCR技术分离培养的AT-Ⅱcells有TLR4mRNA的表达,受外源性刺激后表达增强,且呈一定的浓度依赖性[2]。所以,AT-Ⅱcells是AFG1作用于肺组织的靶细胞,AT-Ⅱcells上有TLR4的表达。那么,AFG1诱导AT-Ⅱcells损伤的调控机制中是否存在TLR4介导的信号通路的存在,关于TLR4信号转导通路是否参与AFG1致AT-IIcells损伤生物学效应的研究,尚未见报道。所以,基于以上基础,笔者等在实验中设想将原代培养的大鼠AT-IIcells作为研究对象,通过不同浓度AFG1对AT-IIcells的刺激,探讨TLR4信号转导通路是否参与AFG1致AT-IIcells损伤生物学效应过程及其具体的途径。
1 材料和方法
1.1 动物模型及分组 清洁级(SPF)雄性大鼠,体重200~250 g/只,由温州医学院实验动物中心提供。1 mg固体装AFG1,Fermentek ltd由北京锐鑫农科贸有限公司提供。将大鼠随机分为正常组(A组):AT-Ⅱ cells中加入同AFG1液等体积量的无菌生理盐水。实验组(B组):据AFG1液作用浓度不同,分别为B1组(浓度为0.5 mg/L)、B2组(浓度为1.0 mg/L)和B3组(浓度为2.0 mg/L)。溶剂对照组(C组):AT-Ⅱ cells中加入同AFG1液等体积量溶剂二甲基亚砜(DMSO)。每组6个样本。
1.2 主要试剂与仪器 DMEM培养液、小牛血清、琼脂糖购自上海生物工程有限公司,胰酶、兔抗大鼠IgG、DNA酶、DMSO购自上海博蕴生物科技有限公司,Trizol试剂购自大连宝生物工程有限公司,DEPC水购自江苏碧云天生物技术研究所,逆转录试剂盒、PCR反应试剂盒购自大连宝生物工程有限公司。梯度PCR扩增仪购自德国Thermo Hybaid公司,台式超速冷冻离心机购自美国Beckman公司,水平电泳仪购自北京六一电泳厂,凝胶成像分析系统购自上海山富科学仪器有限公司,涡旋振荡器购自江苏海门市麒麟医用仪器厂,电子天平购自梅特勒-托利多仪器有限公司,制冰机购自宁波格兰特制冷设备厂,紫光分光光度计购自美国Beckman公司。
1.3 方法
1.3.1 大鼠AT-Ⅱcells的提取 参照文献[3]的方法,大鼠麻醉后取肺,并将肺组织置于含DNA酶液约3.5 ml的玻璃培养皿中,5 min中内将其剪碎,再加入3 ml培养基终止后倒入离心管,用有钙镁缓冲液补足20 ml,于37℃水浴中快速晃动8 min,再用100、200目大小筛网过滤2次,过滤液分装于2支15 ml离心管中,1000 r/min离心8 min,弃上清,沉淀加入3~5倍体积的红细胞裂解液,轻轻吹打混匀2 min,再加入3 mlPBS后1000 r/min离心8 min,弃红色上清,再加入PBS液吹打后1000 r/min离心8 min,弃去上清。收集沉淀细胞用2 ml DMEM+培养基悬浮,以备纯度鉴定和细胞计数。通过纯度、活力鉴定[碱性磷酸酶(AKP)染色[4]、电镜方法鉴定[5]及超微结构观察]细胞,并计数后用20%DMEM完全培养基悬浮细胞、调节细胞浓度为(1~2)×109/L,接种于培养瓶和细胞培养板中,标记细胞名称、日期等,放入37℃恒温培养箱中培养。培养24 h后更换为10%DMEM培养基,继续培养12 h给予不同浓度的AFG1处理。
1.3.2 AFG1不同浓度的配置及分组 AFG1常用DMSO作为溶剂来溶解,并且配置完成后其终浓度为0.4 ml/L[6]。本实验购买的是1 mg固体装AFG1,故用0.2 mlDMSO来溶解,得到5 g/L用DMSO溶解的AFG1。分别取不等量浓度为5 g/L的AFG1液,加入到不同量的培养基中换算配置出2.0、1.0、0.5 mg/L的AFG1液。实验组分别加入AFG1 0.5、1.0和2.0 mg/L(DMSO终浓度为0.4 ml/L),溶剂对照组和正常组分别加入DMSO 0.4 ml/L和生理盐水。24 h后收集细胞用于实验相关指标的检测。
1.3.3 各组有关指标的检测 本实验测定的指标是正常组、实验组和溶剂对照组AT-II cells的TLR 4mRNA、NF-κBmRNA、TNF-αmRNA、IL-6mRNA的表达及其表达水平的变化。采用RT-PCR法检测,即采用Trizol试剂提取各组肺泡Ⅱ型上皮细胞的总RNA,紫外分光光度计测定RNA的浓度,以总RNA为模板,逆转录成cDNA,然后以cDNA为模板,以待测定的各指标引物进行PCR扩增反应。扩增产物进行琼脂糖凝胶电泳,电泳结果用凝胶成像系统成像,用Quantity One分析软件进行凝胶扫描分析,以目的基因/β-actin为该基因表达的相对值。检测各组TLR4 mRNA、NF-κBmRNA、TNF-αmRNA和IL-6mRNA的表达水平及其变化。
2 结 果
正常组AT-Ⅱ cells上TLR4 mRNA、NF-κBmRNA、TNF-αmRNA和IL-6mRNA的表达量较低;实验组经AFG1液作用后,各项指标的表达量显著高于正常组(P<0.05)和溶剂对照组(P<0.05),且呈浓度依赖性增高。溶剂对照组各项指标的表达量与正常对照组相比,无明显差异(P>0.05)。各组大鼠AT-Ⅱ cells的TLR4mRNA、NF-κBmRNA、TNF-αmRNA和IL-6mRNA的表达量见表1;各组大鼠AT-Ⅱcells的 TLR4mRNA、NF-κBmRNA、TNF-αmRNA和IL-6mRNA表达的电泳图,见图1~4。
表1 各组大鼠肺泡Ⅱ型上皮细胞TLR4、NF-κBmRNA、TNF-α mRNA、IL-6mRNA表达结果(±s)
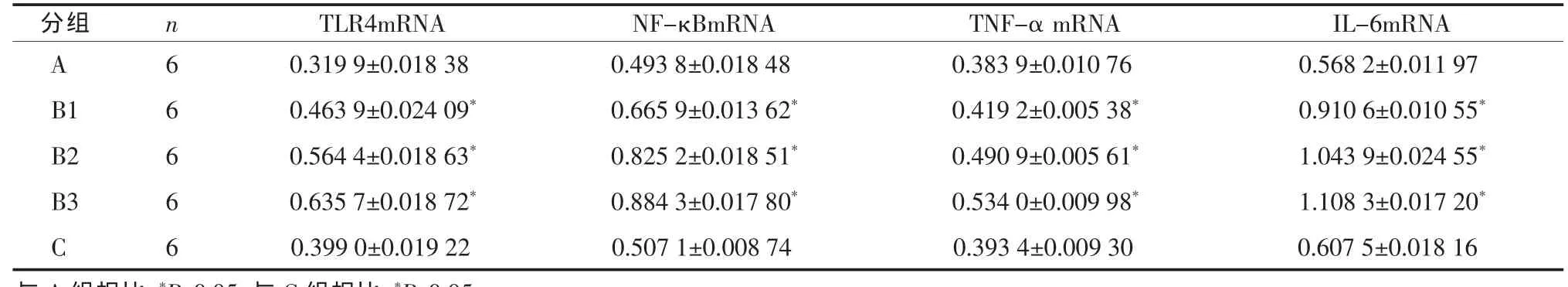
表1 各组大鼠肺泡Ⅱ型上皮细胞TLR4、NF-κBmRNA、TNF-α mRNA、IL-6mRNA表达结果(±s)
与A组相比,P<0.05;与C组相比,P<0.05
TLR4mRNA NF-κBmRNA TNF-α mRNA IL-6mRNA 0.319 9±0.018 38 0.493 8±0.018 48 0.383 9±0.010 76 0.568 2±0.011 97 0.463 9±0.024 09*0.665 9±0.013 62*0.419 2±0.005 38*0.910 6±0.010 55*0.564 4±0.018 63*0.825 2±0.018 51*0.490 9±0.005 61*1.043 9±0.024 55*0.635 7±0.018 72*0.884 3±0.017 80*0.534 0±0.009 98*1.108 3±0.017 20*0.399 0±0.019 22 0.507 1±0.008 74 0.393 4±0.009 30 0.607 5±0.018 16**分组 n A6 B1 6 B2 6 B3 6 C6

图1 TLR4mRNA电泳图
图2 NF-κBmRNA电泳图

图3 TNF-α mRNA电泳图
图4 IL-6mRNA电泳图
3 讨 论
AFG1是生长在食物及饲料中的黄曲霉和寄生曲霉代谢的一组化学结构类似的产物,可大量溶解于氯仿、甲醇、二甲基亚砜等中等极性的有机溶剂中,易被碱或强氧化剂破坏[7]。研究已证实AFG1对肺组织和细胞具有明显的致损伤作用,AFG1作用于AT-Ⅱ cells,引起AT-Ⅱ cells结构和功能改变,说明AFG1直接作用对肺组织及AT-Ⅱ cells具有明显的毒性[8]。但有关于霉菌毒素致AT-Ⅱcells损伤的细胞和分子学机制等还不十分清楚。
TLRs被认为是目前哺乳动物唯一将细胞外抗原识别信息向细胞内传递并引发炎症反应的关键跨膜蛋白,该受体族作为机体炎性反应链的启动蛋白。其中发现最早和功能相对比较清楚的是TLR4,它是TLR家族的重要成员,可以和许多内源性及外源性配体结合,通过一系列的跨膜信号传导通路,发挥防御和免疫调节作用。自1998年Poltorak等[9]发现了TLR4以来,其作为炎症跨膜受体在感染性疾病研究领域中已是热点,TLR4信号转导通路是TLRs中的一条重要通路,与细胞凋亡、炎症密切相关。激活TLR4信号转导通路可能介导霉菌毒素作用于不同的靶细胞而引起的细胞毒性作用。所以探讨TLR4信号转导通路在AFG1处理AT-Ⅱ cells中的激活情况,以及在致细胞毒性中的作用,可以进一步认识AFG1致肺损伤生物学效应及其分子机制。基于以上理论基础和之前的设想,本实验给予不同浓度的AFG1作用于原代培养的大鼠AT-Ⅱ cells,通过测定各组细胞TLR4的表达量及表达水平的变化,以证实TLR4介导了AFG1致损伤的炎症反应过程,并探讨此炎症反应过程的信号传导通路。根据实验结果,实验组TLR4mRNA的表达水平较正常组和溶剂对照组明显升高(P<0.05),且呈浓度依赖性上升,说明AFG1作用于AT-Ⅱ cells可以激活TLR4。
NF-κB存在于肺内多种细胞,如中性粒细胞、巨噬细胞、单核细胞等。氧化损伤的AT-Ⅱcells内也有NF-κB表达,肺炎症中AT-Ⅱcells释放的许多炎症介质如IL-8、IL-6、GM-CSF和TGF-β等都受NF-κB活化调控,与肺部炎症密切相关[10]。本文结果显示,实验组经不同浓度AFG1作用于AT-Ⅱcells后,NF-κBmRNA较正常组和溶剂对照组明显升高(P<0.05),并呈浓度依赖性上升,提示在AFG1作用于AT-Ⅱ cells的过程中有NF-κBmRNA表达的增加。有研究发现,TLR4活化可激活NF-κB。本实验通过AFG1作用于AT-Ⅱcells后在基因水平上对TLR4mRNA和NF-κBmRNA的测定表明AFG1通过TLR4的介导,最终导致NF-κB的活化。同时证明,在肺泡Ⅱ型上皮细胞中,由NF-κB来调控的众多的炎症介质中,TNF-α和IL-6最具典型意义,也是最重要的2种[11]。TNF-α和IL-6是启动炎症反应的关键因子,因此本实验同时将这2种因子作为检测指标。结果发现,AFG1作用后,ATⅡcells的TNF-αmRNA和IL-6mRNA表达量明显升高,并且随着AFG1浓度的升高而其表达量逐渐增高。此结果表明,AFG1能够激活AT-Ⅱcells,并导致TNF-α和IL-6在基因水平上的明显增高。根据已知TLR4的胞内信号传导通路,结合以上实验结果笔者推测,在AFG1损伤AT-Ⅱcells的过程中,AFG1是通过其膜上的TLR4介导,激活NF-κB,进而促使TNF-αmRNA和IL-6mRNA表达增高的途径来实现对AT-Ⅱcells的刺激作用的,即这一反应过程是通过TLR4→NF-κB→炎症介质这一信号转导通路实现的。
目前还有研究发现,不同剂量AFG1作用于AT-Ⅱcells也可以激活JNK蛋白激酶,增加细胞内Ca2+,进而激活JNK信号转导通路,部分参与介导AFG1致AT-Ⅱ细胞毒性作用[12]。因此,在AFG1致AT-Ⅱcells损伤的作用机制中有多少信号转导通路参与其中,哪条通路占有主导地位,还需进一步研究。同时,在TLR4的胞内信号传导通路中,除依赖髓样分化蛋白MyD88可将TLR4的激活和NF-κB的核转运连接起来外,MyD88衔接蛋白则是一条TLR4非MyD88依赖的通路,在AFG1刺激AT-Ⅱcells的过程中,TLR4是具体通过怎样的途径来激活NF-κB,其具体机制也需进一步的研究。另外本实验只是从基因水平上证实AFG1对AT-Ⅱcells的致炎作用机制中有TLR4介导的胞内信号传导通路的存在,至于该通路接下来的蛋白表达是否具有免疫作用,要通过进一步的实验来说明。同时如何进一步深入研究其详细的机制,利用该通路中的信号受体作为靶位,对AFG1所致的肺部炎症进行调控是需要进一步探讨的问题。
[1]Mason RJ,Kalina M,Nielsen LD,et al.Surfactant protein C expression in urethane-induced murine pulmonary tumors[J].Am J Pathol,2000,156(1):175-182.
[2]Coussens LM,Werb Z.Inflammation and cancer[J].Nature,2002, 420(6917):860-867.
[3]Dobbs LG,Gonzalez R,Williams MC.An improved method for isolating typⅡcells in high and purity[J].Am Rev Rispir Dis, 1986,134(1):141-145.
[4]曾庆富,蒋海鹰,钱 仲,等.肺泡Ⅱ型上皮细胞的分离纯化及原代培养[J].中华病理学杂志,1998,27(5):384-385.
[5]Schulz C,Farkas L,Wolf K,et al.Differences in LPS-induced activation of bronchial epithelial cells(BEAS-2B)and type II-like pneumocytes(A-549)[J].Scand J Immunol,2002,56(3):294-302.
[6]ShenHT,Zhang XH,Lv P,et al.Effects of intratracheal administration of aflatoxin G1 on lung tissue in rats[J].Chin J Pharmacol Toxicol,2006,20(4):23-28.
[7]李荣启,范自营,张红云,等.粮食中黄曲霉毒素污染[J].粮食和油脂,2006,8(1):17-18.
[8]Rand TG,Mahoney M,White K,et al.Microanatomical changes in alveolar type II cells in juvenile mice intratracheally exposed to Stachybotrys chartarum spores and toxin[J].Toxicol Sci,2002,65 (2):239-245.
[9]Poltorak A,He X,Smimoval L,et al.Defective LPS signaling in C3H/Hei and C57BL/10ScCr mice:mutation in TLR4 gene [J].Science,1998,282(5396):2085-2088.
[10]Dziarski R,Wang Q,Miyake K,et al.MD-2 Enables Toll-Like receptor 4 mediated responses to lipopolysaccharide and enhances TLR4-mediated responses to Gram-positive and Gramnegative bacteria and their cell wall components[J].J Immunol, 2001,166(3):38-44.
[11]Chen LY,Zuraw BL,Zhao M,et al.Involvement of protein tyrosine kinase in Toll-like receptor 4-mediated NF-kappa B activation in human peripheral blood monocytes[J].Am J Physiol Lung Cell Mol Physiol,2003,284(4):7-13.
[12]Gekle M,Schwerdt G,Freudinger R,et al.Ochratoxin A induces JNK activation and apoptosis in MDKC-C7 cells a nanomolar concentrations[J].J Pharmacol Exp Ther,2000,293(3): 837-844.
[2012-04-09收稿,2012-05-10修回]
[本文编辑:韩仲琪 王庆法]
Toll-like receptor 4 mediated inducing-injury role of aflatoxin G1 on rat TypeⅡ alveolar epithelial
YANG Hong①,CHEN Cheng-shui.①Dept.of Respiratory Medicine,the Second Affiliated Hospital to
cells
Zhejiang University of TCM and Materia Medica,Hangzhou,Zhejiang 310005,China
ObjectiveOn gene level to explore biological effects of Toll-like receptor 4 mediated the injury role of aflatoxin on alveolar typeⅡ epithelial cells,as well as in this process role mechanisms and pathway.MethodsIn this experiment 3 groups were randomly designed.Group 1(normal group);Group 2(the experimental group),and Group 3(solvent control group),6 samples(i.e isolated, purified and cultured Type Ⅱ alveolar epithelial cells,AT-Ⅱ cells),per group.In normal group an equal volume of sterile saline was added;in experimental group(i.e Group 2)added different concetrations of AFG1 solution(i.e 2.0 mg/L,1.0 mg/L and 0.5 mg/L, as B1,B2,B3subgroups);in solvent control group (i.e Group3)added DMSO;in Group 2 and 3,the end concetration of DMSO was 0.4ml/L.Then,after treatment for 24hs,from above-mentioned 5 group extracting mRNA was taken to detect the levels of TLR4mRNA,NF-κBmRNA,TNF-αmRNA and IL-6mRNA of each group by using RT-PCR.ResultsIn normal group on alveolar TypeⅡ epithelial cells the expression of TLR4 mRNA, NF-κBmRNA,TNF-αmRNA and IL-6mRNA was lower levels.In experimental group cells after AFG1 solution acting,those related indicator expressions were significantly higher than that in normal group (P<0.05)and solvent control group (P<0.05),and a dose dependence increased.Solvent control group,in these related indicator expressions compared with normal control group,had no significant differences(P>0.05).ConclusionTLR4→NF-κB→inflammatory mediators involved in signal transduction pathway of AFG1 inducing injury of AT-Ⅱ cells.
Alveolar TypeⅡepithelial cells;Injury of lungs;Aflatoxin G1;Toll-like receptor 4;Nuclear factor (NF)-κB
book=727,ebook=101
R-33:R655.3
A
310005浙江杭州,浙江中医药大学第二附属医院呼吸内科(杨红);325000浙江温州,温州医学院第一附属医院呼吸内科(陈成水)

