多西他赛与吉非替尼序贯应用对人肺腺癌细胞H1975存活及凋亡通路的研究
张鑫宇 刘皈阳 祝晓光 王伟兰
肺癌是当今发生率和死亡率最高的恶性肿瘤之一,依据患者的临床和病理特征,可分为小细胞肺癌和非小细胞肺癌(non-small cell lung cancer, NSCLC),二者中NSCLC占80.4%。由于大部分肺癌患者被诊断发现时已属于晚期,导致患者的5年生存率往往低于10%[1]。
近年来铂类为主的传统的两药联合化疗方案的疗效遇到瓶颈[2,3],以表皮生长因子受体(epidermal growth factor receptor, EGFR)为靶点的分子靶向治疗成为肿瘤治疗研究的热点。吉非替尼和厄洛替尼是具有口服活性可逆的小分子酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKIs),在胞内和ATP竞争酪氨酸激酶残基的结合位点,阻止酪氨酸激酶残基自身磷酸化而抑制下游信号的转导,最终加速细胞凋亡[4],被广泛应用于晚期进展的NSCLC。然而临床实验和临床观察中发现EGFR-TKIs并不适用于所有患者,2004年几项重要的回顾性研究[5-7]发现占EGFR 90%以上突变比例的19和21外显子的突变可预测EGFR-TKIs的敏感性。优势突变人群的临床特征主要表现为亚裔、非吸烟的女性患者。2009年3项大型前瞻性的III期临床实验[8-10]进一步证实了上述结论,基于此,2010年NCCN(中国版)指南要求晚期进展的NSCLC患者在使用EGFR-TKIs时要进行EGFR突变检测。虽然EGFR-TKIs在携带优势突变的患者身上显示出较好的反应率,但获得性耐药却不可避免地尾随而至,一般出现在最初治疗10个月后[11]。获得性耐药的可能机制有很多,主要包括EGFR 20外显子T790M突变[12];肝细胞生长因子受体(mesenchymal-epithelial transition factor,Met)扩增[13];肝细胞生长因子(hepatocyte growth factor,HGF)的高表达[14];EGFR旁路信号通路胰岛素生长因子(insulin-like growth factor, IGF)受体的激活[15];下游信号分子碱性磷脂酶(phosphatase and tensin homolog,PTEN)的缺失[16]以及最近发现的上皮间质化(epithelialto-mesenchymal transition, EMT)[17,18]。其中T790M突变约占上述总比例的50%以上,为当下研究的热点。从发现耐药以来,逆转耐药的研究也一直没有停止过。根据TKIs治疗失败的分子机制研究主要有靶向T790M耐药突变开发的新一代不可逆的TKIs、选择性c-met扩增抑制剂、拮抗IGF1-R的单克隆抗体以及针对EMT耐药设计的抑制剂,均取得较好的初步结果。遗憾的是研究成果大多处于II期、III期临床试验中[19],真正走向临床服务于患者还需要一个过程。这段时间中,面对越来越多TKIs治疗失败后仍需治疗或仍有强烈治疗意愿的患者,需要在已有的治疗药物基础上探索新的治疗模式,既往相关基础研究发现合理的化疗联合靶向治疗模式在NSCLC EGFR突变野生型和敏感型细胞株中均显示有协同作用[20,21]。已有临床医生根据TKIs治疗阶段以及治疗过程中患者对TKIs的反应,借助临床现有的药物和治疗手段,不断地尝试逆转耐药,主要尝试过铂类联合紫杉类化疗、化疗联合靶向治疗、化疗后序贯原靶向治疗以及更换另外一种TKIs等模式。虽然大都为小规模尝试治疗的总结,证据级别不高,但经验可贵,值得借鉴[22-24]。
基于上述信息,我们发现在占获得性耐药比例最高的T790M突变人群中,有关化疗与靶向药物联合应用的研究仍然不是很全面,本文通过体外实验探索化疗药物多西他赛和吉非替尼在携带T790M突变的NSCLC获得性耐药细胞株H1975上合理的给药模式,一方面进一步完善此方向研究,另一方面为T790M获得性耐药的后续治疗提供一些值得借鉴的基础理论支持。
1 材料与方法
1.1 材料 人肺腺癌细胞H1975购自中科院上海细胞生物研究所,由本实验室保种。MTT、DMSO、吉非替尼购自Sigma公司。多西他赛由法国赛诺菲安万特公司提供,吉非替尼与多西他赛均溶于DMSO中,分别以40 mmol/L与12 mmol/L过滤分装后于-20oC保存,实验时利用完全培养基稀释到相应的工作浓度,且保证工作液中DMSO浓度不高于0.1%,每支药物反复冻融不超过5次。凋亡细胞染色试剂盒购自普利莱基因技术有限公司,Annexinv-PE/7-AAD细胞凋亡检测试剂盒购自BD公司,DNA含量(细胞周期)检测试剂盒购自南京凯基生物技术有限公司,Caspase-3、Caspase-8、Caspase-9活性检测试剂盒购自R&D Systems。流式细胞仪为BD公司产品,酶联免疫检测仪为Biocell 2010公司产品。
1.2 方法
1.2.1 细胞培养 人肺腺癌细胞H1975培养于含10%胎牛血清和青霉素与链霉素(终浓度为100 U/mL)的RPMI-1640(Gibco公司)培养液,常规置于37oC、5%CO2培养箱中,细胞单层贴壁生长,实验取用生长状态良好的对数生长期细胞,胰蛋白酶消化传代,收集备用。
1.2.2 MTT法检测药物对H1975生长作用的影响 通常认为在MTT检测中空白对照组在波长570 nm的吸光度为0.8-1.2时,不同抑制组与空白组间区分效果较好,而吸光度与实验中参与MTT代谢的细胞数量和活性相关,不同的肿瘤细胞增殖速度不同,由上述方法确定H1975的铺板数为5,000个/孔。
1.2.2.1 单药MTT实验 实验前一天晚上取生长状态良好的对数生长期细胞,胰酶消化计数后完全培养基稀释到上述相应浓度后,取100 μL到96孔板,37oC、5%CO2培养箱中孵育过夜,待细胞完全贴壁后,吸弃原培养基,加入200 μL完全培养基配置好的含不同药物不同浓度的药液,每个浓度至少6个复孔,设置空白组和对照组。空白组只加培养液,对照组不加药物。培养72 h后每孔加用PBS配成的5 mg/mL MTT溶液20 μL,继续孵育4 h-6 h后小心吸弃上清,每孔加150 μL DMSO,置水平摇床上低速振荡10 min,使结晶物充分溶解,570 nm波长处测量各孔吸光度。分别计算各加药组的抑制率。所有细胞增殖抑制实验均独立重复至少3次,求得平均抑制率,细胞存活率=(A用药组/A对照组)×100%,细胞抑制率=(1-A用药组/A对照组)×100%。
1.2.2.2 不同时序给药方案的增殖抑制实验 时序方案分组如下:①多西他赛作用24 h,PBS洗涤1遍,吉非替尼继续序贯48 h(DG);②多西他赛联合吉非替尼作用48 h,PBS洗涤1遍,不含药液的完全培养基继续孵育24 h(D+G);③吉非替尼作用48 h,PBS洗涤1遍,多西他赛继续序贯24 h(GD)。不同时序方案下的两药给药浓度根据上述单药MTT的IC50值的比率进行确定,两药在每种方案下的给药配比剂量分别为各自单药IC50的0倍、0.25倍、0.5倍、1倍、2倍、4倍。MTT方法同上述单药实验。
1.2.3 两药时序使用效应的评估
1.2.3.1 Isobolograms等效线图法 通过Steel和Peckham[25]的isobolograms来评价IC80(抑制80%细胞生长的药物浓度)水平吉非替尼和多西他赛在H1975细胞株上的量效关系(图1)。Isobolograms法是判定联合用药体外发生协同、相加、拮抗作用的标准统计方法,适用于毒性机制不明以及多种抗癌因子联合作用下的量效曲线研究。Isobolograms的概念在先前的研究中有过详细的描述[26]。
三条模型线由模型I、模型II围成一个区域,以吉非替尼和多西他赛的疗效曲线为基础,图中三条等效线围成的阴影区域为相加作用,当Pa落在此区域的左边时,则存在协同作用;当Pb落在阴影区域时则存在相加作用;当Pc、Pd落在此区域右边时,则存在弱相加作用或拮抗作用。需要指出的是,在大多数情况下,以上4个点都同时落在三条模型线围成的区域的左边或区域内或区域的右边。少数情况下如果这4个点不是落在同一个区域内,则用Wilcoxon符号轶和检验进行统计,以判断协同、相加或拮抗作用。
由等效线模型I(实线)和II(虚线)围成的区域为相加作用区域,模型线由吉非替尼和多西他赛的量效曲线构成。在H1975细胞株的等效线图中,横坐标和纵坐标的数值1分别代表导致80%细胞生长抑制的吉非替尼或多西他赛单药浓度。时序给药点Pa、Pb、Pc以及Pd分别表示协同、相加、弱相加或拮抗作用。
1.2.3.2 联合指数分析 以MTT法测得单药不同药物剂量的抑制率后可以得到细胞的剂量-效应曲线,采用CalcuSyn分析软件计算联合指数(combination index,CI)。联合指数的公式为CI=(D)1/(Dx)1+(D)2/(Dx)2,其中(D)1、(D)2分别为联合用药时两药各自的浓度,Dx为联合用药达fa时单药抑制率也达到fa所需要的药物浓度,Dx=Dm[fa/(1-fa)]1/m,fa表示一定浓度的两药联合用药达到的抑制率。通过软件输入单药的剂量及抑制率可得到Dm值和m值,再经上述联合指数计算公式就可得到某种联合用药方案的效应,CI<1表示此方案具有协同效应[27]。
1.2.4 流式细胞仪AnnexinV/7-AAD双染色法检测不同给药方案下H1975细胞凋亡情况 实验前一天晚上取生长状态良好的对数生长期细胞,胰酶消化计数后完全培养基稀释到1×106个/mL,取500 μL到25 cm培养瓶中,加完全培养基至5 mL,37oC、5%CO2培养箱中孵育过夜,待细胞完全贴壁后,吸弃原培养基,加入5 mL完全培养基配置好的含不同药物浓度的药液。到达作用时间后,不含EDTA的胰酶消化收集细胞,PBS洗涤2次,计数收集5×105个-1×106个细胞,加入500 μL-1,000 μL的Binding Buffer重悬细胞调整细胞浓度到1×106个/mL。从以上细胞悬液中吸取100 μL转移到5 mL流式上样管中,分别加入5 μL 7-AAD和PE-Annexin V染液,室温避光反应至少15 min,最后向每支流式管中加入300 μL-400 μL Binding Buffer,1 h内上机检测,激发波长Ex=488 nm,发射波长Em=578 nm,PE-Annexin V建议使用FL2通道检测,7-AAD建议使用FL3通道检测。每次实验均需在正常细胞组中设立3组对照:①不加染料组;②7-AAD单染组;③PE-Annexin V单染组。实验重复3次。正常活细胞Annexin V、7-AAD均低染,凋亡细胞Annexin V高染、7-AAD低染,死亡细胞Annexin V、PI均高染,胞质自切细胞7-AAD高染,Annexin V低染。实验分组如下:①对照(无药物作用)72 h组(N);②多西他赛单独作用72 h组(D);③吉非替尼单独作用72 h组(G);④多西他赛作用24 h,PBS洗涤1次后序贯吉非替尼48 h组(DG);⑤多西他赛联合吉非替尼48 h,PBS洗涤1次后序贯不含药液的完全培养基继续孵育24 h组(D+G);⑥吉非替尼作用48 h,PBS洗涤1次后序贯多西他赛24 h组(GD)。每种方案下的给药剂量分别为MTT单药实验中的IC50。
1.2.5 Hoechst 33258 DNA染色检测凋亡 实验分组同上,收集各组细胞到1.5 mL EP管中,4%多聚甲醛重悬细胞沉淀固定,1,000 rpm低速离心,吸弃固定液,PBS洗涤1次,将少量细胞悬液滴到载玻片上,涂布,风干;使用配制好的Hoechst 33342工作液,重悬细胞,室温孵育10 min以上;吸弃染色液,PBS洗涤1次,抗荧光淬灭封片剂封片。每组细胞至少涂片5张,每张细胞涂片在Olympus荧光显微镜200倍视野下观察8个不同视野,实验重复3次。
1.2.6 流式细胞仪检测不同给药方案下H1975细胞周期分布情况 实验分组和给药剂量同凋亡实验,到达作用时间后,胰蛋白酶-EDTA消化液消化收集细胞,PBS洗涤细胞1次,计数调整细胞浓度为1×106个/mL,70%冰乙醇固定,4oC保存,染色前PBS洗去固定液,加100 μL RNaseA 37oC水浴30 min,再避光加入400 μL PI染液混匀,4oC避光30 min,上机检测,记录激发波长488 nm处红色荧光,检测细胞周期分布。
1.2.7 Caspase活性检测 实验分组和给药剂量同凋亡实验,收集2×106个-6×106个细胞,PBS洗涤2次,加50 μL-150 μL冰冷的Lysis Buffer(25 μL/1×106细胞),冰上孵育10 min,离心10,000 g、3 min,将上清转移至新的EP管,取少量上清(5 μL),Braford法测定其中的蛋白浓度;吸取50 μL含100 μg-200 μg蛋白裂解上清;如体积不足50 μL用Lysis Buffer补足至总体积50 μL,加入50 μL的2×Reaction Buffer(注意:使用前每50 μL 2×Reaction Buffer加入0.5 μL DTT,Reaction Buffer要一一对应);根据实验目的加入5 μL Caspase-3(DEVD-AFC)、Caspase-8(IETDAFC)或者Caspase-9 (LEHD-AFC),并于37oC避光孵育2 h。酶标仪λ=405 nm测定其吸光值。通过计算OD诱导剂/OD阴性对照的倍数来确定凋亡诱导剂组Caspase的活化程度。同时设置空白组(50 μL Lysis Buffer+50 μL 2×Reaction Buffer+5 μL底物)以及不含底物的阴性组(50 μL含蛋白Lysis Buffer+50 μL 2×Reaction Buffer)。
1.3 统计学处理 采用SPSS 13.0软件进行统计学分析,各组间差异分析采用One-way ANOVA检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 单药MTT对H1975生长的影响 吉非替尼和多西他赛作用72 h对H1975细胞抑制作用的IC50值分别为(10.31±1.05)μmol/L、(3.03±0.13)nmol/L,并且呈浓度依赖性抑制H1975的生长(图2)。
2.2 不同时序给药方案对H1975增殖抑制作用 根据吉非替尼和多西他赛单药的MTT结果,近似取IC50的整数值,吉非替尼为10 μmol/L,多西他赛为3 nmol/L。按照上述设计的3种时序给药方案和药物配比剂量进行MTT试验,得到的结果见图3。其中A、B、C分别代表多西他赛序贯吉非替尼组、多西他赛联合吉非替尼组以及吉非替尼序贯多西他赛组。
纵坐标显示的是H1975的存活率,横坐标对应的是多西他赛和吉非替尼的浓度配比。依据3种给药模型中两药单药量效曲线可进一步绘制IC80下不同方案等效线图从而评价模型之间的优劣。同时可以进行3种模型联合用药指数CI的分析。
2.3 不同时序模型给药方案效果的评价
2.3.1 等效线图法 依据3种给药模型中吉非替尼和多西他赛单药量效曲线绘制IC80下3种方案的等效线图模型(图4)。同时进行3种模型联合用药指数CI的分析(表1)。图4中A、B、C分别代表多西他赛24 h序贯吉非替尼组48 h、多西他赛联合吉非替尼组48 h以及吉非替尼48 h序贯多西他赛24 h组的等效线图,各图中横纵坐标数值1分别代表每种模型下吉非替尼或多西他赛单药作用后的IC80值。A图中固定吉非替尼剂量后,变换多西他赛的剂量得到的5个IC80等效点中3个点落在IC80等效口袋区域的左侧,2个点处于等效区域的左侧边缘位置,说明多西他赛序贯吉非替尼组主要表示为协同作用或接近强相加作用。B图中5个IC80等效点皆处于IC80等效口袋区域内,且大都处于区域靠右侧位置,说明多西他赛联合吉非替尼主要表示为相加作用。C图中5个IC80等效点皆处于IC80等效区域右侧且远离等效区域,表示吉非替尼序贯多西他赛主要表示为拮抗作用。
2.3.2 中位线效应法 对3种给药模型得到的原始数据按照联合用药指数法进行分析采用CalcuSyn软件计算联合用药的CI值,具体结果见表1-表3。从CI的概念来讲,CI>1说明药物间为拮抗作用,CI=1说明药物间为相加作用,CI<1说明药物间为协同作用。CI值越小,协同的效应越强烈。在实际实验中,通常认为CI<0.3表示强烈协同效应,0.3≤CI<0.7为中度协同效应,0.7≤CI<1.0为较弱的协同效应。表1结果显示大部分值小于1,在吉非替尼低剂量的组别中个别值接近1或略高于1,说明多西他赛序贯吉非替尼组主要表现为强协同或中度协同作用。表2结果显示大部分值在1附近,在吉非替尼低剂量组别出现高于1的现象,说明多西他赛联合吉非替尼主要表现为相加作用。表3结果显示大部分值远远超过1,表示吉非替尼序贯多西他赛主要表现为拮抗作用。

图1 等效线图法的原理图Fig 1 Schematic representation of an isobologram

图2 不同浓度的吉非替尼(A)和多西他赛(B)作用72 h对H1975细胞生长的影响Fig 2 Effects of gefitinib (A) and docetaxel (B) on the proliferation of H1975 cells for 72 h
2.4 Annexin V/7-AAD双染色法检测吉非替尼和多西他赛诱导H1975细胞的凋亡 采用流式细胞仪分析方法进一步确定多西他赛序贯吉非替尼是否导致最高的凋亡率。共设计6种给药方案,其中包括空白对照组以及多西他赛和吉非替尼单药组(图5A),结果发现与正常组相比,10 μmol吉非替尼单药(7.69±0.48)以及吉非替尼序贯多西他赛(5.37±0.62)方案均未引起H1975出现明显的凋亡现象,吉非替尼联合多西他赛同吉非替尼单药以及多西他赛序贯吉非替尼与空白组比较皆诱导产生明显凋亡(P<0.05),而且多西他赛单药(25.54±1.27)与多西他赛序贯吉非替尼(27.36±0.72)方案较多西他赛联合吉非替尼方案(14.75±1.14)在诱导凋亡结果上也具有明显差异(P<0.05)。但多西他赛单药和多西他赛序贯吉非替尼两种方案间未能得出有统计学意义的结果,数值上多西他赛序贯吉非替尼组略显优势(图5B)。
2.5 药物处理后Hoechest 33258染色结果 药物诱导凋亡的H1975细胞,Hoechest 33258染色后显示蓝染的凋亡小体和细胞核。与完整、圆形、大型的细胞核相比,单个凋亡小体呈细小不规则颗粒状,同一细胞内(红色箭头指示处)可出现大小不等的多个凋亡小体(图5C)。
2.6 不同给药方式对细胞周期的影响 给药剂量和实验分组同细胞凋亡实验,不同作用方式下的结果都以正常组为基准进行比较,流式图结果见图6A,由统计结果可以看出,吉非替尼单药主要将细胞抑制在G0/G1期(56.59±3.29)(P<0.05),而单药多西他赛作用后,G2/M期的细胞明显增多(42.57±1.22)(P<0.05),同样在吉非替尼序贯多西他赛方案中G0/G1期细胞高达57.48±3.63(P<0.05),而多西他赛序贯吉非替尼组G0/G1期细胞仅占36.5±2.65,G2/M期细胞比例则为39.83±1.28(P<0.05)(图6A)。由此可见吉非替尼单药或吉非替尼序贯多西他赛组主要诱导G0/G1期阻滞,而多西他赛单药或多西他赛序贯吉非替尼组主要诱导G2/M期阻滞。
2.7 不同给药方式下Caspase-3、Caspase-8、Caspase-9的活性情况 由方法中可知Caspase的活化程度可以通过计算OD诱导剂/OD阴性对照的倍数来确定。统计结果发现与其它组相比,多西他赛序贯吉非替尼组Caspase-3的活性为2.1±0.19(P<0.05),多西他赛组Caspase-8的活性为2.59±0.27(P<0.05),而所有组Caspase-9的活性没有统计学差异(图7)。
3 讨论

图3 吉非替尼和多西他赛在H1975细胞株中的时序依赖关系。A:多西他赛24 h后吉非替尼48 h;B:多西他赛联合吉非替尼48 h序贯24 h不含药完全培养基;C:吉非替尼48 h序贯多西他赛24 h。纵坐标代表细胞存活率,横坐标代表多西他赛和吉非替尼浓度配比,浓度单位为μmol/L(□为0、○为2.5、Δ为5.0、+为10、×为20、▽为40)。数据为3次独立实验的平均值;标准差<20%。DG:多西他赛序贯吉非替尼;D+G:多西他赛联合吉非替尼;GD:吉非替尼联合多西他赛。Fig 3 Schedule dependence of the interaction between gefitinib and docetaxel in H1975. A: Pretreated with docetaxel 24 h, followed by gefitinib for 48 h;B: Treated concomitantly with gefitinib and docetaxel for 48 h and incubated in drug-free medium for 24 h; C: Pretreated with gefitinib 48 h, followed by docetaxel for 24 h. The survival rate are show on ordinate, the concentrations of docetaxel and gefitinib are shown on the abscissa. The concentrations unit is μmol/L. 0, squares; 2.5, circles; 5, uptriangles; 10, plus; 20, cross; 40, downtriangles. Data are the meanvalues for three independent experiments;SE was <20%. DG: docetaxel followed by gefitinib; D+G: gefitinib plus docetaxel; GD: gefitinib followed by docetaxel.
EGFR的异常表达和活化在肿瘤的发生发展中起着重要的作用,使EGFR成为肿瘤治疗的理想靶位,为晚期肺癌患者带来了新的生存希望,然而临床使用EGFRTKIs的过程中发现大部分患者或早或晚都将出现耐药。其中20外显子790位T突变为M(蛋白水平表现为苏氨酸转变为甲硫氨酸)是肿瘤对EGFR-TKIs获得性耐药的重要原因,在获得性耐药的患者中约占50%左右。T790M耐药原因主要有两种:①甲硫氨酸替代苏氨酸后出现了位阻效应,减弱了酪氨酸激酶残基与ATP口袋中药物的结合力;②突变增加了酪氨酸激酶残基与ATP的亲和力,而且是至少一个数量级以上的差别,使突变型受体药物和ATP的亲和力恢复到野生型EGFR水平[28,29]。
H1975(EGFR exon 20 T790M-exon 21 L858R)为携带21外显子敏感性突变的双突变耐药细胞株,双突变造成的ATP亲和力的恢复使得加大的治疗窗重新关闭,表现为对TKIs的获得性耐药。我们经过反复实验总结出了适合本实验室条件的操作方法,得到吉非替尼和多西他赛单药作用72 h对H1975细胞抑制作用的IC50值分别为(10.31±1.05)μmol/L和(3.03±0.13)nmol/L,在以往报道[30]的范围之内。

图4 多西他赛与吉非替尼时序作用下的等效线图。A:多西他赛24 h后吉非替尼48 h;B:多西他赛联合吉非替尼48 h序贯24 h不含药完全培养基;C:吉非替尼48 h序贯多西他赛24 h。数据为3次独立实验的平均值。Fig 4 Isobologram of docetaxel in combination with gefitinib. A: Pretreated with docetaxel 24 h, followed by gefitinib for 48 h; B: Treated concomitantly with gefitinib and docetaxel for 48 h and incubated in drug-free medium for 24 h; C: Pretreated with gefitinib 48 h, followed by docetaxel for 24 h. Data are the mean values for three independent experiments.

表1 多西他赛序贯吉非替尼组的联合用药指数结果Tab 1 The result of CI to pretreated with docetaxel followed by gefitinib

表2 多西他赛联合吉非替尼的联合用药指数结果Tab 2 The result of CI to treated gefitinib combination with docetaxel
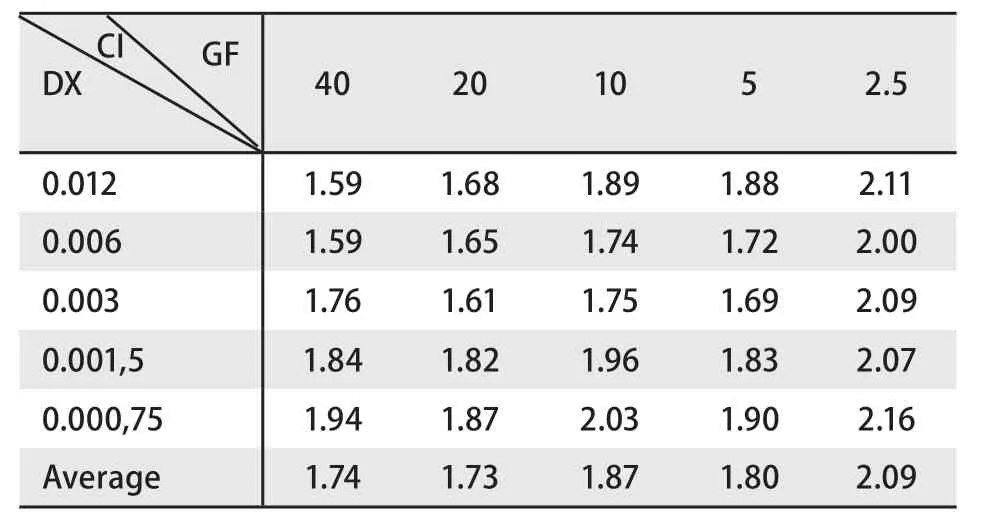
表3 吉非替尼序贯多西他赛的联合用药指数结果Tab 3 The result of CI to treated pretreated with gefitinib followed by docetaxel

图5 多西他赛和吉非替尼单药或序贯作用72 h诱导的H1975凋亡。A:N:正常培养;D:多西他赛单药;G:吉非替尼单药。胰酶消化,Annexin V/7-AAD固定流式检测;B:与正常培养组对比其它组的凋亡率。*:与DG组比较,P<0.05;#:与D组比较,P<0.05;C:不同方法处理72 h后H1975凋亡形态改变。实验重复3次。Fig 5 The effects of docetaxel and gefitinib alone and in the sequential exposure schedules for 72 h on cell apoptosis of H1975. A: N: Without treatment; D: docetaxel alone; G: gefitinib alone. After trypsinized, cells were stained with annexin V/7-AAD and detected by flow cytometry; B: Relative apoptosis levels to control. *: compare to DG group, P<0.05; #: compare to D group, P<0.05; C: The apoptosis of H1975 in dealing with different methods after 72 h. Independent experiments are repeated 3 times.
TKIs耐药后的临床治疗一直处于探索阶段,大多为小规模的临床经验总结,比如在耐药后进行铂类联合紫杉类化疗、化疗联合靶向治疗、化疗后序贯原靶向治疗以及更换另外一种TKIs药物的尝试均有报道,但有研究[31]提示一种靶向药物治疗失败后出现T790M突变的耐药患者不推荐更换另外一种靶向药物继续治疗,但对于耐药后出现非T790M突变的耐药患者仍可以尝试更换另外一种靶向药物继续治疗,临床可能获益。
联合用药实验中的“协同”是指“1+1>2”的效果,如果是“1<1+1≤2”,只能称之为“加合”,“1+1<1”则称为“拮抗”。所以两种药物联合抑制效果强于单药并不意味着具有协同作用,其中可能包括有“1<1+1≤2”的情况。鉴于上述经验,针对携带T790M突变的H1975细胞株,我们设计了3种序贯方案来考察哪种方案的疗效最佳。常用于评估两药联合效应的统计学方法有isobolograms模型、Bliss additivism模型及CI方法。Isobolograms模型和CI方法均是基于IC50进行计算的[32]。本实验中的数据达到了使用isobolograms模型和CI方法的条件。所以我们同时选择这两种方法来体外评价上述3种给药方案对H1975存活的影响。Isobolograms模型和CI方法的原理在试验方法中已经详细阐述。

图6 吉非替尼与多西他赛联合作用于H1975细胞时的细胞周期分布。A:胰酶消化,PI单染固定流式检测。B:与正常培养组对比,其它组的周期分布。*:与D和DG组比较,P<0.05;#:与G和GD组比较,P<0.05。数据为3次独立实验的平均值。Fig 6 Cell cycle distribution of H1975 cells exposed to gefitinib and docetaxel in different sequences. A: After trypsinized, cells were stained with PI and detected by flow cytometry; B: Relative cell cycle distribution levels to control. *: compare to DG and D groups, P<0.05; #: compare to G and GD groups, P<0.05. Data are the mean values for three independent experiments.

图7 吉非替尼与多西他赛联合下Caspases的活化情况。*:与DG组比较,P<0.05;#:与D组比较,P<0.05。数据为3次独立实验的平均值。Fig 7 The activities of Caspases to gefitinib and docetaxel in different sequences. *: compare to DG group, P<0.05; #: compare to D group, P<0.05.Data are the mean values for three independent experiments.
本研究结果显示,先用多西他赛24 h后序贯吉非替尼48 h组中5个IC80等效点中3个点落在IC80等效口袋区域的左侧,相对于多西他赛联合吉非替尼48 h组(5个点皆处于IC80等效口袋区域内,且大都处于区域靠右侧位置,指示为相加作用)以及吉非替尼48 h后序贯多西他赛24 h组(5个IC80等效点皆处于IC80等效区域右侧且远离等效区域,指示为拮抗作用)表示为协同作用或接近强相加作用。表1-表3中的CI值同样也证实了isobolograms模型的结论,即多西他赛序贯吉非替尼组较其它两种给药方式具有协同增效作用。此结果与EGFR突变野生型和敏感型细胞株的基础研究[20,21]结果一致,同样INTACT1、INTACT2、TRIBUTE和TALENT的多中心随机对照临床研究[33,34]也得到类似结果。
目前认为细胞的死亡存在3种类型:坏死、凋亡和自噬,有报道[35]称吉非替尼低浓度仅引起细胞生长的抑制,只有高浓度才会导致细胞的凋亡,并且凋亡主要经死亡受体途径诱导。但多西他赛诱导细胞死亡的方式可能为凋亡,也可能为其它方式(比如有丝分裂灾变),并且在凋亡途径中可能同时激活死亡受体途径和线粒体途径,但未见有明确结论[36]。因此我们在细胞毒性数据及3种序贯给药方式的基础上,增加空白组和单药组,对不同方案下细胞死亡方式中的凋亡途径进行初步研究,探讨不同用药组下细胞周期分布情况,观察不同凋亡途径的交叉和影响,进一步解释不同方案间存在的疗效差异现象。
流式细胞仪分析方法检测凋亡实验结果显示:多西他赛单药与多西他赛序贯在诱导凋亡结果上较其它组具有明显差异,但两种方案间未能得出有统计学意义的结果,数值上多西他赛序贯吉非替尼组略显优势。而单药吉非替尼和吉非替尼序贯多西他赛组,未诱导出明显凋亡。细胞周期分布实验中单药多西他赛和多西他赛序贯吉非替尼组,细胞主要被抑制在G2/M期,而单药吉非替尼和吉非替尼序贯多西他赛组,细胞主要被抑制在G0/G1期。Caspase活化结果显示单药多西他赛和多西他赛序贯吉非替尼组,Caspase-3、Caspase-8明显活化,而Caspase-9与对照组相比,不仅未被诱导活化,而且活性均有一定程度的抑制。
众所周知,EGFR-TKIs主要通过抑制EGFR及其下游信号磷脂酰肌醇三羟基激酶/蛋白激酶B(phosphatidyl inositol-3-kinase and protein kinase B, PI3K/Akt)和丝裂原活化蛋白激酶/细胞外信号调节激酶1/2(mitogenactivated protein kinases/extra cell μlar signal-reg μlated kinases,MAPK/Erk1/2)传导,抑制肿瘤细胞增殖、侵袭、转移及凋亡。研究[37]发现化疗与EGFR-TKIs联合应用于不同NSCLC细胞,只有细胞EGFR磷酸化(pEGFR)水平增加者才能从后续的吉非替尼治疗中获益,而与EGFR是否存在突变或扩增无关,也就是说先多西他赛后吉非替尼的EGFR和ERK磷酸化水平会明显增高,明显提高了后续吉非替尼的疗效。同时吉非替尼为细胞周期非特异性药物,使大量细胞在多西他赛诱导的G2/M期死亡。而吉非替尼与多西他赛同时应用或吉非替尼后序贯多西他赛时,吉非替尼把细胞大量抑制在G0/G1期,而多西他赛为周期特异性药物,主要作用于细胞有丝分裂期,使多西他赛的疗效大打折扣,而吉非替尼导致的EGFR和ERK磷酸化下调作用也不能被同时或序贯应用的多西他赛逆转,结果说明上述两种方案未能增强细胞抑制作用,可能与吉非替尼把细胞大量抑制在G0/G1期和多西他赛逆转EGFR和ERK磷酸化下调失败有关。
Caspase全称为含半胱氨酸的天冬氨酸蛋白水解酶,是一组存在于细胞质中、具有类似结构的蛋白酶。它们的活性位点均包含半胱氨酸残基,能够特异性地切割靶蛋白天冬氨酸残基后的肽键,负责选择性地切割某些蛋白质,从而造成细胞凋亡。根据原域的长度、酶在凋亡途径中的位置和前体的活化方式,分起始者胱天蛋白酶和效应者胱天蛋白酶。Caspase-8、Caspase-9为起始者胱天蛋白酶,Caspase-3为效应者胱天蛋白酶。Caspase-8主要作用于死亡受体途径,Caspase-9则主要存在于线粒体途径中。二者最终都通过活化下游的Caspase-3来造成细胞凋亡。结果显示和空白组比较,各用药方案皆主要通过死亡受体途径中的Caspase-8前体活化从而激活Caspase-3来诱导细胞凋亡,而且多西他赛序贯吉非替尼组Caspase-3、Caspase-8的活化程度远高于吉非替尼联合多西他赛组以及吉非替尼序贯多西他赛组,却低于多西他赛单药组。然而流式结果显示多西他赛序贯吉非替尼组的凋亡率反而略高于多西他赛单药组。值得我们注意的是所有实验组的Caspase-9的活性并未有统计学差异,这引发了我们的思考:是否存在两药联合后吉非替尼激活多西他赛诱导的自噬或者有丝分裂灾变?假如存在的话,自噬和有丝分裂灾变同凋亡之间是否会相互转化?这些问题仍值得我们进一步实验继续探索。
本研究在吉非替尼耐药的H1975细胞株上发现多西他赛序贯吉非替尼与吉非替尼联合多西他赛及吉非替尼序贯多西他赛相比具有协同增效作用,为临床晚期TKIs耐药后T790M突变的患者提供了一条很好的临床思路,尤其为体力状态较好的患者带来了一丝希望。但序贯方案的优化和给药剂量的详细确定仍有待进一步体内和临床实验的研究。在死亡相关的凋亡通路中,不同给药方案主要都是通过死亡受体途径诱导细胞凋亡的,同时多西他赛序贯吉非替尼组诱导凋亡现象仍值得深入研究。

