高压静电抗溶剂法制备聚乳酸微球
陈爱政,杨月梅,王士斌,孙晴晴,刘源岗,党婷婷
(1华侨大学化工学院,福建 厦门 361021;2华侨大学生物材料与组织工程研究所,福建 厦门 361021)
高压静电抗溶剂法制备聚乳酸微球
陈爱政1,2,杨月梅1,王士斌1,2,孙晴晴1,刘源岗1,2,党婷婷1
(1华侨大学化工学院,福建 厦门 361021;2华侨大学生物材料与组织工程研究所,福建 厦门 361021)
以无水乙醇为非溶剂,采用高压静电抗溶剂法制备聚乳酸微球。通过 24全因子试验设计对微球粒径和粒径分布的影响因素进行了显著性分析。并考察最显著因素对微球表面形貌的影响规律。结果表明,推进速度是影响微球粒径的最显著因素,最优条件下微球表面光滑、球形度好,粒径分布窄。浓度为3%,相对分子质量为5万~10万的聚乳酸制备的微球,球形度较好。经过高压静电处理后,傅里叶红外光谱测定表明聚乳酸无明显结构摄动;X射线粉末衍射分析表明聚乳酸晶体结构未发生明显变化。
高压静电体系;抗溶剂;聚乳酸;因子试验
随着高分子材料科学和现代医药学的相互渗透,选择合适的高分子材料作为药物控制释放载体,进行制备具有生物相容性良好、可生物降解性和缓释性的药物载体已成为最热门的研究方向之一[1-3]。聚乳酸[Poly(lactic acid),PLA]及其共聚物在人体内的代谢是通过水解或酶解最终完全分解为 CO2和H2O,中间产物乳酸也是体内正常糖代谢的产物;且人体对此类材料有很强的耐受性,故成为人们广泛关注的药物缓释高分子材料。自 1970年 Yolles等率先将 PLA用作药物长效释放剂载体,1979年Beck以聚乳酸-羟基乙酸(PLGA)为囊材制备出孕酮PLGA缓释胶囊以来[4],PLA及其共聚物已被用作一些半衰期短、稳定性差、易降解及毒副作用大的药物控释载体,如抗生素、抗癌用药、疫苗、激素、计生用药、解热镇痛药以及神经系统用药等,可有效地增加给药途径,减少给药次数和给药量,提高药物生物利用度,减少其对肝、肾等的副作用。
目前,制备聚乳酸微球的传统方法中,乳化-溶剂挥发法、复乳法、聚合法等存在产品易于聚集、融合,分离纯化困难,需花大量时间和精力去除残留溶剂、多余药物和不可降解的添加物(如作为稳定剂的聚乙烯醇),不适宜工业化生产;喷雾干燥法、熔融法、盐析法等制备过程比较激烈,如温度较高或pH值变化较大,对药物的稳定性有较高的要求,因此,不适合装载多肽、蛋白类大分子药物或其它热敏性物质。
静电喷射是利用静电力将液体流破裂为带电液滴的技术。在过去的几十年里,该技术已广泛应用在燃料喷雾、喷墨印刷和细胞固定等领域。高分子溶液、乳液,以及固体粒子悬浮液都可用静电喷射,并且对水溶性和非水溶性高分子都适用[5-7]。该工艺简便高效、条件温和,且具有控制微粒的形状、表面形貌及粒径大小等优良特性[8-10],特别是其制备的微粒具有高度稳定的单分散性,其释放行为往往能被更准确控制。另外,本文引入一种抗溶剂的概念。当溶解于有机溶剂的聚合物溶液泵入非溶剂体系中,两者快速接触,可提高聚合物的饱和度,继而迅速沉析、固化形成聚合物微球[11]。
鉴于静电喷射在制备聚乳酸微球的独特优势,借助高压微胶囊成型装置,引进抗溶剂概念,本研究采用高压静电抗溶剂法制备聚乳酸微球。通过Minitab 软件设计全因子试验确定微球制备工艺参数中具有显著影响的因素,并考察显著因素对微球形貌、粒径的影响。在考察的操作条件下,研究了不同聚乳酸分子量/浓度对微球形貌及粒径分布的影响。最后,用FTIR、XRPD对制备前后聚乳酸的结构变化进行表征。
1 实验部分
1.1 试剂与仪器
L-聚乳酸(PLLA,Mw分别为1.1万,3万,5万,7.6万,10万,济南岱罡生物工程有限公司);乙醇和二氯甲烷均为分析纯,购自国药集团。
高压微胶囊成型装置(自制);AJ5805微量注射泵(上海安吉电子设备有限公司);BS210S电子分析天平(德国 Sartorius);FDU-2100 冷冻干燥仪(日本东京理化器械株式会社);TGL-18M台式高速冷冻离心机(湖南凯达科学仪器有限公司);S-4800扫描电子显微镜(日本Hitachi);X射线衍射仪(荷兰帕纳科公司);FTIR 8400S傅里叶变换红外光谱仪(日本Shimadzu)。
1.2 聚乳酸微球的制备
高压静电抗溶剂过程如图1所示。高压静电装置的输出电压为0~10 kV,微量注射泵推进速度为1~99 mm/h。高压发生器的正极接注射器针头,负极接大口径铁制容器。容器内装大体积的无水乙醇,注射器内装聚乳酸溶液。输液泵以一定的速度向下推压聚乳酸溶液,在电场力的作用下,聚乳酸溶液克服黏滞力和表面张力,呈一定粒径的液滴。电喷产生的液滴垂直滴入到接收容器中,沉析固化形成聚乳酸微球。离心收集样品,冷冻干燥。
高压静电抗溶剂法的过程基本同静电喷射法,不同之处在于无水乙醇代替接收铝板,吸收溶解溶液中的有机溶剂,使喷出液滴中的溶剂急速膨胀,从而使聚乳酸过饱和,有助于加快聚乳酸微球的固化且收集方便、不易粘连。
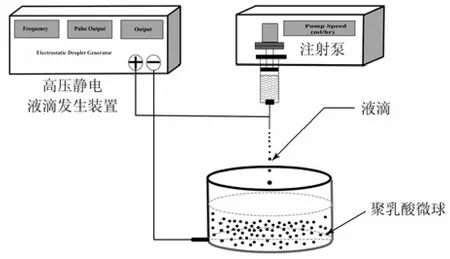
图1 高压静电抗溶剂过程
1.3 实验设计
影响静电喷射产生的聚合物微粒形态/粒径的因素有:电压、聚合物分子量、浓度、流速、溶剂类型、针头内径、接收距离。如表1所示,以二氯甲烷为有机溶剂,选用10万相对分子质量聚乳酸,浓度为30 g/L,24全因子试验设计考察输出电压、推进速度、针头内径、接收距离4个变量及其相互作用对微粒粒径和粒径分布的显著性影响。在预实验的基础上设计了变量的高低水平,而4个中心点实验的设计是为了评估过程的差异。采用MINITAB 15.0 版本,对试验数据进行方差分析。

表1 实验因子和实验水平
1.4 聚乳酸微球的形貌及粒径表征
聚乳酸微球由扫描电镜检测形貌,将冻干的粉末样品置于铜台的导电胶上,喷金测试;根据扫描电镜图片,用软件Adobe photoshop CS4分析微球的粒径和粒径分布。根据药典规定,选择500个微球,对其进行标记并测量其直径。
1.5 制备前后聚乳酸的红外光谱测定和 X射线粉末衍射分析
取等量的PLLA原材料和PLLA微球,以KBr压片法制备样品,在波数为4000~400 cm―1范围内经傅里叶变换红外光谱仪测试,记录红外光谱。
将PLLA原材料和PLLA微球分别均匀装入石英样品皿(约5 mm深)中,用特制的玻璃板将粉末整平、压实,平放在样品测试台上测试。铜靶Kα1(λ=1.540598 Å)辐射;镍(Ni)滤波片;NaI闪烁计数器;PSD位敏探测器;管电压40 kV,管电流40 mA;连续扫描,扫描范围5°~50°,扫描速度 Δ2θ=0.2°/s。
2 结果与讨论
2.1 聚乳酸微球的粒径和粒径分布
表2为平均粒径和粒径分布的实验结果,Span定义为(D90-D10)/D50,Span越小,粒径分布越窄。
图2(a)表示平均粒径的主效应图,图 2(b)表示标准化效应的正态图。从图2 (a)中可看出,聚乳酸微球平均粒径随着溶液推进速度、针头内径、接收距离的增大而增大,特别是推进速度的斜率比较大。而在测试范围内,聚乳酸微球平均粒径随着电压增大而减小。Fukui等[12]报道海藻酸钠/壳聚糖微胶囊的粒径随着推进速度、针头内径、针尖与液面距离的增大而增大,随电压的增大而减小,与本工作的结果一致。图2(b) 为标准化效应的正态图,B点即溶液推进速度离斜线最远,表明溶液推进速度是影响PLLA微球粒径最显著的影响因素,而D点、AD点也是较显著的影响因素。AD为显著性因素,说明A电压和D接收距离有交互作用,电压越高,接收距离越低,越有利于小粒径微球的形成。这是因为在相同电压下,接收距离越短,电场强度就越大,相当于提高电压。Minitab全因子试验结果表明溶液推进速度越小,接收距离越低,越有利于形成均一及小粒径的微球。

表2 Minitab全因子试验结果
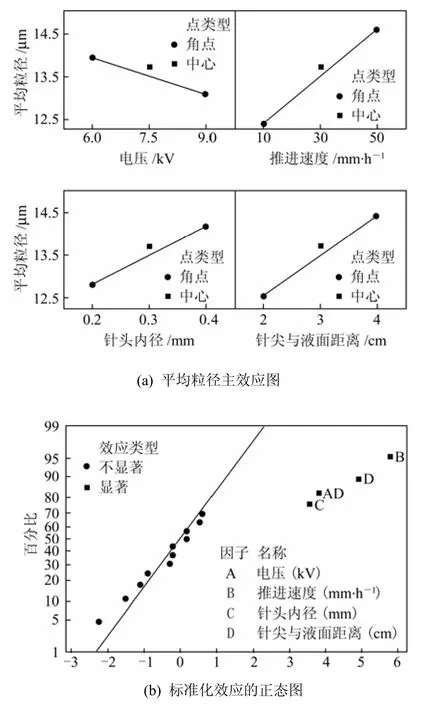
图2 Minitab分析
2.2 聚乳酸微球的表面形貌
2.2.1 推进速度对微球表面形貌的影响

图3 不同推进速度下所制得的聚乳酸微球的扫描电镜图

图4 最优条件下制备的聚乳酸微球的表面形貌和粒径分布
在其它条件不变的情况下,推进速度的变化导致相同时间内挤出的聚合物溶液的量发生变化,推进速度越小,微球粒径越小。图3是在固定电压为9 kV,聚乳酸相对分子质量为10万,浓度为30 g/L,针头内径为0.26 mm,接收距离为40 mm等条件下,分别在10 mm/h和50 mm/h的推进速度下制得的聚乳酸微球。从 SEM 图可知,微球的球形度良好,表面光滑;随着推进速度的增大,粒径分布变宽,同时较大粒径微球的数量增多,这很可能是静电喷射过程中随着推进速度的不断增大,造成液滴流容易产生横向或扭曲不稳定性[13-14]。静电喷射制备微球的文献报道中,在影响微球粒径的所有参数中,控制粒径大小最理想、最方便调节的参数就是推进速度。
2.2.2 最优参数下聚乳酸微球的形貌和粒径
根据 Minitab软件分析全因子试验结果可知,在电压为9 kV,聚乳酸相对分子质量为10万,浓度为30 g/L,推进速度为10 mm/h,针头内径为0.20 mm及接收距离为20 mm等条件下,能得到表面光滑、球形度好、粒径分布窄的单分散聚乳酸微球,平均粒径为9.27 µm,span为0.80,见图4。
2.3 聚乳酸分子量/浓度对微球形貌、粒径的影响
在电压为9 kV,推进速度为50 mm/h,聚乳酸浓度为30 g/L,针头内径为0.26 mm,针尖与液面距离为20 mm的操作条件下,分别选取相对分子质量为1.1万、3万、5万、7.6万和10万的聚乳酸,制备得不同分子量的聚乳酸微球。结果表明1.1万和3万相对分子质量的聚乳酸形成颗粒形状较不规则,较多碎片颗粒形成,表面不光滑,粒径分布不均匀。7.6万相对分子质量聚乳酸形成的微球粒径较5万、10万相对分子质量小,且球形度较好。总体来说,相对分子质量为5万~10万的聚乳酸能够形成球形度较好、粒度较均匀的微球(图 5)。

图5 不同相对分子质量所制得的聚乳酸微球的扫描电镜图

图6 不同浓度下所制得的聚乳酸微球的扫描电镜图
聚乳酸浓度高,含量高,黏度大,在相同电压下,液体形成的雾滴较大,使得聚乳酸更不易在有机溶液中移动,传质效果减弱,液滴达到过饱和态的时间加长,所以形成的颗粒粒径较大;并且高浓度的聚乳酸可能会降低电场强度,以致液滴无法被打碎形成更小的液滴,聚合物以纤维形式沉积出来的速率较颗粒形成速率快[15],最终导致无法获得颗粒。所以,高浓度不予考虑。如图6所示,实验结果表明,10 g/L和20 g/L浓度的聚乳酸难于形成球形的微粒。25 g/L、30 g/L和35 g/L的聚乳酸虽然能形成球形的微粒,但是结果表明30 g/L浓度时效果最佳。Taki等[16]已提出聚乳酸溶液,浓度不宜过大,Xie等[17]的研究结论也表明,浓度高的溶液所得颗粒易出现团聚现象,Berkland等[18]则发现,溶液浓度低有助于减小微球粒径,缩小粒径分布。
2.4 FTIR和XRPD分析
PLLA在1759 cm-1处有个特征吸收峰,意味着羰基的振动伸缩,范围在1700~1900 cm-1间,经高压静电抗溶剂法处理后,微球的特征吸收峰未转移,振动范围没变化,证明无明显结构摄动,见图7。
从图8可知,经高压静电处理后的PLLA微球与原料PLLA相比,晶体结构方面未发生明显变化。Koushik等[19]和Kang等[20]亦有类似的结果报道。
3 结 论
采用高压静电抗溶剂法成功制备出表面光滑、球形度好、粒径均一的聚乳酸微球。

图7 原料PLLA和PLLA微球的红外光谱图

图8 原料PLLA和PLLA微球的XRD图谱
通过MINITAB软件设计全因子试验对影响聚乳酸微球粒径的制备工艺参数进行了显著性分析。显著影响微球粒径的3个因素是:推进速度、接收距离、电压和接收距离的交互作用。浓度为30 g/L,相对分子质量为5万~10万的聚乳酸条件下制备的微球,球形度优良。
经过高压静电处理后,傅里叶红外光谱测定表明,聚乳酸无明显结构摄动;X射线粉末衍射分析表明,聚乳酸晶体结构未发生明显变化。
[1] Timko B P,Whitehead K,Gao W,et al. Advances in drug delivery[J]. Annual Review of Materials Research,2011,41(1):1-20.
[2] 裘迪,朱宏. 乳酸类载紫杉醇纳米粒表面修饰的研究进展[J]. 化工进展,2009,28(7):1198-1201.
[3] 赵杨锋,马利福,黄启谷,等. 活性/可控聚合方法合成生物医用高分子材料研究进展[J]. 化工进展,2009,28(7):1202-1207.
[4] 刘俊,刘义荣. 聚乳酸的合成及应用[J]. 生物医学工程杂志,2001,8(2):286-287.
[5] Xu Y X,Hanna M A. Electrospray encapsulation of water-soluble protein with polylactide:Effects of formulations on morphology,encapsulation efficiency and release profile of particles[J].International Journal of Pharmaceutics,2006,320(1-2):30-36.
[6] Arnold M M,Gorman E M,Schieber L J,et al. NanoCipro encapsulation in monodisperse large porous PLGA microparticles[J].Journal of Controlled Release,2007,121(1-2):100-109.
[7] Wang S B,Chen A Z,Weng L J,et al. Effect of drug-loading methods on drug load,encapsulation efficiency and release properties of alginate/poly-l-arginine/chitosan ternary complex microcapsules[J].Macromolecular Bioscience,2004,4(1):27-30.
[8] Almeria B,Deng W W,Fahmy T M,et al. Controlling the morphology of electrospray-generated PLGA microparticles for drug delivery[J]. Journal of Colloid and Interface Science,2010,343(1):125-133.
[9] Hartman R P A,Borra1 J P,Brunner D J,et al. The evolution of electrohydrodynamic sprays produced in the cone-jet mode,a physical model[J]. Journal of Electrostatics,1999,47(3):143-170.
[10] Kuo S M,Niu G C C,Chang S J,et al. A one-step method for fabricating chitosan microspheres[J]. Journal of Applied Polymer Science,2004,94(5):2150-2157.
[11] York P. Strategies for particle design using supercritical fluid technologies[J]. Pharmaceutical Science & Technology Today,1999,2(11):430-440.
[12] Fukui Y,Maruyama T,Iwamatsu Y,et al. Preparation of monodispersed polyelectrolyte microcapsules with high encapsulation efficiency by an electrospray technique[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects,2010,370 (1-3):28-34.
[13] Xie J W,Lim L K,Phua Y Y,et al. Electrohydrodynamic atomization for biodegradable polymeric article production[J]. Journal of Colloid and Interface Science,2006,302(1):103-112.
[14] Xie J W,Marijnissen J C M,Wang C H. Microparticles developed by electrohydrodynamic atomization for the local delivery of anticancerdrug to treat C6 glioma in vitro[J]. Biomaterials,2006,27(17):3321-3332.
[15] Meng F Z,Jiang Y,Sun Z H,et al. Electrohydrodynamic liquid atomization of biodegradable polymer microparticles:Effect of electrohydrodynamic liquid atomization variables on microparticles[J]. Journal of Applied Polymer Science,2009,113(1):526-534.
[16] Taki S,Badens E,Charbit G. Controlled release system formed by supercritical anti-solvent coprecipitation of a herbicide and a biodegradable polymer[J]. The Journal of Supercritical Fluids,2001,21 (1):61-70.
[17] Xie J W,Wang C H. Encapsulation of proteins in biodegradable polymeric microparticles using electrospray in the Taylor Cone-Jet mode[J]. Biotechnology and Bioengineering,2007,97(5):1278-1290.
[18] Berkland C,Pack D W,Kim K. Controlling surface nano-structure using flow-limited field-injection electrostatic spraying (FFESS) of poly (d,l-lactide-co-glycolide)[J]. Biomaterials,2004,25(25):5649-5658.
[19] Koushik K,Kompella U B. Preparation of large porous deslorelin-PLGA microparticles with reduced residual solvent and cellular uptake using a supercritical carbon dioxide process[J].Pharmaceutical Research,2004,21(3):524-535.
[20] Kang Y Q,Wu J,Yin G F,et al. Characterization and biological evaluation of paclitaxel-loaded poly(L-lactic acid) microparticles prepared by supercritical CO2[J]. Langmuir,2008,24(14):7432-7441.
Development of poly (L-lactide) microspheres in high-voltage electrostatic antisolvent process
CHEN Aizheng1,2,YANG Yuemei1,WANG Shibin1,2,SUN Qingqing1,LIU Yuangang1,2,DANG Tingting1
(1School of Chemical Engineering,Huaqiao University,Xiamen 361021,Fujian,China;2Institute of Biomaterials and Tissue Engineering,Huaqiao University,Xiamen 361021,Fujian,China)
An antisolvent,absolute ethyl alcohol was used in the high-voltage electrostatic antisolvent process to prepare poly (L-lactide) microspheres. A 24factorial experiment was designed to investigate and identify the relative significance of the processing parameters on particle size and particle size distribution of the products. The results indicated that the effect of push speed was dominant in the results regarding particle size. After optimization,the resulting poly (L-lactide) microspheres exhibited good spherical shape,smooth surface and narrow particle size distribution. When the concentration and molecular weight of poly (L-lactide) were 3% (w/v) and 50~100 kDa respectively,the resulting microspheres showed good spherical shape. Fourier transform infrared (FTIR) spectroscopy measurement found no significant structural perturbation. X-ray powder diffraction (XRPD) analysis revealed no significant crystal structural changes.
high-voltage eletrostatic system;anti-solvent;poly (L-Lactide);factorial experiment
R 318
:A
:1000-6613(2012)09-2024-07
2012-04-16;修改稿日期:2012-06-08。
国家自然科学基金(51103049,81171471,31170939)及福建省自然科学基金(2010J05027,2011J01223)项目。
陈爱政,博士,副教授,主要从事药物缓控释体系与组织工程方面的研究。联系人:王士斌,教授,博士生导师,主要从事生物材料与组织工程方面的研究。E-mail sbwang@hqu.edu.cn。

