嘧啶基黄药的制备与表征*
郭 蒙,王会勤,岳 佳,王 超,曹莹莹
(1.潍坊学院,山东 潍坊 261061;2.中国矿业大学,江苏 徐州 221008)
黄药又名黄原酸盐,在常温下是黄色粉末状固体,常因杂质存在颜色稍深。黄药最早由Keller合成于20世纪20年代,迄今为止,其工业化生产方法有很多种:结晶法、直接合成法、湿碱法、稀释剂法、实用新型反应器法、过量醇法、碱金属醇法、蒸气法等[1-2]。黄药一般是用醇、酚等在强碱性条件下与二硫化碳反应制得,通式为:

R表示脂肪族或芳香族烃基,M表示碱金属阳离子。
黄药用途广泛,工业上主要用作有色金属或稀有金属矿石浮选的有效捕收剂,也可用作橡胶硫化促进剂;农业上用于作物的干燥剂;在医药上可用作医用防腐剂及杀菌剂,如黄原酸钾是医药甲砜霉素的中间体[3-4]。黄药的衍生物用途更加广泛,如纤维素基黄原酸钠可用于人造纤维[5],淀粉基黄原酸盐用于污水处理[6]等,因此,研制开发新型黄药具有重要意义。本文先从硫脲、乙酰丙酮反应出发,合成了4,6-二甲基嘧啶-2-硫醇,再与二硫化碳在强碱性条件下反应合成出一种新型黄药,并通过熔点测定、红外光谱、热重分析、元素分析等对其进行了初步表征。
1 实验部分
1.1 仪器与试剂
乙酰丙酮,AR,天津市科密欧化学试剂有限公司;硫脲,AR,天津市海晶精细化工厂;二硫化碳,AR,成都市科龙化工试剂厂;其他试剂均为分析纯。
FT-IR380傅立叶变换红外光谱仪,Nicolet America公司;Elementary VarioEL元素分析仪,美国PE公司;HCT-2型微机差热天平,北京恒久科学仪器厂;DHT型搅拌调温电热套,鄄城华鲁电热仪器有限公司;WRS-2A/2显微熔点仪,上海精密科学仪器有限公司;ZKXF-2型真空干燥箱,上海树立仪器仪表有限公司。
1.2 实验步骤
1.2.1 4,6―二甲基嘧啶―2―硫醇的合成
在装有温度计、搅拌及冷凝装置的250ml四颈烧瓶中,加入等摩尔的硫脲和乙酰丙酮,加入150ml乙醇,搅拌一段时间后溶液呈无色,再加入6.5ml盐酸,回流下加热搅拌反应2小时。反应完毕后,将溶液在室温下冷却过夜,析出大量细小明亮的黄色晶体。抽滤,蒸馏水洗三次,30℃下真空干燥,得到黄色产品,产率74%。熔点217℃(文献[7]为218℃)。
1.2.2 黄药(4,6―二甲基嘧啶―2―三硫代碳酸钠)的合成
在250ml的烧瓶中加入0.03mol 4,6―二甲基嘧啶―2―硫醇和0.03mol氢氧化钠,加入50ml甲苯,电磁搅拌下加热到60-70℃,1小时内将0.06mol二硫化碳滴加到上述溶液中,溶液渐渐变为棕黄色。滴加完毕后,电磁搅拌回流120min,然后室温下冷却,抽滤,30℃下真空干燥,得浅黄棕色固体,产率81%。熔点在300℃以下没有测出。
2 结果与讨论
2.1 嘧啶基黄药的表征
元素分析,C7H7N2S3Na,实测值(计算值),%:C 34.87(35.28),H 3.15(2.96),N 11.81(11.76)。元素分析结果初步表明已经合成了目标产物,但H元素含量偏高,可能与产物中含有结晶水有关。从热重分析图(见图1)中也可看出,产物在60—110℃内出现了明显的失重,说明有大量结晶水失去。
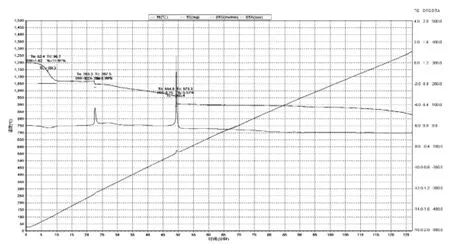
图1 热重分析图
对目标产物用KBr压片法(IR)在4000cm-1—400cm-1范围内扫描进行了红外结构测定[8],结果见图2、图3。在图2中,3438cm-1处为—SH的吸收峰,2915cm-1和1459cm-1、1384cm-1处分别是对应—CH3的伸缩振动和弯曲振动的吸收峰,其中由于在嘧啶环上吸电子的影响,使-CH3在2960cm-1的吸收峰位置移向了较低波数2915cm-1。在1569cm-1和1625cm-1处出现了嘧啶环上骨架振动的吸收峰,1221cm-1则属于—C—S的的吸收峰。图3为黄药的谱图,图中3333cm-1处出现了一个延续相当长的二硫代羧酸的吸收峰,与图2的红外谱图比较可以看出,二硫代羧酸的吸收峰将—CH3的伸缩振动峰覆盖了;由于嘧啶环以及嘧啶环上三硫代碳酸取代基吸电子的影响,使—CH3弯曲振动的吸收峰由1459cm-1、1384cm-1移动到1437cm-1,1343cm-1处;同时,也由于三硫代碳酸取代基吸电子的影响,使嘧啶环上骨架振动的吸收峰由1569cm-1和1625cm-1移动到1533cm-1和1577cm-1处;—C—S键吸收峰则由于受到嘧啶环和二硫代羧酸基团的共同影响有1221cm-1移动到了1244cm-1处。红外分析结果表明,已经合成了目标产物。
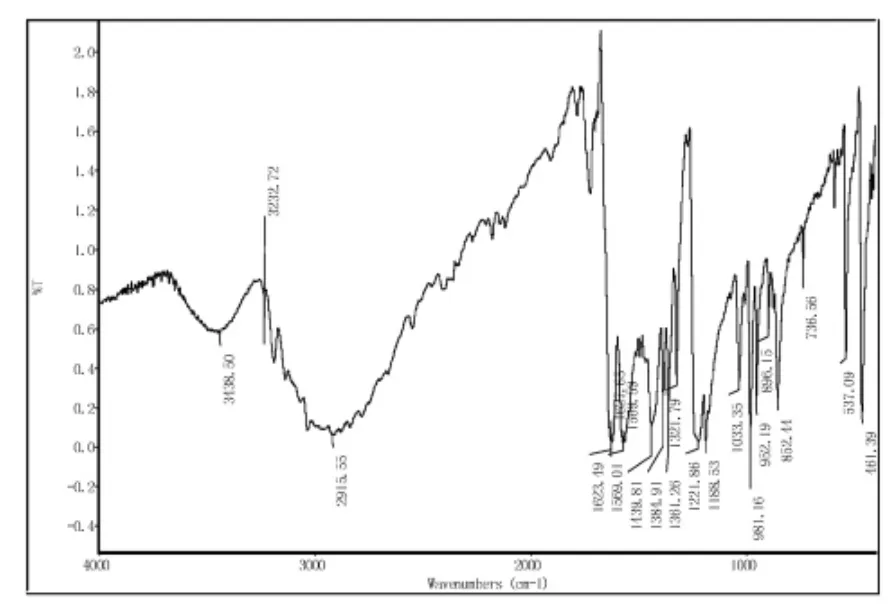
图2 4,6-二甲基嘧啶-2-硫醇红外谱图
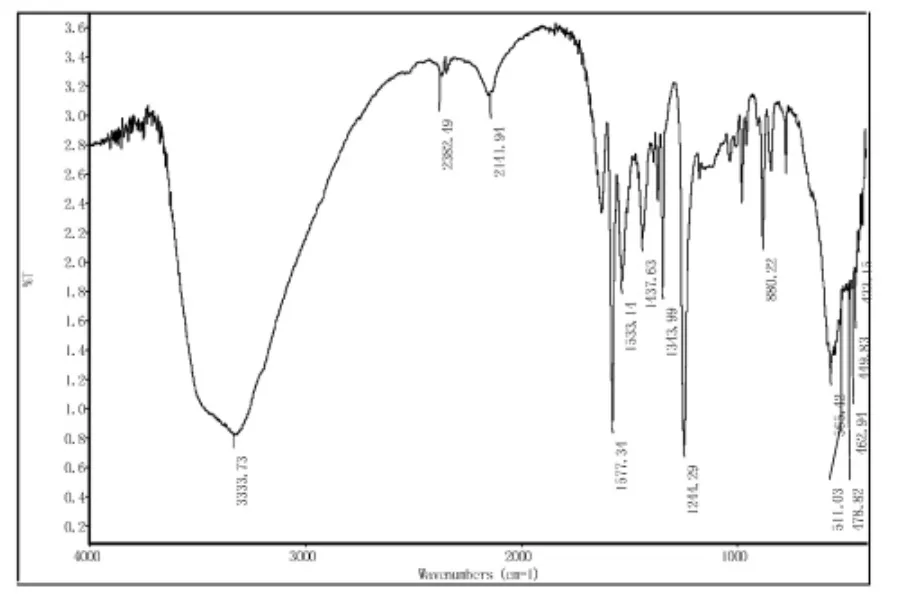
图3 黄药红外谱图
2.2 实验条件研究
2.2.1 4,6―二甲基嘧啶―2―硫醇合成方法的改进
4,6―二甲基嘧啶―2―硫醇的合成方法有三种[9-10],通过比较,研究温度与时间对反应产率的影响,优化了合成条件。
2.2.1.1 温度的选择
固定反应物的配比为1∶1、浓HCl体积1ml、溶剂50ml,分别在不同温度及回流条件下进行合成反应,反应2小时,结果见表1。由表1可以看出,75℃以后产率几乎不变。由于回流条件下温度易于控制,因此确定在回流条件下进行反应。

表1 反应温度与产率的关系
2.2.1.2 反应时间的选择
固定反应物配比1∶1、浓HCl体积1ml、溶剂50ml,在回流条件下,考察了不同反应时间对产率的影响,结果见表2。由表2可以看出,反应120min后产物产率已至最高峰,时间再延长而产率变化不大,因此选择反应时间为120min。

表2 反应时间与产率的关系
通过实验,确定了最佳反应条件为:反应物配比1∶1、1ml浓盐酸、适量体积的乙醇,回流条件下反应120min。
2.2.2 黄药合成的研究
2.2.2.1 溶剂的选择
稀释剂法合成黄药时,稀释剂多采用苯、汽油等,由于苯、汽油沸点低,挥发性强,对人体危害大,故实验中稀释剂选用了甲苯;在其他条件固定的情况下,分别以苯、甲苯为稀释剂进行实验,其产率为81.7%和81%,说明改用稀释剂后产率变化不大。
2.2.2.2 反应物配比的选择
由于4,6―二甲基嘧啶―2―硫醇不溶于该反应环境下的溶剂,且生成的产物亦不溶于溶剂中,故采用二硫化碳过量的方式。反应物不同配比S与产率R的关系见图4,由图4可确定4,6―二甲基嘧啶―2―硫醇与二硫化碳的配比以1∶2为宜。
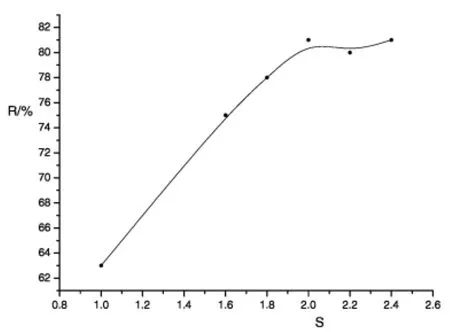
图4 反应物配比与产率的关系
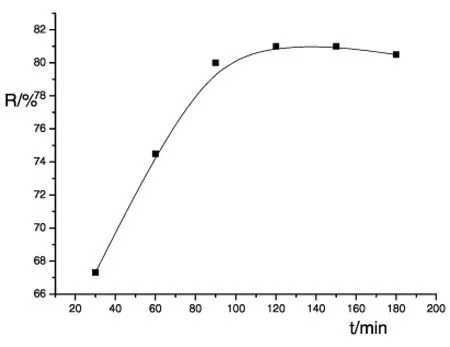
图5 反应时间与产率的关系
2.2.2.3 反应时间的影响
在其他条件不变的情况下,对反应时间进行了研究,结果见图5,由此确定反应时间以120min为宜。
2.2.2.4 温度的影响
固定其他反应条件不变,研究了反应产率与温度的关系,结果见图6,由此可确定反应温度在60—70℃之间比较合适。
2.2.2.5 其他条件的选择
固定其他反应条件,分别对CS2滴加时间、干燥方式进行了研究,实验发现如果CS2一次性加入或分批加入,将会由于放热过度得不到释放而引起爆沸,故CS2采用在1h内滴加的方式加入。由于目标产物在常压下干燥发生部分变色现象,因此对产物采用在30℃下进行真空干燥的方式。
通过实验,确定了反应的最佳条件为:以甲苯为稀释剂,反应物配比1∶2、CS2在1h内滴完后,于60—70℃反应120min。
3 结论
以乙醇为溶剂,硫脲、乙酰丙酮为原料,在盐酸催化下合成4,6―二甲基嘧啶―2―硫醇,并使其与过量二硫化碳在强碱性条件下反应合成新型黄药(4,6―二甲基嘧啶―2―三硫代碳酸钠)。通过对合成条件进行优化,确定4,6―二甲基嘧啶―2―硫醇的反应条件为:硫脲与乙酰丙酮的摩尔比为1∶1,加入适量盐酸,75℃下反应2h,产率达74%。新型黄药的反应条件为:4,6―二甲基嘧啶―2―硫醇与CS2配比1∶2,在1h内滴完CS2后,然后在60—70℃反应2h,产率达81%。该方法对有色金属及矿石浮选有一定的应用参考价值。
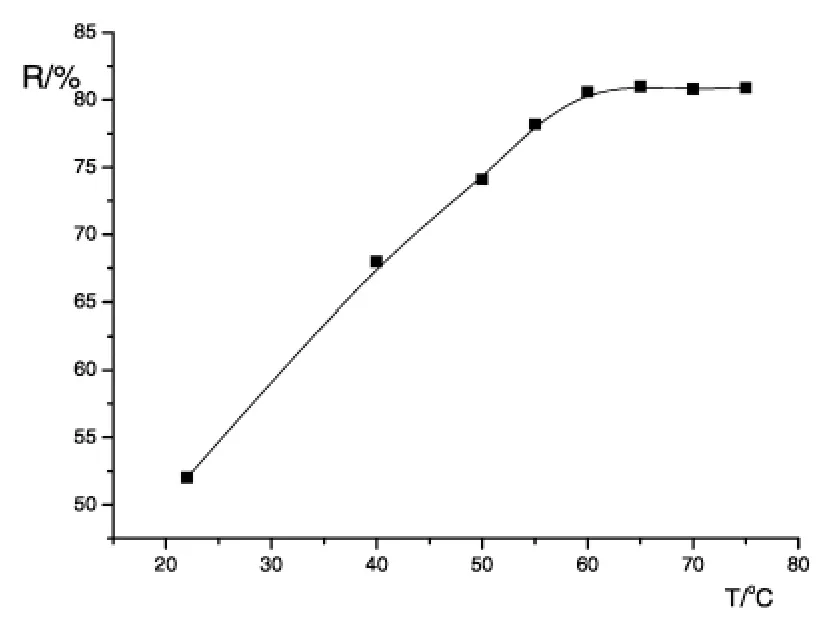
图6 反应温度与产率的关系
[1]朱玉霜,朱建光.浮选药剂的化学原理[M].长沙:中南工业大学出版社,1987:16-17.
[2]李刚.黄药的生产方法概述[J].安徽化工,2002,118(4):7-8.
[3]刘龙利.黄药的研究与应用概述[J].国外金属矿选矿,2005,(7):11-12.
[4]吴世敏,印德麟.简明精细化工大辞典[M].沈阳:辽宁科学技术出版社,1999:641.
[5]韩巧凤,番寿龙,杨绪杰,等.芳香族黄原酸盐的合成及萃取性能研究[J].江苏化工,2002,30(7):33-34.
[6]龚盛昭.淀粉基黄原酸盐合成新工艺及其在废水处理中的应用[J].化工环保,2001,21(2):95-97.
[7]Nigam S C,Saharia G S,Sharma H R.Studies in heterocyclic compounds.Part-XXXⅧ:Synthesis and in vitro screening of 4,6-dimeth-5-(arylazo/N-substituted p-sulphamylbenzeneazo)pyrimidin-2-thiols[J].J Indian Chem Soc,1983,60(6):583.
[8]宁永成.有机化合物结构鉴定与有机波谱学[M].2版.北京:北京科学出版社,2004:32-335.
[9]黄亚玲,李芬芳,余慧,等.4,6-二甲基-2-巯基嘧啶合成方法的改进[J].化学与生物工程,2007,24(20):67-70.
[10]李在国,汪清民,黄君珉.有机中间体制备[M].2版.北京:化学工业出版社,2001:182.

