不同水分条件下沙漠豆生理指标的变化
卜楠,俞丽蓉,马万里,†,王铁娟,周鸿升,毕建瓴,孙克
(1.北京林业大学,100083,北京;2.内蒙古师范大学生命科学与技术学院,010022,呼和浩特;3.国家林业局林产工业规划设计院,100714,北京;4.内蒙古自治区国土资源信息院,010010,呼和浩特;5.北京水保生态工程咨询有限公司,100055,北京)
不同水分条件下沙漠豆生理指标的变化
卜楠1,俞丽蓉2,马万里2,3†,王铁娟2,周鸿升3,毕建瓴4,孙克5
(1.北京林业大学,100083,北京;2.内蒙古师范大学生命科学与技术学院,010022,呼和浩特;3.国家林业局林产工业规划设计院,100714,北京;4.内蒙古自治区国土资源信息院,010010,呼和浩特;5.北京水保生态工程咨询有限公司,100055,北京)
运用常规的植物生理抗旱性测定方法,对引种植物沙漠豆在不同土壤水分梯度下叶片中的可溶性糖、可溶性蛋白质、脯氨酸以及过氧化氢酶(CAT)活性,超氧化物歧化酶(SOD)活性和过氧化物酶(POD)3种保护酶等指标的变化进行研究。结果表明:1)脯氨酸含量随干旱胁迫程度的增强逐渐升高,可溶性蛋白质先降低后升高,二者之间存在相互补偿关系,可溶性糖含量呈现先升高再降低的变化趋势,表现出渗透调节物质对干旱的调节作用;2)3种保护酶活性在不同水分处理过程中变化不同,CAT活性表现为升高,SOD在中度干旱水分条件下升高,至重度干旱水分条件下则降低,POD活性的变化与SOD活性变化相反,保护酶之间相互配合协同作用维持了沙漠豆叶片细胞膜的完整性;3)丙二醛浓度随干旱胁迫程度的增强而升高,表明沙漠豆随水分不足可以通过增加渗透调节物质含量、增强保护酶活性、提高抗氧化能力,来减轻干旱胁迫的伤害。
沙漠豆;干旱胁迫;生理指标
干旱胁迫影响植物的生长和发育,植物抗旱性的探究成为各国学者的研究热点之一。沙漠豆(又叫澳洲苦马豆,Swainsona formosa(Sturt’s desert pea))属于豆科苦马豆属草本植物,因其花色艳丽,观赏价值高,被确定为澳大利亚南澳州的州花。该植物生长适应性强,可耐受澳大利亚中部的干旱气候,在澳大利亚中南部和西北部分布最多,并适应沙漠环境。我国北方干旱半干旱地区自然生态环境条件差,急需适宜生长的优良固沙植物和耐干旱植物,在我国北方地区分布的苦马豆(Swainsona salsulaDC.)与澳洲苦马豆是同属近缘种关系,其防风固沙生态保护等方面具有重要的作用,但其观赏性远远不如澳洲苦马豆。本文对引入我国的沙漠豆的水分生理特性进行研究,探讨其在不同水分条件下的生理特点与适应性,对我国如何利用和开发这一兼具观赏和生态价值的引种植物具有重要意义。
1 材料和方法
2010年从澳大利亚Austrahort Pty Limited公司引进沙漠豆种子,并于5月20日开始实验室种植。沙漠豆种子用70~80℃的水冲泡30 min后,转入到50~60℃的温水中浸泡12~24 h,待种子完全吸胀后,选饱满者播种于口径为20 cm的花盆中,每盆播种3株,播种深度0.6~1.0 cm。沙漠豆在原产地澳大利亚主要生长在沙质土中,本实验的播种土壤为模拟的混合土(蛭石、泥炭、砂子质量比=1∶1∶2),土壤pH值为7.34,有机质质量含量30.44 g/kg,全氮质量含量37.2 g/kg,全磷质量含量0.16 g/kg,全钾质量含量0.52 g/kg。待全部出苗后正常生长到盛叶期后,选取生长表现较为一致的沙漠豆18盆,进行不同水分条件的设计,按3个水分梯度处理,即:每天浇水1次、每2天浇水1次和每3天浇水1次,每个处理6盆。每盆浇水量为每次400 mL,将苗木浇透,9 d为一个处理周期。本研究将每天浇水1次视为对照(CK)、每2天浇水1次视为中度干旱水分条件(M1)、每3天浇水1次视为重度干旱水分条件(M2)。每个处理3次重复。在处理4个周期后测定,当对照(CK)的含水量为(29.15±6.18)%时,M1降为(20.08±3.22)%,M2则降到(12.76±3.46)%。
采用随机取样的方法,取植物下部叶,迅速剪碎混合均匀,装袋编号,放入液氮罐中保存,供实验取用。丙二醛浓度采用硫代巴比妥酸法测定;还原糖含量采用蒽酮比色法测定;游离脯氨酸含量采用磺基水杨酸法提取,酸性茚三酮比色法测定;可溶性蛋白质含量采用考马斯亮蓝G-250法(Bradford法)测定;过氧化氢酶(CAT)活性采用紫外吸收法测定;超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)法测定;过氧化物酶(POD)活性采用愈创木酚法测定[1-2]。
2 结果和分析
2.1 不同水分条件对沙漠豆丙二醛浓度的影响
植物体在盐胁迫或水分干旱环境等逆境中,会产生膜质过氧化产物丙二醛(MDA),植物体内丙二醛浓度在一定程度上反映了其对植物细胞膜的伤害程度,同时也能表现出植物对逆境胁迫的适应能力。沙漠豆在不同水分条件下叶片MDA浓度见图1。可以看出,干旱胁迫加剧使MDA浓度呈现上升变化趋势,在M2水平胁迫下MDA浓度最高,沙漠豆叶片中MDA浓度伴随着土壤水分减少而逐渐升高,膜质过氧化产物之一的MDA浓度越高,表明植物受伤害程度越大。由此说明,沙漠豆在缺水干旱时发生了明显的过氧化作用,且M2水平胁迫造成的膜质过氧化程度最严重,沙漠豆叶片中MDA的积累与植物受干旱胁迫程度的严重性呈正相关性,这一结论与很多植物在干旱胁迫下的表现一致[3-4]。

图1 不同水分条件下沙漠豆丙二醛浓度的变化Fig.1 Changes of the content of MDA of Swainsona formosa under different water conditions
2.2 不同水分条件对沙漠豆细胞渗透调节物质的影响
2.2.1 脯氨酸质量含量的变化 渗透调节是细胞抵御干旱逆境胁迫的一种重要方式,当植物在干旱等逆境环境时脯氨酸的积累、可溶性糖的积累[3],以及可溶性蛋白质质量含量的变化在一定程度上均反映出植物的适应性变化。
逆境条件下植物体内脯氨酸(Pro)含量增加与其抗性相关,抗旱性强的植物往往积累较多的脯氨酸[5],从图2可以看出,随着土壤含水量的降低,沙漠豆叶片脯氨酸质量含量显著增加。本实验结果说明在M1和M2水平下脯氨酸出现了一定程度的积累,其质量含量均高于对照样本,可见,脯氨酸的积累与所受的干旱胁迫水平呈正相关,与土壤含水量呈负相关,脯氨酸质量含量随着土壤含水量的降低呈现递增趋势,水分越少,脯氨酸的累积现象越明显。张志艳等[6]认为干旱对蛋白质的合成产生影响,抑制了脯氨酸参与蛋白质的合成作用,所以植物体内脯氨酸质量含量表现为升高趋势。
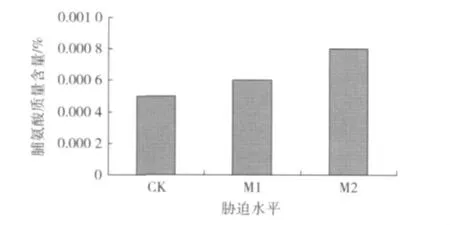
图2 不同水分条件对沙漠豆脯氨酸质量含量的影响Fig.2 Effect of various drought stresses on the proline content of Swainsona formosa
2.2.2 可溶性糖质量含量的变化 植物在逆境下可以主动积累可溶性糖是利于维持植物体正常生长所需水分的,从而提高植物的抗逆性。图3结果显示,随土壤含水量的降低,沙漠豆细胞可溶性糖质量含量的变化表现为先显著升高,再大幅度降低,且水分在M2水平时可溶性糖质量含量低于对照,说明水分在M2水平对可溶性糖的积累作用影响不大,胁迫程度对细胞渗透调节作用的贡献不明显。可溶性糖质量含量在水分减少时可以降低植物细胞的渗透势,维持植物在干旱环境中正常生长所需的水分,提高其抗逆性[7-8];但是也有研究[9]发现干旱胁迫加剧,可溶性糖质量含量降低。本实验中,沙漠豆的可溶性糖质量含量随着水分的减少,表现出持续升高-降低的变化趋势。这是由于可溶性糖在M1水分条件下主动积累,是保持植物体正常生长所需水分,减少植物受毒害程度的需要;而在M2水分条件下可溶性糖质量含量降低可能与植物呼吸作用有关,当呼吸速率增加,使光合产物含量下降引起了可溶性糖质量含量降低。李予霞[10]对葡萄叶片进行研究时发现,干旱胁迫使幼叶可溶性糖质量含量升高,老叶中可溶性糖质量含量随着胁迫加剧而降低,表现出幼嫩组织适应干旱胁迫。本实验中可溶性糖质量含量在M2水分条件下减少的原因,需要进一步研究探讨。

图3 不同水分条件对沙漠豆可溶性糖质量含量的影响Fig.3 Effect of drought stress on the content of soluble sugar of Swainsona formosa
2.2.3 可溶性蛋白质质量含量的变化 植物在干旱胁迫下也会产生诱导蛋白,增强植物的耐脱水能力,减小植物细胞受伤害程度。由图4可以看出,随土壤含水量的减少,可溶性蛋白质质量含量呈现出降低—升高的变化趋势,这与韩蕊莲等[11]对沙棘叶片可溶性蛋白研究得出的结论基本一致。表明起初的M1水平条件下沙漠豆体内的蛋白质分解代谢大于合成代谢,可溶性蛋白质大量降解,至M2水分条件时,可溶性蛋白质质量含量开始上升,表明沙漠豆体内开始合成蛋白质,对干旱胁迫有一定的适应性,但其质量含量仍然低于对照。本实验中,蛋白质质量含量先下降后上升,下降的幅度较大,与对照相比,差异极显著。可溶性蛋白质质量含量上升主要由于水分胁迫促进了可溶性蛋白质的降解,形成了具有渗透调节功能的脯氨酸等氨基酸。这一点从图2可以看出,在M1水平条件下,可溶性蛋白质质量含量降低而脯氨酸质量含量升高,说明可溶性蛋白质在干旱胁迫下质量含量降低是补偿脯氨酸的质量含量,这与杜金伟等[12]对干旱胁迫下的山杏的研究结论相符合。说明在干旱胁迫下,植物体内渗透调节物质之间会通过各自质量含量的变化进行相互补偿,这种补偿策略也有研究报道显示在可溶性糖和脯氨酸之间存在[13]。
2.3 不同水分条件对沙漠豆保护酶活性的影响

图4 不同水分条件对沙漠豆可溶性蛋白质质量含量的影响Fig.4 Effectof drought stress on the content of soluble protein of Swainsona formosa
1)过氧化物酶活性的变化。过氧化物酶(POD)是植物体内重要的保护酶之一,它能够有效清除植物体内产生的H2O2等过氧化物,防止植物体内产生的过氧化物对细胞膜造成的伤害;因此,它的变化能够说明植物对干旱条件的适应性。图5表明,随土壤含水量的减少,POD活性呈现先下降再上升的趋势。起初随着土壤含水量下降,POD活性超出了自我修复范围,表现出对干旱的不适应,导致POD活性下降,而到达M2水分条件时,POD活性开始增加,并接近达到对照值。这可能与超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性的增加有关。通过这3种保护酶之间相互协调作用,维持了沙漠豆细胞的完整性,降低膜的受毒害程度,使植物更好地适应干旱胁迫。
2)过氧化氢酶活性的变化。H2O2的清除是细胞彻底消除活性氧的关键,过氧化氢酶(CAT)可以将SOD等产生的H2O2转化成H2O,与SOD协同反应,使活性氧维持在较低水平上。从图6可以看出,CAT值随着含水量的减少逐渐升高。说明随着干旱胁迫的增加,沙漠豆可以很好地调动CAT酶,清除生理系统里的H2O2,使沙漠豆对干旱作出一定的响应。
3)超氧化物歧化酶活性的变化。超氧化物歧化酶(SOD)活性是植物抗旱性的重要指标之一。从图7可见,M1水分条件下,沙漠豆的SOD活性较对照略微升高,随着胁迫的加剧,其活性大幅度降低,M2水分条件下,SOD活性对植物体内产生的活性氧自由基的清除能力已大大减弱。由此可见,适度的干旱胁迫能使沙漠豆体内SOD活性增强,是植物对干旱胁迫条件的一种适应性反应;但是,当干旱胁迫程度过大时,自由基的产生与清除之间的平衡失调后,SOD活性便表现为降低,也是一种对过于干旱胁迫时的不适应性。
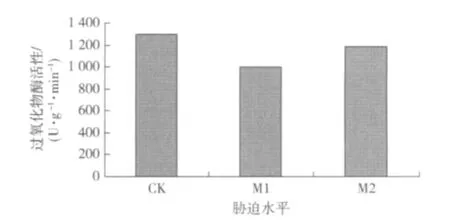
图5 不同水分条件对沙漠豆过氧化物酶活性的影响Fig.5 Effect of drought stress on the POD active of Swainsona formosa
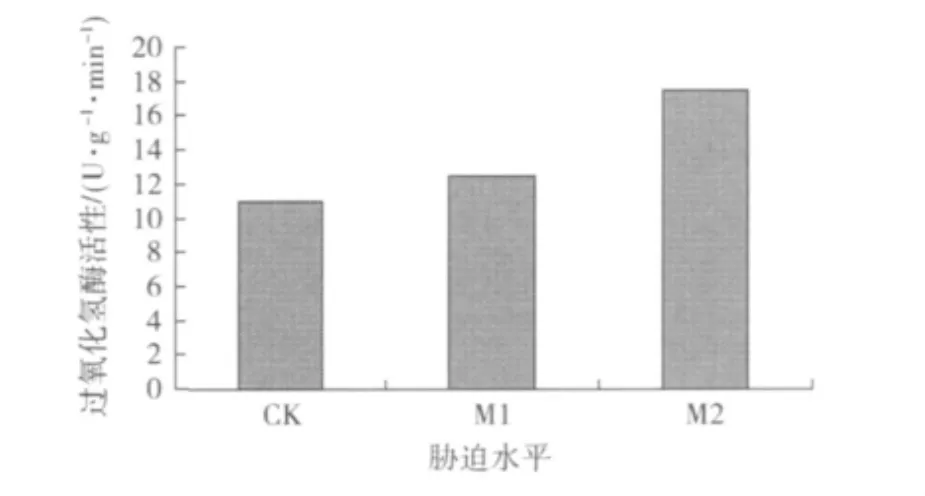
图6 不同水分条件对沙漠豆过氧化氢酶的影响Fig.6 Effect of drought stress on the CAT active of Swainsona Formosa

图7 不同水分条件对沙漠豆超氧化物岐化酶活性的影响Fig.7 Effectof drought stress on the SOD active of Swainsona formosa
细胞内的保护酶系统主要有超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)等,SOD活性的大小能反映植物清除活性氧的总体能力,CAT、POD能分解H2O2。有关保护酶系统与植物耐旱性关系的研究已有不少报道[13-14],结果不尽相同。本试验结果表明,沙漠豆保护酶活性在不同水分条件处理过程中变化不同,CAT表现为逐渐升高,POD活性则在中度胁迫下降,而随着水分进一步减少,POD活性又升高,SOD活性的变化与POD活性变化相反。说明在水分条件下,沙漠豆体内保护酶系统的活性变化不是同步的。SOD活性在M1水分条件时升高,说明其抵御活性氧的伤害作用能力强,消除自由基的能力也较强;而POD活性在M1水分条件下降低,可能由于起初植物对干旱逆境的适应能力差,自由基产生与清除平衡失调。这3种酶相互配合,能够较高效地清除H2O2,确保较低的膜脂过氧化水平,以维持植物细胞膜的完整性,降低膜的伤害率,表现出强的抗旱适应性。
3 结论与讨论
1)沙漠豆在缺水干旱时发生了明显的过氧化作用,随沙漠豆遭受干旱伤害程度不断加重,MDA的积累与植物受干旱胁迫程度的严重性呈正相关性;脯氨酸质量含量随着土壤含水量的降低呈现递增趋势,脯氨酸质量含量高低与所受的干旱胁迫水平呈正相关;可溶性糖质量含量和可溶性蛋白质质量含量表现出的变化不一致,可溶性蛋白质质量含量呈现先降低后升高,而可溶性糖质量含量呈现先升高再降低的变化趋势,渗透调节物质间可能存在相互补偿作用,共同表现出对干旱适应的调节作用。
2)沙漠豆在干旱胁迫时,3种保护酶(SOD、CAT和POD)随水分条件的下降,其各自活性表现出的变化不同;但通过3种保护酶之间的相互协调作用,能够维持沙漠豆叶片细胞膜的完整性,降低膜的受毒害程度。
综上所述,从对沙漠豆在不同水分条件下,其细胞渗透调节物质、保护酶系统以及MDA等生理指标的变化分析可以看出,沙漠豆的各个生理指标通过自身的变化对水分变化会作出一定的响应,并在其生长方面做出适应性的调整。通过研究引种沙漠豆在不同水分条件下其体内生理指标的变化,对沙漠豆抗旱性的全面性了解,以及在干旱区如何开发利用这一资源植物必将产生积极作用。
4 参考文献
[1]卢毅军,朱春艳.植物引种与生态学研究[J].园林科技,2007(3):3-5
[2]张以顺,黄霞,陈云凤.植物生理学实验教程[M].北京:高等教育出版社,2009
[3]惠竹梅,房玉林,郭玉枝,等.水分胁迫对葡萄幼苗4种主要生理指标的影响[J].干旱地区农业研究,2007,25(3):2107-2109
[4]Staffan E J,Henrik V S,Berfl A,et al.Active oxygen produced during seledtive excitation of photosys-tem Ⅰ is damaging not only to photosystem I but also to photosystemⅡ[J].Plant Physiol 2001,125(4):2007-2015
[5]王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006
[6]张志燕,王艳荣,赵利君.土壤水分含量对草坪植物生理指标的影响[J].安徽农业科学,2007,35(25):7779-7780
[7]张超.6种绣线菊的干旱适应性研究[D].哈尔滨:东北农业大学,2008
[8]贺苏华.干旱胁迫对四个红檵木品种生理特性的影响[D].长沙:湖南农业大学,2008
[9]Zhang Jianping,Wang Jinjun,Zhao Zhimo,et al.Effects of Simulated Acid Rain on the Physiology of Carmine Spider Mite,Tetranychus cinnabarinus(Boisduvals)[J].Journal of Applied Entomology,2004,128(5):342-347
[10]李予霞,崔百明,董新平,等.水分胁迫下葡萄叶片脯氨酸和可溶性糖积累与叶龄的关系[J].果树学报,2004,21(2):170-172
[11]韩蕊莲,李丽霞,梁宗锁,等.干旱胁迫下沙棘膜质过氧化保护体系研究[J].西北林学院学报,2002,17(4):1-5
[12]杜金伟,崔世茂,金丽萍,等.水分胁迫对山杏渗透调节物质积累及保护酶活性的影响[J].内蒙古农业大学学报,2009,30(2):88-93
[13]武勇,陈存及,刘宝.干旱胁迫下柚木叶片生理指标的变化[J]. 福建林学院学报,2006,26(2):103-106
[14]Babitha M P,Bhat S G,PrakashH S,et al.Differential Induction of Superoxide Dismutase in Downy Mildew Resistantand-susceptible Genotypes of Pearl Millet[J].Plant Pathology,2002,51(4):480-486
Physiological changes of Swainsona formosa under different water conditions
Bu Nan1,Yu Lirong2,Ma Wanli2,3,Wang Tiejuan2,Zhou Hongsheng3,Bi Jianling4,Sun Ke5
(1.Beijing Forestry University,100083,Beijing;2.The College of Life Science and Technology,Inner Mongolia Normal University,010022,Hohhot;3.State Forestry Administration,Planning and Design Institute of the Forest Products Industry,100714,Beijing;4.Natural Resource Information Centre of Inner Mongolia,010010,Hohhot;5.Beijing Engineering Consulting Corp.Ltd.of Soil and Water Conservation,100055,Beijing:China)
Under different water conditions some physiological indexes ofSwainsona formosa,such as Malondialdehyde(MDA),soluble sugar,soluble protein,proline,protective enzymes(SOD,POD and CAT),were determined by using the conventional method of plant physiology in this paper.The results are as follows:1)with increased drought stress the proline content increased gradually,soluble protein content decreased and the increased,there was a mutual compensation relationship between the two indexes.The tendency of content of soluble sugar increasing initially and then decreasing showed the regulation function of osmotic adjustment material to the drought stress.2)The activities of defense enzymes changed differently under various water conditions,the CAT activities raised with the drought stress.The SOD activity increased at moderate drought stress and declined at severe drought stress.In contrast to SOD activity,but POD activity changes were opposite to SOD.The cooperative synergistic effect among protective enzymes maintained the integrity of cell membrane of leaves.3)The MDA content increased with drought stress,which means that damage to.Swainsona formosadue to drought stress can be reduced by increasing soluble content,strengthening activity of protective enzymes and antioxygenic ability.
Swainsona formosa;drought stress;physiological indexes
2011-09-20
2012-10-30
国家林业局“948”项目“生态经济型观赏植物沙漠豆种质资源及繁殖栽培技术引进”(2009-4-14)
卜楠(1983—),男,博士研究生。主要研究方向:水土保持和复合农林。E-mail:bn_222@126.com
†责任作者简介:马万里(1963—),男,教授。主要研究方向:生态学和植物学。E-mail:wanlima518@126.com
(责任编辑:程 云)

