航天诱变甜菜种子对其SP1代某些生理特性的影响
吴则东 ,王华忠
(1.黑龙江大学农作物研究院/中国农业科学院甜菜研究所,哈尔滨 150080;2.黑龙江省普通高等学校甜菜遗传育种重点实验室/黑龙江大学,哈尔滨150080;3.中国农业科学院北方糖料作物资源与利用重点开放实验室,哈尔滨 150080)
利用返回式卫星等所能到达的空间环境对植物(种子)的诱变作用产生有益的变异,在地面选育植物新种质、新材料,培育新品种的高新技术育种途径和方法,称为航天育种或空间诱变育种[1]。1987年,我国第9颗返回式科学试验卫星携带着水稻和青椒种子发射成功,这是我国航天育种的开始[2]。自此以后,我国航天育种事业蓬勃发展,截止到2010年,通过国家或省级鉴(审)定的航天诱变新品种达到60个,累计推广240万公顷[3]。由于中国不是甜菜的起源国,品种资源相对匮乏,因此改善种质资源极为重要[4]。本试验通过对甜菜种子进行航天搭载诱变处理,对SP1代变异株叶片及花蕾还原糖含量的测定以及对四倍体品系叶片表皮细胞叶绿体及花粉粒萌发孔的观察,并与对照进行对比,探讨航天搭载种子的变异机理。
1 材料与方法
1.1 试验材料
本研究的材料均来自于中国农业科学院甜菜研究所经过十余年选择自育的国产优良甜菜品系,同一甜菜品种的种子分作两份,一份卫星搭载,另一份留在地面做对照。2006年9月,经“实践八号”航天育种卫星搭载了8份甜菜材料,经过15d的在轨飞行返回地面。本试验选用其中的5份材料,其中航天品系分别命名为 HT1,HT2,HT3,HT4 和 HT5,相应的对照分别命名为 CK1,CK2,CK3,CK4 和 CK5,其中 HT1 和 HT2 为多胚二倍体品系,HT3和HT4为单胚二倍体保持系,HT5为多胚四倍体品系,航天品系当年与对照一起培育母根。每个航天品系选取一株变异株为供试材料,变异株的标准主要是叶形比亲本明显变窄。测定还原糖的取样时间为2007年6月15日,主茎取生长点附近叶片及主茎顶端未成熟花蕾,2007年7月4日取开放花蕾,称重并放于-80℃冰箱保存待用;观察叶片下表皮叶绿体数取样时间为2007年6月5日;观察花粉粒萌发孔的取样时间为2007年6月10日。
1.2 方法
1.2.1 田间试验设计 2007年4月17日,将航天品系及其对照分别栽植在中国农业科学院甜菜研究所农村试验地,株距40cm,不同品系之间相隔100m以上,每个品系种植60株。5月20日进行施肥,常规田间管理。
1.2.2 还原糖含量的测定 采用3,5-二硝基水杨酸比色法测定还原糖[5-6]。3,5-二硝基水杨酸溶液与还原糖(各种单糖和麦芽糖)溶液烘热后被还原成棕红色的氨基化合物,在一定范围内,还原糖的量和棕红色物颜色深浅的程度成一定比例关系。先利用标准葡萄糖测定消光度值,以消光度值为纵坐标,葡萄糖毫克数为横坐标,绘制标准曲线,求得直线方程。然后在540nm波长下测定待测样品棕红色物质的消光度值,查标准曲线,便可求出样品中还原糖的含量。实验中所用的药品均为国产分析纯,所用的仪器为国产的T6型紫外分光光度计。
1.2.3 花粉粒萌发孔的观察 利用2%醋酸地衣红对甜菜花粉进行染色,在显微镜下对花粉粒萌发孔进行观察,记录花粉粒萌发孔的数目[7]。一般四倍体甜菜花粉粒萌发孔的数目大于12个,而二倍体甜菜花粉粒萌发孔的数目小于7个[8]。取样时间为2007年6月16日,样品为HT5及CK5。实验中所用的地衣红为进口,显微镜为日本产的OLYMPUS,型号是CHK,观察倍数为40倍,照相机为日本索尼公司的DSC-W30型。
1.2.4 叶片下表皮叶绿体数的观察 将甜菜叶片下表皮撕下,用1%的硝酸银溶液进行染色[9],使用显微镜对叶绿体数进行观察,并进行拍照。所用显微镜及照相机同花粉粒萌发孔的观察。
2 结果与分析
2.1 太空环境对甜菜不同品系还原糖的影响
从实验结果看(见表1),卫星搭载的两个航天品系(HT2和HT4)在3个取样点均表现为还原糖的含量低于对照品系,HT3则表现为还原糖的含量在3个取样点均高于对照品系,而HT1则是叶片还原糖含量低于对照,花蕾还原糖含量均高于有对照。其中HT1未开放花蕾还原糖的含量比对照高32%,HT2未开放花蕾还原糖的含量比对照低22%,HT3叶片及开放花蕾中还原糖的含量均比对照高30%;而其余航天品系与对照还原糖的含量则差异不大。从表中我们还可以看到开放花蕾中还原糖的含量明显高于叶片及未开放花蕾。

表1 航天搭载和对照不同取样部位还原糖含量的测定

图1 CK5花粉粒萌发孔
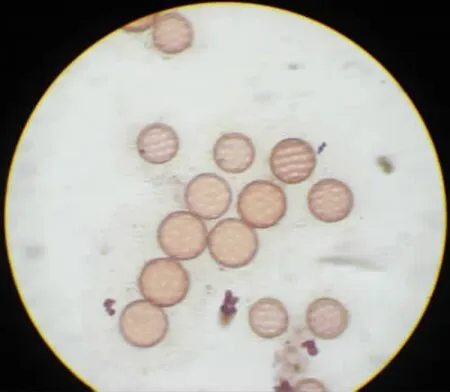
图2 HT5(变异株1)花粉粒萌发孔
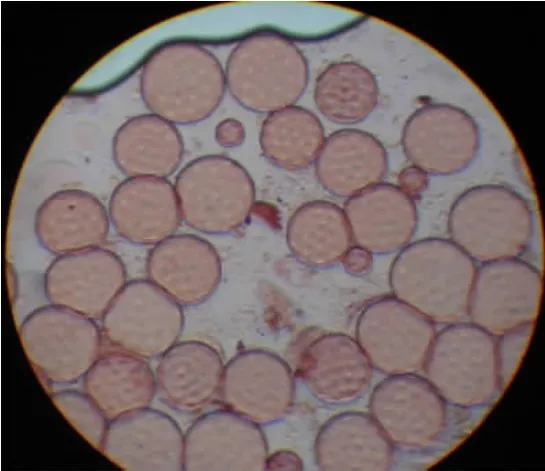
图3 HT5(变异株2)花粉粒萌发孔
2.2 太空环境对甜菜四倍体花粉粒萌发孔数的影响
从图中我们可以看到,和对照相比,航天品系的花粉粒萌发孔发生了两种变化,一种是花粉粒大小不一,而且萌发孔数目明显变少,对照萌发孔数在16个左右,而航天品系仅有12~13个;另外一种变化是花粉粒和萌发孔增大,萌发孔数目增多,一般在16个以上。
2.3 太空环境对甜菜四倍体叶片下表皮气孔保卫细胞叶绿体数的影响
对于植物四倍体品系鉴定的方法,在未开花之前一般都采用气孔保卫细胞叶绿体计数法,例如烟草[10]、枇杷[11]等等,甜菜四倍体的鉴定也经常采用此法[12],一般认为叶绿体数在24个以上就为四倍体,小于14个的就为二倍体。
从图4中我们可以看出,甜菜叶片下表皮气孔保卫细胞叶绿体数航天处理和对照之间没有明显的区别,气孔保卫细胞叶绿体数均在24个以上。
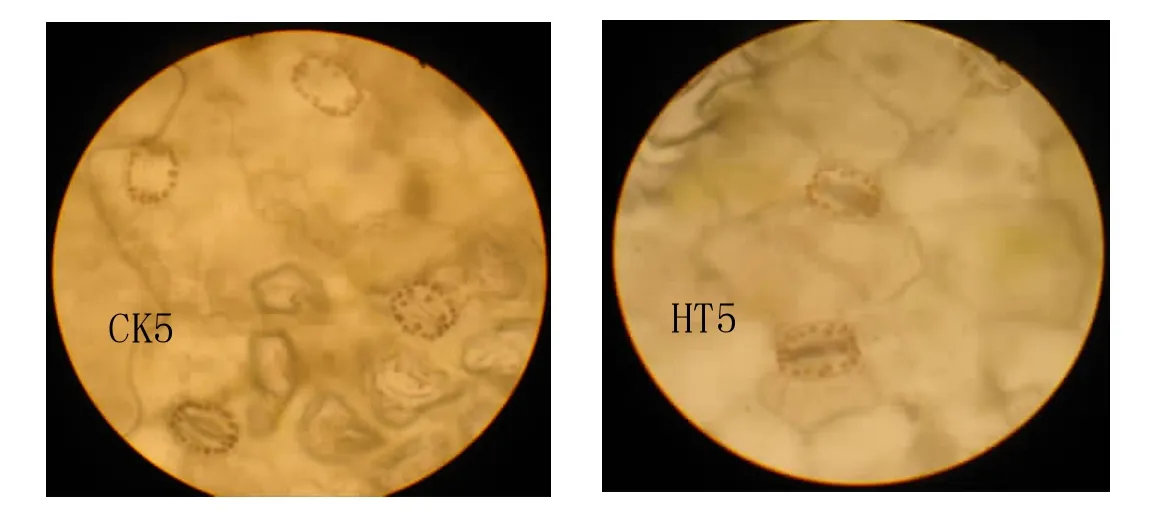
图4 CK5和HT5叶片下表皮气孔保卫细胞叶绿体
3 结论和讨论
植物体内的还原糖主要是葡萄糖、果糖和麦芽糖。它们在植物体内的分布,不仅反映植物体内碳水化合物的运转情况,而且也是合成其它成分碳架来源和呼吸作用的基质。研究表明,同一品系,还原糖含量的高低,和植物的抗性有一定的关系,例如马铃薯对软腐病的抗性[13]、甜菜对丛根病的抗性等等[14],都证实了还原糖含量的提高能够增强品系的抗性水平。从本试验结果来看,还原糖含量的变化在4个品系中表现并不一致,说明航天诱变的方向具有不确定性,这和前人研究结果相同[15]。从花粉粒萌发孔及保卫细胞气孔叶绿体观察结果表明,叶片保卫细胞气孔叶绿体数没有发生改变,而航天品系有些株系的花粉粒萌发孔的数目和大小发生了改变,因此可以看出,诱变的表达主要是在生殖器官。
我国甜菜种质资源极其匮乏,目前登记入国家种质库的仅有1300多份[16],与国外相差悬殊。因此,要想提高我国甜菜的育种水平,就要首先改善现有的种质资源,而航天诱变则为一个不错的选择。由于航天搭载的材料具有变异率高、纯合快以及产生可用于生产的特殊类型多的特点[17-19]。如通过对还原糖含量的提高,用来筛选抗性品系。通过几代的自交,逐步纯化。本试验中我们测量的生理指标相对较少,将来可以通过对更多变异植株进行逐代自交,并通过不同生理指标的测定来筛选不同用途的品系,这将大大加速甜菜品系选择的步伐,也是将来甜菜育种的一种全新选择。
[1]刘录祥,郑企成.空间诱变与作物改良[M].北京:原子能出版社,1997.
[2]孙焕,马浩波,李雪君,等.航天育种发展概况及其在烟草上的应用展望[J].中国种业,2009(10):14-15.
[3] 中国航天育种新品种达到 60 个[J].蔬菜,2010(6):47.
[4]王红旗.我国甜菜育种工作回顾与展望.Ⅰ.成绩与不足[J].中国糖料,2001(2):32-38.
[5] 赵凯,许鹏举,谷广烨.3,5-二硝基水杨酸比色法测定还原糖含量的研究[J].食品科学,2008,29(8):534-536.
[6]郭敏亮.3,5-二硝基水杨酸比色法测定还原糖[J].江苏农学院学报,1990(2):40.
[7]桂明珠.甜菜花粉萌发孔检查及其制片方法[J].中国甜菜,1984(4):51-52.
[8]王华忠.对改进我国甜菜四倍体选育技术的商榷[J].中国甜菜,1989(1):47-51.
[9]杨继娟,张吉光,胡小平,等.矿物油室温保存棉花黄萎菌的ISSR分析[J].西北农业学报,2010(12):177-182.
[10]和志娇,和加卫,程在全,等.滇西北部分悬钩子属植物亲缘关系的ISSR分析[J].西北农业学报,2011(11):164-169.
[11]张明,李延龙,王贞,等.基于ISSR标记的韭菜种质资源遗传多样性初探[J].西北农业学报,2012(1):146-150.
[12]鲁文英.饲用甜菜多倍体诱导及倍性鉴定的研究[D].兰州:甘肃农业大学,2007.
[13]王金生,张学君,方中达.马铃薯品种对细菌软腐病抗性生理指标的研究—Ⅱ.品种还原糖含量及其与软腐病抗性的关系[J].南京农业大学学报,1990(2):69-75.
[14] 邓峰,苏廷荃.甜菜抗丛根病机理初步研究[J].中国糖料,1998(1):6-10.
[15]朱昌兰,胡岳峰,陈莹,等.作物空间诱变育种研究进展[J].江西农业大学学报,1999(3):435-437.
[16]崔平,张守谆,李雅华.中国甜菜品种资源目录[M].北京:中国农业出版社,1995.
[17] 赵玉锦,赵琦,白志良,等.空间诱变高粱突变体的研究[J].植物学通报,2001,18(1):81-89.
[18]李金国,刘敏,王培生,等.空间条件对番茄诱变作用及遗传的影响[J].航天医学与医学工程,2000,13(2):114-118.
[19]李源祥,蒋兴村.水稻空间诱变性状变异及育种研究[J].江西农业学报,2000,12(2):17-23.

