鸭疫里默氏杆菌血凝素基因的克隆、表达及其蛋白的定位分析
屠 晶,胡青海,于圣青,丁 铲,韩先干,朱寅玉,王小兰,苗 双,卢凤英
(中国农业科学院上海兽医研究所,上海 200241)
鸭疫里默氏杆菌(Riemerella anatipestifer)感染是当前危害养鸭业最为严重的传染病之一。该病已呈世界范围分布,由于该病分布的广泛性以及引起雏鸭的高死亡率,发育迟缓和淘汰率增加,给养鸭业造成严重的经济损失。
鸭疫里默氏杆菌是黄杆菌科鸭疫里默氏杆菌属的代表种,已确认的血清型有21个[1],但目前对鸭疫里默氏杆菌的毒力相关基因还知之甚少,已经确定的毒力基因只有ompA[2]。另外,还推测一些因子可能与致病性相关,如pCFC1质粒中含有两个毒力相关基因vapD1和vapD2[3-4],以及CAMP溶血素[5]等。在一些病原菌中血凝素是重要的毒力因子,如在沙门氏菌、霍乱弧菌、大肠杆菌和百日咳博德特氏菌等[6-9],可作为一种粘附素在细菌感染过程中参与细菌粘附到宿主细胞。本实验室测定了鸭疫里默氏杆菌CH3株的全基因组,解析后发现基因组中存在血凝素基因,这与Zhou等的报道一致[10]。本研究将对鸭疫里默氏杆菌血凝素基因进行了克隆和表达,并对其蛋白在细菌中的定位进行了分析,为下一步研究其生物学功能奠定基础。
1 材料和方法
1.1 菌株和血清 鸭疫里默氏杆菌CH3株(血清1型)、WJ4株(血清 1型)、NJ3株(血清 2型)、Th4株(血清 2型)、HXb2(血清 10型)、NN8株(血清 15型)和JY6株(未定型)由本实验室分离、鉴定并保存;E.coliDH5α及BL21(DE3)感受态细胞购自天根生化科技(北京)有限公司;鸭抗鸭疫里默氏杆菌CH3株、Th4株(血清 2型)和 HXb2(血清 10型)阳性血清由本实验室制备。
1.2 载体、酶及主要试剂 限制性内切酶购自TaKaRa公司;Expand High Fedility PCR system购自Roche公司;原核表达载体pET-28a(+)购自Novagen公司;pGEM-T easy载体、T4 DNA ligase购自Promega公司;辣根过氧化物酶(HRP)标记羊抗鸭IgG购自香港Abcam公司;HRP标记羊抗鼠IgG为天根生化科技(北京)有限公司产品;FITC标记羊抗鼠IgG购自北京康为世纪生物科技有限公司。
1.3 血凝素基因的克隆和鉴定
1.3.1 引物设计根据鸭疫里默氏杆菌血清1型CH3全基因组中血凝素基因的序列,用Primer5.0软件设计了一对引物。上游引物P1:5'-TAGGATCC ATGAAAAAGTTTTTGATAGCTTCGGC-3'(BamHⅠ);下游引物P2:5'-GTCTCGAGTTATCTGCGTGGAGC TTTCTTTTG-3'(XhoⅠ)。 引物由英潍捷基(上海)贸易有限公司合成。
1.3.2 PCR扩增提取不同血清型鸭疫里默氏杆菌的基因组,作为PCR模板扩增血凝素基因。PCR反应条件:94℃ 5 min;94℃ 30 s、52℃ 40 s、72℃ 70 s,30个循环;72℃延伸10 Min。PCR产物连接pGEM-T,转化JM 109感受态细胞,筛选、鉴定得到阳性重组质粒命名为pT-hemag-X(菌株名)。由上海英骏生物技术有限公司测序,用DNAS-tar7.01软件进行序列分析。
1.4 血凝素基因重组表达质粒的构建及鉴定BamHⅠ/XhoⅠ双酶切pT-hemag-CH3,回收目的片段与经同样酶切处理的pET-28a载体连接,将连接产物转化大肠杆菌DH5α,筛选、鉴定得到阳性重组质粒,命名为pET-hemag。
1.5 血凝素基因表达及鼠抗鸭疫里默氏杆菌血凝素阳性血清的制备 将pET-hemag重组质粒转化至E.coliBL21(DE3)感受态细胞,筛选阳性重组菌,经IPTG诱导表达,收集诱导后菌体并超声破碎,离心后分别收集上清液和沉淀,通过SDS-PAGE分析重组血凝素蛋白的表达与可溶性。
表达的血凝素重组蛋白包涵体经复性、纯化后与ISA50佐剂乳化,免疫BALB/c小鼠制备鼠抗鸭疫里默氏杆菌血凝素阳性血清。
1.6 Western blot分析 鸭疫里默氏杆菌CH3株(血清1型)、Th4株(血清2型)和HXb2(血清 10型)的全菌蛋白经SDS-PAGE凝胶电泳后,半干转印[9]至PVDF膜,5%脱脂乳4℃封闭过夜,以1∶500稀释的鼠抗血凝素蛋白阳性血清作为一抗,1∶8 000稀释的HRP标记羊抗鼠IgG为二抗,进行western blot试验,分析鼠抗CH3株血凝素蛋白血清与1、2、10型鸭疫里默氏杆菌的反应性。
同时,重组血凝素蛋白经SDS-PAGE凝胶电泳、半干转印后,分别与1∶300稀释的鸭抗鸭疫里默氏杆菌CH3株(血清1型)、Th4株(血清2型)和HXb2(血清10型)阳性血清作为一抗,及1∶8 000稀释的HRP标记羊抗鸭IgG作为二抗进行western blot,以检测鸭血清中有无抗血凝素的抗体。
1.7 红细胞凝集试验 1%鸡、鸭或鹅的红细胞悬液按常规方法制备。以新城疫病毒La Sota株作为阳性对照,血凝试验按照OIE介绍的新城疫病毒血凝试验的方法进行。
1.8 鸭疫里默氏杆菌中血凝素蛋白的定位分析 用悬浮荧光法分析鸭疫里默氏杆菌血凝素蛋白。培养鸭疫里默氏杆菌CH3株,稀释细菌到107cfu/mL,100μL菌液分别与100μL 1:50,1:250,1:500稀释的鼠抗血凝素阳性血清室温作用2 h,PBS洗涤5次,再与羊抗鼠 IgG-FITC(1∶100)室温作用 2 h,PBS洗涤3次后用少量PBS重悬细菌,荧光显微镜下 观 察 结 果 。设 立 鼠鸭疫里默氏杆菌多克隆抗血清作为阳性对照,na ve小鼠血清作为阴性对照。用在线软件PSORTb v.3.0预测血凝素蛋白在细菌中的定位。
2 结果
2.1 血凝素基因的克隆,鉴定与序列测定 利用PCR方法从所检测的不同血清型鸭疫里默氏杆菌菌株中均扩增到了血凝素基因,经琼脂糖凝胶电泳检测扩增产物,出现一条1 kb左右的条带,与预期相符。测序结果表明从CH3株中扩增出的血凝素基因大小为 1 059 bp(图 1),编码 352个氨基酸(JN937575~JN937580)。用CDD分析表明其蛋白中存在3个保守的功能域,即Glucosam inidase superfamily domain(aa 34~aa 161)、 Lysin domain(aa 249~aa 291)和 MltD domain(aa 220~aa 329)。同源性分析表明,5种不同血清型血凝素蛋白的氨基酸同源性为94.1%~100%,其中已在GenBank中登录的全基因组序列的DSM 15868株(CP002346)与其他鸭疫里默氏杆菌菌株的血凝素氨基酸同源性为94.3%~98.3%,均为血清1型的CH3和WJ4间血凝素同源性为94.9%,而WJ4与JY6株(未定型)血凝素的氨基酸同源性为100%。以上结果还提示鸭疫里默氏杆菌血凝素同源性的高低与菌株有关,而与血清型无关。鸭疫里默氏杆菌血凝素与黄杆菌3519-10株血凝素(NC_013062)的氨基酸同源性为68.0%~68.9%,与大肠杆菌NRG 857C(CP001855)推测的血凝素/粘附素的氨基酸同源性为19.0%~19.5%(图2)。CDD分析表明,鸭疫里默氏杆菌血凝素蛋白有Glucosaminidase和LysM两个超家族(图2)。

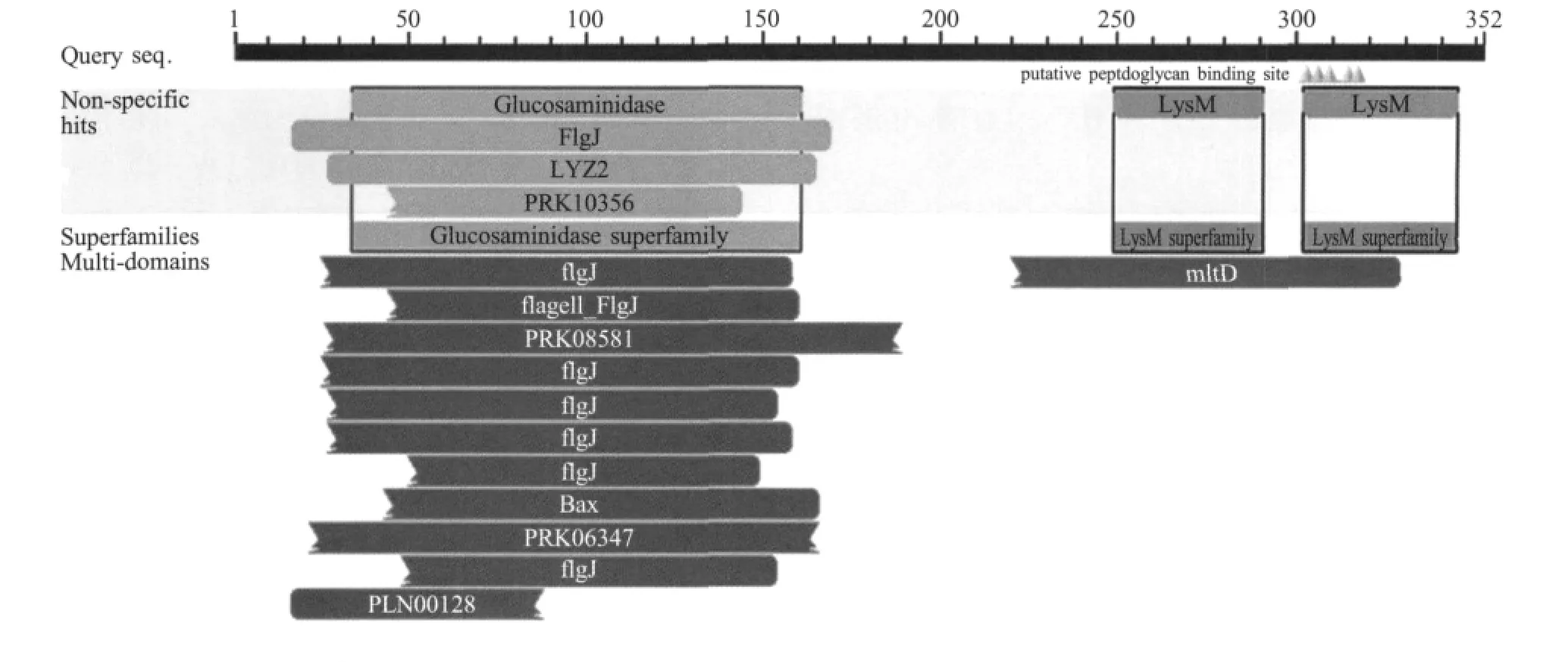
图2 鸭疫里默氏杆菌血凝素蛋白保守的结构域分析Fig.2 The conserved domains on the hemagglutinin protein of R.anatipestifer
2.2 Hemagglutinin基因的原核表达和western blot分析BamHⅠ/XhoⅠ双酶切和PCR鉴定,筛选阳性重组质粒,将重组质粒pET-hemag转化BL21(DE3)诱导表达后进行SDS-PAGE电泳,结果表明在40 ku左右有一条明显的表达带。表达的蛋白均存在于裂解细菌的上清和包涵体中,以包涵体的形式存在为主(图3)。Western blot结果显示,本研究中制备的鼠抗血凝素阳性血清能够与鸭疫里默氏杆菌 CH3株(血清 1型)、Th4株(血清 2型)和 HXb2(血清10型)菌体中的血凝素蛋白反应,但与CH3株血凝素蛋白的反应比另外2个血清型血凝素蛋白的反应强(图4)。另外,表达的血凝素蛋白能与鼠抗血凝素阳性血清反应,但是与鸭抗鸭疫里默氏杆菌CH3株(血清1型)阳性血清、鸭抗Th4株(血清2型)阳性血清、鸭抗HXb2株(血清10型)阳性血清均无反应(图 5)。
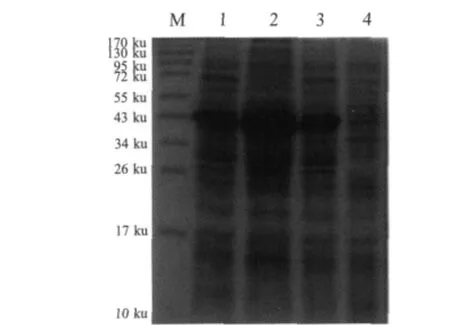
图3 血凝素蛋白在大肠杆菌中的表达Fig.3 Analysis of the expression of hemagglutinin in E.coli by SDS-PAGE
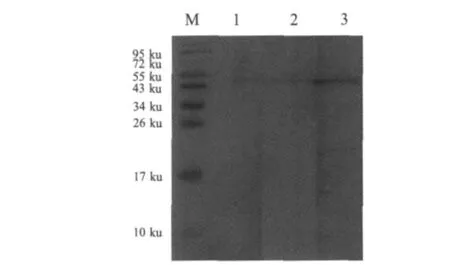
图4 Western blot检测鸭疫里默氏杆菌中血凝素蛋白Fig.4 Detection of R.anatipestifer hemagglutinin protein prepared mous antiserum by western blot
2.3 血凝素蛋白在鸭疫里默氏杆菌中的定位分析红细胞凝集试验表明,鸭疫里默氏杆菌CH3、Th4、HXb2、NN8和JY6等菌株均不凝集鸡、鸭和鹅的红细胞。Western blot的结果显示本研究中制备的鼠抗鸭疫里默氏杆菌血凝素抗体与菌体中的血凝素蛋白呈阳性反应(图4),并且该抗体与以可溶性(存在于表达菌体的裂解上清中)及以包涵体形式的重组血凝素蛋白均能反应(图5),初步表明该血凝素抗体可用于后续试验中血凝素的检测。鸭疫里默氏杆菌免疫鸭体内没有血凝素抗体,提示这种血凝素可能不是一种膜蛋白。采用悬浮荧光法来进一步进行验证,结果表明菌体经间接免疫荧光染色后,在荧光显微镜下观察鸭疫里默氏杆菌的表面无特异性荧光。而阳性对照鼠抗鸭疫里默氏杆菌多克隆抗血清与鸭疫里默氏杆菌做IFA,呈现明显荧光。在线软件PSORTb v.3.0预测结果表明,鸭疫里默氏杆菌的血凝素定位于胞浆。
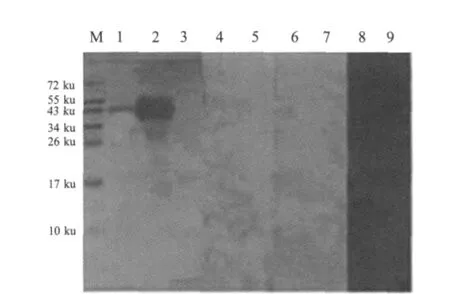
图5 Western blot检测免疫鸭血清中血凝素的抗体Fig.5 Detection of ant-hemagglutinin antibody w ith R.anatipestifer immunized duck sera by western blot
3 讨论
血凝素在许多细菌病原体中都是重要的毒力因子。血凝素通常表达在细菌的表面作为一种粘附素,与细菌表面的鞭毛样结构如鞭毛粘附素或非鞭毛表面成份如非鞭毛粘附素一起,使细菌粘附到哺乳动物细胞表面[8]。一些病原菌(包括尿路致病性大肠杆菌、百日咳博德特氏菌、霍乱弧菌和伤寒沙门氏菌)粘附到宿主细胞的能力与其凝集红细胞的能力相关,而且研究表明这些细菌的血凝素在细菌感染过程中作为凝集素[9]。黄杆菌科的一些菌株具有血凝活性,黄杆菌3519-10株等细菌基因组中存在血凝素基因[11-12],但对于其功能目前还研究的比较少。鸭疫里默氏杆菌的血凝素是否也是一种毒力因子尚不清楚。
本研究的实验结果经分析表明,鸭疫里默氏杆菌的血凝素可能定位于胞浆内,这与其他病原菌的血凝素定位于膜表面有所不同。由于鸭疫里默氏杆菌Riean_1717基因氨基酸与黄杆菌血凝素(FIC_02084)氨基酸的同源性较高(68%左右),分析认为其为血凝素基因。但黄杆菌的有些菌株有鞭毛,也具有血凝活性;而鸭疫里默氏杆菌无鞭毛,并且鸭疫里默氏杆菌血凝素与大肠杆菌血凝素的同源性也只有19%左右。因此,不能以其他细菌血凝素定位于细菌表面来判断鸭疫里默氏杆菌血凝素的定位。根据GenBank中登录的2株鸭疫里默氏杆菌的全基因组序列,对该蛋白的解析也有差异。在DSM 15868株(CP002346.1)相关蛋白(Riean_1717)的解析为FIC_02084血凝素(KEGG/SPTR)、胞壁质酶(COGs)、甘露糖基糖蛋白内 -β-n-乙酰葡糖胺酶(PFAM);而 RA-GD株(CP002562.1)相关蛋白(RIA_0466)的解析为鞭毛特异的胞壁质酶。因此,该蛋白更可能是胞浆中的一种酶。在线软件COGnitor预测结果也表明,该蛋白与细菌的运动和分泌有关。细菌蛋白的定位与功能密切相关,鸭疫里默氏杆菌血凝素的生物学功能还有待通过基因缺失等手段进行进一步的研究。
[1]Pathanasophon P,Phuektes P,Tanticharoenyos T,etal.A potential new serotype ofRiemerella anatipestiferisolated from ducks in Thailand[J].Avian Pathol,2002,31:267-70.
[2]Hu Qing-hai,Han Xian-gan,Zhou Xiao-jin,et al.OmpA is avirulence factor ofRiemerella anatipestifer[J].Vet Microbiol,2011,150:278-283.
[3]Chang C F,Hung P E,Chang Y F.Molecular characterization of a plasm id isolated fromRiemerella anatipestifer[J].Avian Pathol,1998,27:339-345.
[4]Weng Shu-chuan,Lin Wen-hua,Chang Yong-fu,et al.Identification of a virulence-associated protein homolog gene and ISRa1 in a plasmid ofRiemerella anatipestifer[J].FEMS Microbiol Lett,1999,179(1):11-19.
[5]Crasta K C,Chua K L,Subramaniam S,et al.Identification and charaeterization of CAMP cohemolys in as a potential virulence factor ofRiemerella anatipestifer[J].JBacleriol,2002,184(7):1932-1939.
[6]Aslanzadeh J,Paulissen L J.Adherence and pathogenesis ofSalmonella enteritidisin Mice[J].M icrobiol Immunol,1990,34:885-893.
[7]Han N,Whitlock J,Progulske-Fox A.The hemagglutinin gene A(hagA)ofPorphyromonas gingivalis381 contains four large,contiguous,direct repeats[J].Infect Immun,1996,64:4000-4007.
[8]Markham P F,Glew MD,Whithear K.G,et al.Walker.Molecular cloning of the gene fam ily that encodes pMGA,a hemagglutinin ofMycoplasma gallisepticum[J].Infect Immun,1993,61:903-909.
[9]Rao V K,Whitlock JA,Progulske-Fox A.Cloing,characterization and sequencing of two haemagglutinin genes fromEikenella corrodens[J].JGen Microbiol,1993,139:639-650.
[10]Zhou Zu-tao,Peng Xiao-ya,Xiao Yun-cai,etal.Genome sequence of poultry pathogen Riemerella anatipestifer strain RA-YM[J].JBacteriol,2011,193(5):1284-5.
[11]Kawai Y,Yano I,Kaneda K.Various kinds of lipoamino acids including a novel serine-containing lipid in an opportunistic pathogen Flavobacterium.Their structures and biological activities on erythrocytes[J].Eur JBiochem,1988,171(1-2):73-80.
[12]M ller JD,Barnes A C,Dalsgaard I,et al.Characterisa tion of surface blebbing and membrane vesicles produced byFlavobacterium psychrophilum[J].Dis Aquat Organ,2005,64(3):201-209.

