山西省蔬菜灰霉病菌对嘧霉胺的抗药性检测
赵晓军, 任 璐, 周建波, 殷 辉
(1.山西省农业科学院植物保护研究所,太原 030032;2.山西农业大学农学院,太谷 030801)
山西省蔬菜灰霉病菌对嘧霉胺的抗药性检测
赵晓军1*, 任 璐1,2, 周建波1, 殷 辉1
(1.山西省农业科学院植物保护研究所,太原 030032;2.山西农业大学农学院,太谷 030801)
为明确山西省蔬菜灰霉病菌对嘧霉胺的抗药性,2010-2011年用单孢分离法从山西省数十个县、市蔬菜主产区采集、分离到171株灰霉病病原菌(Botrytiscinerea),并采用最低浓度抑制法测定各菌株对嘧霉胺的敏感性。结果表明,山西省灰霉病菌对嘧霉胺的平均抗性频率为50.29%,平均抗性倍数为1 423.4。在山西省不同地区灰霉病菌对嘧霉胺的抗性存在差异,其中嘧霉胺使用较多的朔州地区抗药性频率达到100%。
灰霉病; 灰葡萄孢菌; 嘧霉胺; 抗药性; 蔬菜
灰霉病是蔬菜作物的主要病害之一,在露地和保护地均有发生,给蔬菜生产造成了严重损失[1-3]。目前生产上用于防治灰霉病的主要杀菌剂有:苯氟磺胺类、苯并咪唑类、二甲酰亚胺类、N-苯氨基甲酸 酯 类 等[4-7]。 由 于 灰 霉 病 菌 (BotrytiscinereaPers.ex Fr.)具有繁殖速率高、遗传变异大、适合度高的特性[8-9],加之多年连续使用一种药剂防治使灰霉病菌对杀菌剂产生了抗药性,甚至出现了多重抗药性[10-11]。迄今为止,已有灰霉病菌对多菌灵、乙霉威、腐霉利、嘧霉胺等药剂抗药性的相关报道[12-15]。
嘧霉胺属于苯胺基嘧啶类杀菌剂,抑制芽管伸长和菌丝生长,兼有保护治疗作用,是防治灰霉病的高效 杀菌剂[1,3-4]。有研究表明,它能够抑制蛋氨酸的合成和胞壁水解酶的分泌[16]。灰霉病菌对嘧霉胺的抗药性属于单基因控制的,因此在生产上使用有很高的风险性[2,17-18]。20世纪90年代,嘧霉胺在欧洲大面积推广使用[3-4],之后欧洲的一些国家相继报道灰霉病菌对嘧霉胺产生了抗药性[4,19-23]。1998年,嘧霉胺开始在中国登记并使用[1-3]。国内学者研究表明:在我国辽宁和江苏等地已经报道了灰霉病菌对嘧霉胺的抗药性菌株[1,3-6]。
嘧霉胺在山西省已使用多年,目前尚未明确灰霉病菌对嘧霉胺的抗药性情况。本试验在山西省的数十个县市采集并分离灰霉病菌,进而测定各菌株对嘧霉胺的抗性频率和抗性水平,为山西省各菜区嘧霉胺的合理使用提供理论指导。
1 材料与方法
1.1 标本采集
2010-2011年在山西省进行调查并采集标本。采集地点包括:大同、朔州、太原、晋中、运城、临汾、晋城、长治。在各个调查区以棚室或地块为单位采集典型蔬菜灰霉病病果或病叶标本。
采集好带有灰霉病病原菌的病果用小刀刻下果皮,并用吸水纸吸干,再用标本夹压制。带有灰霉病病原菌的叶子和枝干铺平整,用带有吸水纸的标本夹压制,最后将干标本和标本信息装到信封中,保存到标本室。标本编号依据山西省农业科学院植保所植病室的编排准则,标注采集地点、采集时间、采集人、采集编号。
1.2 菌株分离
采用组织分离法分离灰霉病菌,取病健交界处小块组织,接种在PDA平板中央,待菌丝长出时再进行单孢分离获得单孢系菌株。将纯菌株转接到PDA平板上进行插片法培养,然后观测病原菌的显微形态和菌落形态。将分离得到的灰霉病菌纯菌株转接于装有PDA培养基的离心管(1.5mL)用于保存菌种。菌株以采样地市或县的小写拼音字头“字母+序号”命名。
1.3 供试杀菌剂
97.17%嘧霉胺原药,由陕西美邦农药有限公司提供。
1.4 含药培养基制备
将97.17%嘧霉胺原药用丙酮配成1 000μg/mL母液,母液保存于4℃冰箱中备用。使用时以无菌水分别稀释为50、10、5、2.5μg/mL和1μg/mL的系列浓度。在无菌环境下,将配制好的系列浓度与冷却到40℃左右的PDA培养基按1∶9的比例混合充分摇匀,制成最终浓度为5、1、0.5、0.25、0.1μg/mL的含药平板。
1.5 抗药性频率测定
采用最低抑制浓度法(MIC)鉴别菌株。不能在含嘧霉胺最低抑制浓度的平板上正常生长的为敏感菌株,能在含药培养基上生长的为抗性菌株。其中,最低抑制浓度即为药剂能够抑制菌株生长的最低浓度。本试验采用的嘧霉胺最低抑制浓度为0.1μg/mL,此浓度通过多次重复试验所得。用打孔器在培养2d的待测菌株边缘取直径为5mm的菌饼接种于含嘧霉胺鉴别浓度的PDA平板上,每个处理重复3次,置于25℃恒温培养箱培养2d,观察、记录菌株生长情况。进而统计各个调查地区敏感和抗性菌株的抗性频率。

1.6 灰霉病菌对嘧霉胺的抗药性水平测定
将纯化好的灰霉病菌接种于PDA平板培养基上。在25℃条件下,培养3d。用打孔器在菌落边缘取直径为5mm的菌饼,接种于含不同浓度嘧霉胺的PDA平板培养基上,25℃培养3d,采用十字交叉法测量菌落直径,每个处理3次重复。将测量直径与对照组比较,求出抑制百分率并将其换为几率值(y)。以几率值(y)为纵坐标和浓度剂量对数(x)为横坐标制作毒力回归方程曲线,从而计算出各菌株对嘧霉胺的EC50值,分析其抗药水平。
本试验中引用的灰霉病菌对嘧霉胺的敏感基线为0.096μg/mL[1]。抗性水平的划分见表1。

表1 抗性水平划分标准

2 结果与分析
2.1 病原菌的分离及纯化
本试验共分离纯化得到171株灰霉病菌。其中,12株采自大同、19株采自朔州、32株采自太原、28株采自晋中、16株采自晋城、14株采自长治、34株采自运城、16株采自临汾。
2.2 各地区灰霉病菌对嘧霉胺的抗性频率及分布
将分离纯化的菌株进行了室内抗药性鉴定。结果表明:嘧霉胺的敏感菌85株,抗性菌86株,抗性频率达到50.29%。其中低抗菌株占3.51%;中抗菌株占15.79%;高抗菌株占17.54%;特高抗菌株占13.45%。山西省各地区灰霉病菌的抗药性频率均有一定的差异,其中长治地区未发现抗性菌株。太原地区以中抗菌株为主,抗性频率为50%。晋中、朔州、运城地区以高抗和特高抗菌株为主,抗性频率分别为50.00%、100%、58.82%。大同地区以低中抗菌株为主,抗性频率为41.67%。晋城地区所测菌株均为特高抗菌株,抗性频率为25%(详见表2)。
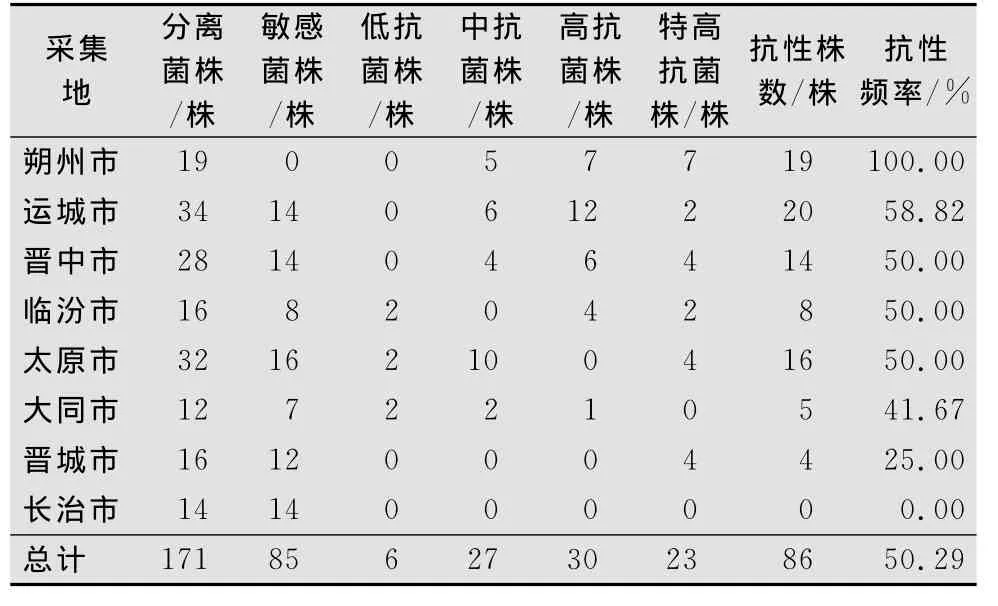
表2 山西省各地区灰霉菌对嘧霉胺的抗性频率
2.3 抗性菌株抗性水平测定结果
由测定结果可知,敏感菌株平均EC50值为0.128 6 μg/mL,低抗菌株平均EC50值为0.526 0μg/mL,抗性倍数为5.5倍;中抗菌株平均EC50值为3.881 8μg/mL,抗性倍数为40.4倍;高抗菌株平均EC50值为31.946 1μg/mL,抗性倍数为332.8倍;特高抗菌株平均EC50值为930.214 0μg/mL,抗性倍数达到9 690.0倍。
3 讨论
嘧霉胺作用位点单一,病原菌容易对其产生抗药性,使其田间防治效果下降。为了获得理想的防治效果,加大了杀菌剂的使用剂量,增加了喷药次数,从而使得选择压力增大,导致抗性菌株成为优势种群[1]。迄今为止已经有很多关于灰葡萄孢菌对嘧霉胺产生抗药性的报道[20-23]。
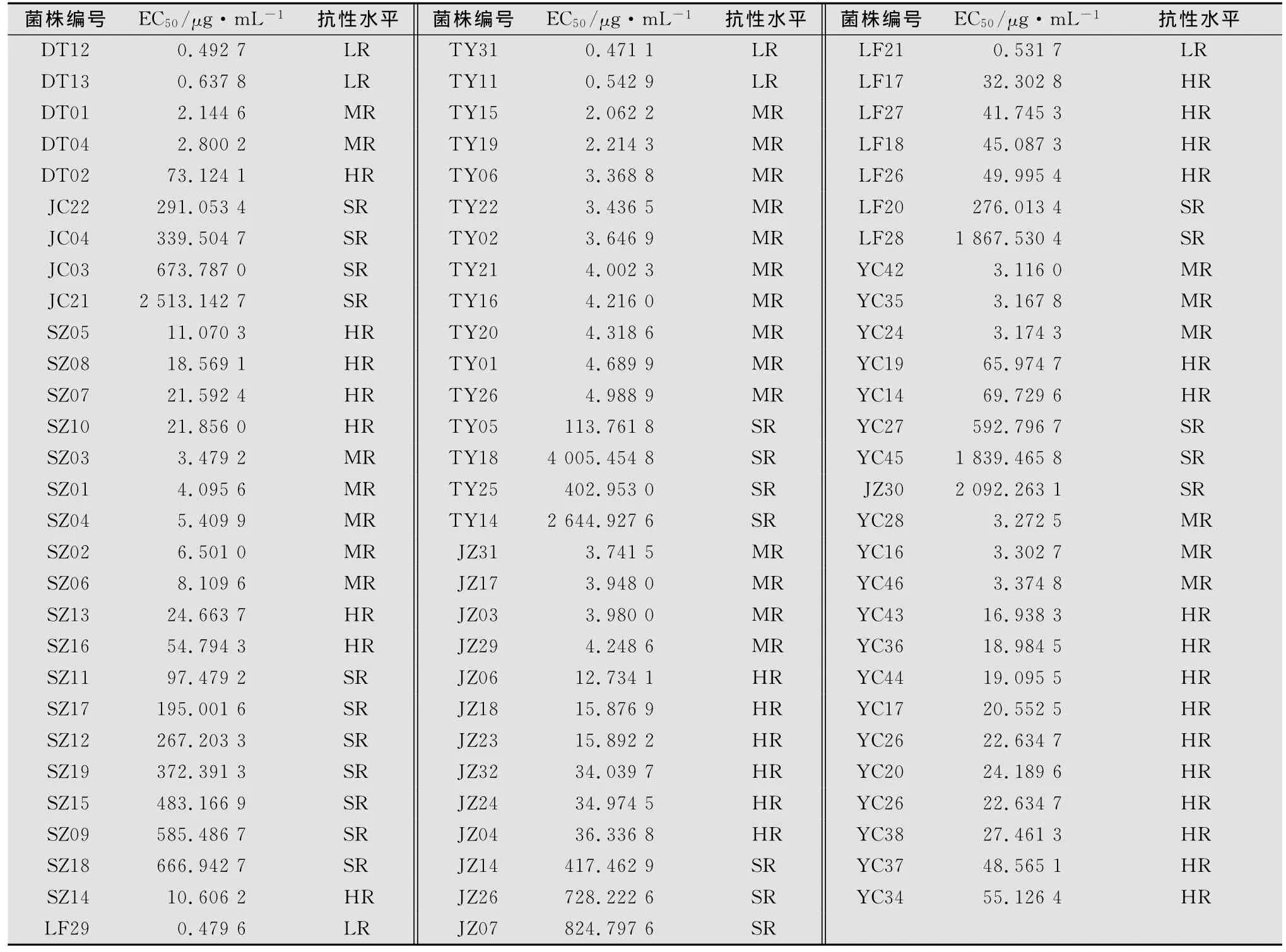
表3 山西省各地区抗性菌株的抗性水平
本研究表明,山西省蔬菜灰霉病菌已对嘧霉胺产生抗药性,处于高抗性水平,平均抗药性频率达50.29%,平均EC50值为136.646 5μg/mL,这与之前大多数灰霉菌对嘧霉胺抗性水平主要为中高抗水平的报道相一致[1,3];不同地区抗药性频率存在差异,嘧霉胺使用较多的朔州地区抗药性频率最高,而在长治地区灰霉病菌还没对嘧霉胺产生抗药性。
本研究采用最低抑制浓度法(固体法)测定菌株对嘧霉胺的抗性频率。固体法是将不同剂量的药物与一定量融化的固体培养基相混合,制成含不同药物浓度的递减药物平板。将待测菌接种于含药物平板上,再将平板放入温箱培养判断菌的生长情况,以该菌不生长的平板所含药剂浓度为该药的最低抑制浓度(MIC)。该方法在大量测定菌株EC50值之前,将敏感菌株与抗性菌株区分开,只测定抗性菌株的EC50值以测定抗性菌株的抗性水平,从而在已知敏感基线的前提下减少了工作量。
目前,嘧霉胺仍是山西省防治蔬菜灰霉病的主要药剂之一,然而其防治效果逐年下降。由于同种杀菌剂的单一重复使用是灰霉病菌产生抗药性的原因之一。因此,建议根据不同地区的抗药性水平采取相应抗药性治理措施,如不同作用机制的杀菌剂交替使用、减少单季喷药次数、普及病害综合治理技术等,以延缓抗药性的发展。
[1]纪明山,祁之秋,王英姿,等.番茄灰霉病菌对嘧霉胺的抗药性[J].植物保护学报,2003,30(4):396-400.
[2]纪明山,祁之秋,赵平,等.番茄灰霉病菌对嘧霉胺抗药性的试验[J].沈阳农业大学学报,2002,33(5):345-347.
[3]赵琳,纪明山,祁之秋,等.辽宁省蔬菜灰霉病菌对嘧霉胺的抗药性[J].植物保护,2008,34(3):85-88.
[4]Moyano C,Gomez V,Melgarejo P.Resistance to pyrimethanil and other fungicides inBotrytiscinereapopulations collected on vegetable crops in Spain[J].Journal Phytopathology,2004,152:484-490.
[5]赵玉平,肖春玲.苦荞麦不同器官总黄酮含量测定及分析[J].食品科学,2004,25(10):264-266.
[6]印利梅,礼茜,李红叶.浙江省茄科蔬菜灰霉病菌对嘧霉胺的抗性[J].浙江农业学报,2007,19(2):123-126.
[7]王美琴,赵晓军,张鑫,等.黄瓜灰霉病菌对多菌灵速克灵及乙霉威的抗性检测[J].山西农业科学,2011,39(8):853-855.
[8]林汝法.发挥苦荞种植优势[J].作物杂志,2008(5):1-4.
[9]俞灵莺,李向荣.植物黄酮类抗糖尿病及其并发症的研究进展[J].国外医学:卫生学分册,2000(6):13-17.
[10]刘波,叶钟音,刘经芬,等.对多菌灵、速克灵具多重抗性的灰葡萄孢菌株性质的研究[J].南京农业大学学报,1994,16(3):50-54.
[11]纪明山,程根武,张益先,等.灰霉病菌对多菌灵和乙霉威抗性研究[J].沈阳农业大学学报,1998,29(3):213-216.
[12]纪兆林,童蕴慧,张建军,等.灰葡萄孢对速克灵抗性的研究[J].扬州大学学报,2003,24(3):60-63.
[13]赵晓军,周建波,张鑫,等.山西省晋北地区蔬菜灰霉病菌对腐霉利的抗药性检测[J].农业技术与装备,2011(6):68-70.
[14]周明国,叶钟音.植物病原菌对苯并咪唑类及相关杀菌剂的抗药性[J].植物保护,1987,13(2):31-33.
[15]Lorez D H,Eikhorn K W.Botrytiscinereaand its resistance to dicarboximide fungicides[J].European and Mediterranean Plant Protection Bulletin,1982,12:137-143.
[16]Leroux P.Recent development in the mode of action of fungicides[J].Pestcide Science,1996,47:191-197.
[17]Chapeland F,Fritz R,Lanen C,et al.Inheritance and mechanisms of resistance to anilinopyrimidine fungicides inBotrytis cinerea(Botryotiniafuckeliana)[J].Pesticide Biochemistry and Physiology,1999,64:85-100.
[18]Hilber U W,Hilber-Bodmer M.Genetic basis and monitoring of resistance ofBotryotiniafuckelianato anilinopyrimidines[J].Plant Disease,1998,82(5):496-50.
[19]Latorr B A,Spadaro I,Rioja M E.Occurrence of resistant strains ofBotrytiscinereato anilinopyrimidine fungicides in table grapes in Chile[J].Crop Protection,2002,21(10):957-961.
[20]Hilber U W,Schüepp H.A reliable method for testing the sensitivity ofBotryotiniafuckelianato anilinopyrimidinesin vitro[J].Pesticide Science,1996,47:241-247.
[21]Hilber U W,Schüepp H.Mycelial growth test for assessment of anilinopyrimidine sensitivity of grey mould(Botryotinia fuckeliana)[J].EPPO Bull,1996,26:184-186.
[22]Rueegg J,Lauber H P,Siegfried W,et al.Experiences with anilinopyrimidines in Switzerland[J].Pesticide Outlook,1997,8(3):28-33.
[23]Forster B,Staub T.Basis for use strategies of anilinopyrimidine and phenylpyrrole fungicides againstBotrytiscinerea[J].Crop Protection,1996,15(6):529-537.
Resistance ofBotrytiscinereato pyrimethanil on vegetables in Shanxi Province
Zhao Xiaojun1, Ren Lu1,2, Zhou Jianbo1, Yin Hui1
(1.InstituteofPlantProtection,ShanxiAcademyofAgriculturalSciences,Taiyuan030032,China;2.CollegeofAgriculture,ShanxiAgriculturalUniversity,Taigu030801,China)
One hundred and seventy-one isolates ofBotrytiscinereawere collected from dozens of vegetables fields in different regions of Shanxi Province in2010-2011 to survey the sensitivity ofB.cinereato pyrimethanil.The sensitivity was determined by the method of minimal inhibitory concentration.The results showed that the average resistance frequency and resistance level were 50.29%and 1 423.4 times,respectively,in Shanxi Province.Resistance ofB.cinereato pyrimethanil varied in different regions.The highest resistance frequency was 100%in Shuozhou,where more pyrimethanil had been used,compared with in other regions.
grey mould disease;Botrytiscinerea; pyrimethanil; fungicide resistance; vegetable
S 481.4
A
10.3969/j.issn.0529-1542.2012.05.025
2011-12-19
2012-01-05
山西省青年科技研究基金(2010021033)
* 通信作者Tel:0351-7120597;E-mail:zhaoxiaojun0218@yahoo.com.cn

