rno-miRNA-133b对大鼠骨髓间充质干细胞增殖的影响
黄伟聪,王珏,,杨凯,旷文安,张浩,孙成超
(1.温州医学院附属第一医院 心胸外科,浙江 温州 325000;2.北京阜外心血管病医院 再生医学实验室,北京 100037)
骨髓间充质干细胞(bone marrow derived mesenchymal stem cells,BMSCs)具有取材方便、能进行体外培养、免疫原性低、可诱导分化成不同类型的成熟细胞等优点,目前已成为再生医学研究中的热点种子细胞,在心血管疾病及其他疾病的治疗中有着广泛的研究和应用前景[1-2]。但是,由于BMSCs在骨髓中原始数量少,需要长时间的体外扩增才能达到临床研究和应用的数量要求,因此增强BMSCs增殖的能力在临床干细胞研究和治疗应用中至关重要。
miRNAs是近年来发现的一类内源性非编码单链RNA,长度在20~23个核苷酸,在种属间具有高度保守性,其通过抑制靶点mRNA的翻译或者促进降解而对基因的表达发挥负调控作用,参与调控生命细胞水平的一系列重要进程,包括细胞增殖、凋亡、分化及肿瘤形成等[3]。体外研究中发现miRNA-133b对心脏成纤维细胞、心肌祖细胞及平滑肌内皮细胞增殖具有调控作用[4-6]。本研究为了确定miRNA-133b对BMSCs的作用,在体外培养条件下,利用siPORT NeoFX转染rno-miRNA-133b模拟物(mimic)/抑制剂(inhibitor)至大鼠来源的BMSCs,上调/抑制细胞中miRNA-133b活性以探讨其对BMSCs增殖和凋亡的影响,并利用生物信息学方法预测其靶点基因,初步分析miRNA-133b影响BMSCs增殖的可能机制。
1 材料和方法
1.1 实验动物 Spraque Dawley(SD)大鼠由温州医学院实验动物中心提供,体质量60 g,研究经温州医学院实验委员会批准。
1.2 主要试剂 DMEM培养基、PBS、青链双抗、胰蛋白酶(北京四环生物有限公司),胎牛血清FBS(美国Gibco公司)。MTS细胞增殖/毒性检测试剂盒(美国Promega公司),Brdu细胞增殖比色法测定试剂盒(美国eBioscience公司)。TUNEL荧光法凋亡检测试剂盒(德国Roche公司),rno-miR-133b mimic、inhibitor及其阴性对照(NC)(上海吉玛公司)。rnomiR-133b mimic序列为sense:5’-UUUGGUCCCCUUCAA CCAGCUA-3’,antisense:5’-GCUGGUUGAAGGGGACCAAA UU-3’;rno-miR-133b mimic NC序列为sense:5’-UUCUCCGAACGUGUCACGUTT-3’,antisense:5’-ACGUGA CACGUUCGGAGAATT-3’;rno-miR-133b inhibitor序列为5’-UAGCUGGUUGAAGGGGACCAAA-3’;rno-miR-133b inhibitor NC序列为5’-CAGUACUUUUGUGUAGUA CAA-3’。SiPORT NeoFX转染试剂(美国ABI公司)。
1.3 仪器设备 细胞培养超净台GB-II(北京长城空气净化设备公司),CO2恒温细胞培养箱(美国Thermo公司),酶标仪Model680(美国BIO-RAD公司),realtime-PCR仪7300(美国AB公司),荧光显微镜及图像采集系统(日本Olympus公司)。
1.4 实验方法
1.4.1 细胞培养:原代培养大鼠BMSCs,无菌条件下分离大鼠的股骨和胫骨,以适量DMEM冲出骨髓,用含10% FBS的DMEM培养基在37 ℃,5% CO2培养箱中培养24 h后更换培养基,以后每2~3 d更换培养基,细胞融合70%~80%时用胰蛋白酶消化传代,取生长良好的2代细胞,更换成含5% FBS的DMEM培养基进行以下实验。
1.4.2 转染及实验分组:rno-miR-133b mimic、inhibitor及其各自NC干粉加适量DEPC水配置成终浓度为30μmol/L的工作液。细胞接种后,按照siPORT NeoFX说明书进行转染,并分为4组:过表达组(miR-133b mim组)、过表达组阴性对照组(NC-mim组)、抑制组(miR-133b inh组)、抑制组阴性对照组(NC-inh组),按目的继续培养用于后续实验。
1.4.3 转染效率检测:TaqMan qRT-PCR验证转染效率,接种第二代BMSCs于T25培养瓶中,按1.4.2方法转染及分组,培养24 h后按照Trizol试剂盒说明提取各组总RNA,利用TaqMan miRNA逆转录试剂盒和TaqMan miRNA探针在realtime-PCR仪上行定量PCR,结果以u6 snRNA为内参,利用2-ΔΔCt方法计算目标miRNA-133b的相对表达水平。免疫荧光转染效率检测,用siPORT NeoFX转染带GFP荧光的miRNA于6孔板中爬片的BMSCs,继续培养24 h,更换培养基,4%多聚甲醛固定,Dil染细胞膜,DIAP染核,荧光显微镜下观察并记录。
1.4.4 MTS和Brdu法检测细胞增殖:取生长良好的第二代BMSCs,以每孔1.5×103个细胞接种于96孔板,按1.4.2方法同期做细胞转染及分组,每组设6孔。于转染后24、48和72 h用MTS法各检测一块板,检测时每孔加入20μL MTS检测试剂,并设置调零孔,放于37 ℃,5% CO2培养箱中孵育2 h后,用全自动酶标仪检测OD490值。另于转染后24 h,于每孔中加入BrdU 10μL,并设置细胞背景孔,继续培养12~24 h,按照Brdu细胞增殖比色法测定试剂盒的说明操作,固定细胞,孵育一、二抗并显色,于加入终止液半小时内用全自动酶标仪检测计算OD450-OD595值。
1.4.5 TUNEL免疫荧光染色:取第二代BMSCs以2.5×105/mL细胞密度接种6孔板,每孔2 mL进行细胞爬片,按1.4.2方法转染及分组后继续培养48 h,按TUNEL荧光法凋亡检测试剂盒说明操作,同期行DAPI细胞核染色。荧光显微镜下每张片随机选取9个视野拍片,计数细胞中凋亡细胞所占百分比。
1.4.6 靶基因预测及基因功能分类:采用Target-Scan和PicTar两个数据库进行miRNA-133b检索,预测其靶点基因,并对这些靶点基因进行初步基因功能分类。
1.5 统计学处理方法 采用SPSS16.0统计软件,数据以±s表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 siPORT NeoFX转染miRNA-133b效率检测 利用siPORT NeoFX转染带GFP荧光的miRNA在荧光显微镜下观察发现,GFP荧光成功出现在BMSCs中(见图1)。同时利用TaqMan qRT-PCR检测转染效率发现利用siPORT NeoFX转染的miR-133b mim组较NC-mim组能够明显上调细胞中的miRNA-133b表达(P<0.01),而miR-133b inh组较NC-inh组能够明显下调细胞中的miRNA-133b表达(P<0.01)(见图2)。

图1 荧光显微镜下见绿色荧光出现在BMSCs细胞中(右)(DiL染细胞膜,DAPI染核,×400)
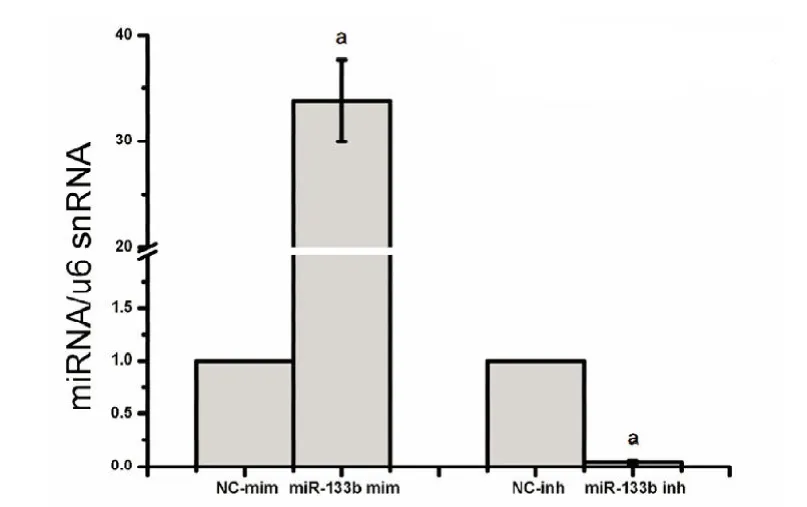
图2 TaqMan qRT-PCR验证转染效率(以u6 snRNA为内参,计算与各自的NC组之比:aP<0.01,n=3)
2.2 miRNA-133b mimic和inhibitor对BMSCs增殖能力的影响 BMSCs接种于96孔板并行同期转染后24、48和72 h行MTS法检测活细胞数(见表1),发现转染后24~72 h miR-133b mim组OD490值明显高于NC-mim组(P<0.05)。而转染后24~72 h miR-133b inh组OD490值明显低于NC-inh组(P<0.05)。相似的结果在转染后24 h的Brdu细胞增殖比色法测OD450-OD595值中再次得到验证(P<0.05)(见表2)。
表1 MTS法检测各组OD490值(n=3±s)

表1 MTS法检测各组OD490值(n=3±s)
与各自的NC组比:aP<0.05
组别NC-mim组miR-133b mim组NC-inh组miR-133b inh组24 h 0.459±0.12 0.539±0.12a 0.473±0.11 0.444±0.09a 48 h 0.720±0.13 0.753±0.16a 0.733±0.12 0.686±0.10a 72 h 1.028±0.18 1.100±0.19a 1.014±0.17 0.946±0.13a
表2 Brdu法检测各组OD450-OD595值(n=3±s)

表2 Brdu法检测各组OD450-OD595值(n=3±s)
与各自的NC组比:aP<0.05
组别NC-mim组miR-133b mim组NC-inh组miR-133b inh组24 h 0.873±0.05 1.024±0.13a 0.897±0.04 0.810±0.06a
2.3 miRNA-133b mimic和inhibitor对BMSCs凋亡的影响 TUNEL免疫荧光检测转染48 h后各组细胞凋亡情况,DAPI和TUNEL同时阳性(DAPI+-TUNEL+)的细胞核被认为是发生凋亡的BMSCs,呈现黄绿色荧光(见图3)。各组在凋亡细胞百分比上差异无统计学意义(P>0.05)(见表3)。

图3 TUNEL荧光染色结果(DAPI染核,TUNEL,×400)
表3 TUNEL法检测各组细胞凋亡百分比(n=3±s)

表3 TUNEL法检测各组细胞凋亡百分比(n=3±s)
组别NC-mim组miR-133b mim组NC-inh组miR-133b inh组凋亡细胞百分比(%)4.032±0.13 4.113±0.20 4.250±0.16 4.206±0.19
2.4 miRNA-133b靶基因预测及基因功能分类TargetScan和PicTar两个数据库分析提示,miRNA-133b的靶点中存在部分调节细胞增殖的基因位点(见表4)。

表4 miRNA-133b与细胞增殖调节相关部分预测靶点基因
3 讨论
BMSCs在临床干细胞治疗研究和应用中具有广阔前景,但如何提高BMSCs体外扩增效率是一个亟待解决的问题。研究发现低强度激光照射、改良培养系统及各种细胞因子刺激等能增强BMSCs的增殖[7-8],但目前对miRNAs与BMSCs增殖方面的研究还比较少。研究发现miRNA-133能够促进肌成纤维细胞和心肌祖细胞的增殖[4-5],而在血管平滑肌细胞中发现miRNA-133能调控其表型改变,且功能学研究中上调miRNA-133活性能抑制其增殖[6]。相同miRNA在不同细胞中对细胞增殖调控结果的不一致,可能与不同细胞中特异的基因表达相关。本研究为了明确miRNA-133b对BMSCs增殖和凋亡的作用,利用siPORT NeoFX成功地将rno-miRNA-133b mimics/inhibitors转染至大鼠来源的BMSCs,并观察上调/抑制miRNA-133b活性对细胞的影响。结果表明上调/抑制miRNA-133b活性,对细胞凋亡无显著影响,但能够促进/减少BMSCs的增殖,表明miRNA-133b对BMSCs的增殖能力具有调控作用。
目前已发现的miRNA-133家族中主要包括3个成员,即miRNA-133a-1、miRNA-133a-2和miRNA-133b,它们分别与miRNA-1-2、miRNA-1-1和miRNA-206在不同的染色体上如多顺反子一样被同时转录,且miRNA的表达存在细胞、组织和器官的特异性,miRNA-133和miRNA-1家族主要在骨骼肌和心肌细胞中呈高表达。miRNA-133和miRNA-1通过调控Srf、Hand2、CyclinD2、Irx5、Detal等基因参与心肌和骨骼肌细胞的分化、发育等过程[9]。Ning等[10]发现miRNA-133b能通过胰岛素样生长因子(IGF-I)信号调控介导脂肪来源的干细胞分化。另外在肿瘤学研究中,miRNA133家族与多种肿瘤的发生、分化、增殖及迁徙等密切相关[11-12]。本研究中发现miRNA-133b能够促进BMSCs数量的扩增,但在临床研究和应用中的生物安全性是否可靠,对BMSCs分化有无影响,仍需要更深入地研究。
miRNA 5’端第2~7个核苷酸被称为种子序列,可通过碱基互补配对的方式与靶点基因的mRNA 3’端非翻译区(3’UTR)结合发挥基因调控作用[3]。目前生物信息学基于miRNA与其靶点基因mRNA 3’UTR的互补配对的原理,开发了TargetScan、PicTar、RNA22、PITA和miRanda等多种miRNAs靶点基因预测软件。本研究中利用较为常用的TargetScan和PicTar对miRNA-133b的靶点基因进行预测,并利用Gene Ontology数据库对这些可能的靶点进行初步的基因功能分类,发现miRNA-133b的预测靶点基因的功能涉细胞增殖、分化、凋亡、信号转导等。与细胞增殖调节相关的部分预测靶点基因在表4中列出,其中Srf、Furin蛋白在肌成纤维细胞的增殖调控中发挥重要作用[4,13]。Chen等[4]发现miR-133通过负调控Srf基因增强肌成纤维细胞的增殖,而后者作为一种转录因子调控肌成纤维细胞中增殖相关基因的表达。鉴于肌成纤维细胞在生物学特性上与BMSCs具有一定的相似性,miRNA-133b在BMSCs中是否是通过调控Srf基因,或者其他的靶点基因发挥促增殖作用,我们将在下一步研究中进行验证。
总之,我们的研究发现miRNA-133b在不影响BMSCs细胞凋亡的情况下对其增殖能力具有调控作用,而在miRNA-133b靶点基因的验证及其对BMSCs分化上,仍需做进一步研究。
[1] Jiang Y, Jahagirdar BN, Reinhardt RL, et al. Pluripotency of mesenchymal stem cells derived from adult marrow[J].Nature,2002,418(6893):41-49.
[2] Flynn A, O’Brien T. Stem cell therapy for cardiac disease[J].Expert Opin Biol Ther,2011,11(2):177-187.
[3] Huang Y, Shen XJ, Zou Q, et al. Biological functions of microRNAs: a review[J]. J Physiol Biochem,2011,67(1):129-139.
[4] Chen JF,Mandel EM,Thomson JM,et al.The role of microRNA-1 and microRNA-133 in skeletal muscle proliferation and differentiation[J].Nat Genet,2006,38(2):228-233.
[5] Ivey KN,Muth A,Arnold J,et al.MicroRNA regulation of cell line ages in mouse and human embryonic stem cells[J].Cell Stem Cell,2008,2(3):219-229.
[6] Torella D,Iaconetti C,Catalucci D,et al.MicroRNA-133 controls vascular smooth muscle cell phenotypic switch in vitro and vascular remodeling in vivo[J]. Circ Res,2011,109(8):880-893.
[7] Hou JF,Zhang H,Yuan X,et al.In vitro effects of low-level laser irradiation for bone marrow mesenchymal stem cells:proliferation, growth factors secretion and myogenic differentiation[J].Lasers Surg Med,2008,40(10):726-733.
[8] Duan J,Kuang W,Tan J,et al.Differential effects of platelet rich plasma and washed platelets on the proliferation of mouse MSC cells[J]. Mol Biol Rep,2011,38(4):2485-2490.
[9] Cordes KR, Srivastava D. MicroRNA regulation of cardiovascular development[J].Circ Res,2009,104(6):724-732.
[10] Ning H, Huang YC,Banie L,et al.MicroRNA regulation of neuron-like differentiation of adipose tissue-derived stem cells[J].Differentiation,2009,78(5):253-259.
[11] Kano M,Seki N,Kikkawa N,et al.miR-145,miR-133a and miR-133b:Tumor-suppressive miRNAs target FSCN1 in esophageal squamous cell carcinoma[J].Int J Cancer,2010,127(12):2804-2814.
[12] Rao PK, Missiaglia E,Shields L,et al.Distinct roles for miR-1 and miR-133a in the proliferation and differentiation of rhabdomyosarcoma cells[J].FASEB J,2010,24(9):3427-3437.
[13] Dogar AM,Towbin H, Hall J.Suppression of latent transforming growth factor (TGF)-beta1 restores growth inhibitory TGF-beta signaling through microRNAs[J].J Biol Chem,2011,286(18):16447-16458.

