生长抑制剂对老芒麦种群生物量结构、能量分配及倒伏率的影响
刘金平,游明鸿
(1.西华师范大学生命科学院,四川 南充637009;2.四川省草原科学研究院,四川 成都611731)
老芒麦(Elymus sibiricus)为禾本科披碱草属多年生疏丛型禾草[1],“川草2号”老芒麦(E.sibiricus cv.chuancao No.2)是目前我国青藏高原东缘广泛种植的一个优良牧草品种[2,3],为该地区生态保护、草地改良、退牧还草、种草养畜以及人草畜三配套等工程中的骨干牧草品种。近年来,川西高原建成3 500hm2种子基地,近100 000hm2人工草地,进行老芒麦草产品与种子的产业化生产。由于高原特殊的自然条件,狂风暴雨频发,常引起盛花期或灌浆期的老芒麦草地倒伏,不仅影响光合作用与种群透气性,更引起茎叶霉变、种子干秕,给后期管理、打草收种、机械操作带来诸多困难,造成种子与草产品产量与质量的下降,倒伏成为影响产业化生产的主要问题。通过栽培养护技术研究与集成,提高老芒麦种群抗倒伏能力,是高寒牧区老芒麦产业化生产、草地畜牧业健康发展急需解决的生产实践问题。
种群构件的分析方法在草本植物研究上有较多的应用[4-7]。构件数量与性状不仅决定种群同化作用的能力,对于植株生物量分布、能量积累及抗逆性都有极其重要的作用。有研究表明多效唑(PP333)、RSW0411、矮壮素(CCC)等生长抑制剂对紫花苜蓿(Medicago sativa)、白三叶(Trifolium repens)、蓝茎冰草(Agropyron smithii)及多年生黑麦草(Lolium perenne)等牧草的构件性状、物质积累及种子产量有影响[8-12],尤其对抑制株高、促进物质积累和转运、提高抗倒伏能力有重要的作用[13-15]。目前,老芒麦的研究多集中于资源评价、品种选育及栽培利用、草产量动态及适应性等研究[16-22],关于生长抑制剂对老芒麦种群构件组成、生物量结构及能量分配与抗倒伏性的影响报道较少。
试验通过拔节期或孕穗期施用不同浓度的PP333或CCC后,于盛花期分析老芒麦种群的根、茎、叶、花序等构件生物量、能量累积及分配,研究生长抑制剂种类、浓度及施用时期对老芒麦生产能力及抗倒伏的影响,探讨提高种子与草产品产量与质量的途径,以期为高寒牧区割草地以及牧草种子生产经营管理提供实用的技术支撑,为该区畜牧业发展、农业产业结构调整和生态环境治理等提供服务。
1 材料与方法
1.1 试验地概况
试验于阿坝州红原县邛溪镇二农场进行,为大陆性高原温带季风气候,东经102°32′、北纬32°46′、海拔3 497 m,年均温1.1℃,极端高温23.5℃,极端低温-33.8℃,年降水量738mm,相对湿度71%,≥10℃年积温仅865℃。土壤为草甸土,0~20cm 土壤的有效氮、有效磷、有效钾含量分别为276mg/kg,10.2mg/kg,131 mg/kg,有机质含量5.87%,pH 值5.91。
1.2 试验材料及设计
以川草2号老芒麦原种为材料。在播幅30cm、行距40cm建成5年的种子生产基地上,选择地势平坦、长势均匀的区域,按10m×10m=100m2,间距2m,划分小区。拔节期统一追施复合肥(N-P-K为14-16-15)150 kg/hm2。采用随机区组3次重复试验设计,分别于拔节期(A1)、孕穗初期(A2)喷施生长抑制素,用量为1L/10m2,对照喷清水。具体处理见表1。

表1 依据生长抑制素种类、浓度及施用时间的处理编号Table 1 No.and type,concentration and application time of inhibitor mg/L
1.3 测定指标及方法
生物量结构:盛花期,在小区中间随机取50cm长的样段,齐地刈割地上部分,称鲜重后,摊薄均匀选取1kg鲜草,3次重复。分离装袋的叶、茎、花序在105℃下烘至恒重后称重,计算每hm2构件生物量,其和为地上生物量总量;按50cm(长)×30cm(宽)×30cm(高)挖取茎基与根系,测定根系深度、分布范围后,冲洗泥土后装袋,把茎基与根系分开,在105℃下烘至恒重后称重,计算每hm2构件生物量,其和为地下生物量总量。
能量分配:把烘干叶、茎(含茎基)、花序、根系粉碎后,用parr1281氧弹量热仪检测单位重量构件热能值,计算每hm2构件能量值。
倒伏率:植株倾斜度大于45°面积占小区总面积的百分数。
鲜草产量:盛花期,在小区中间随机取50cm长的样段,齐地刈割地上部分,称鲜重后,计算单位面积产量,换算成kg/hm2。
潜在种子产量=生殖枝数/m2×小穗数/生殖枝×小花数/小穗×种子千粒重/1 000。
种子产量:蜡熟期,小区中间随机取50cm长的样段,人工收种,3次重复,计算单位面积的种子产量,换算成kg/hm2。
1.4 数据处理
采用SAS 9.1进行多重比较、析因分析与相关性分析。
2 结果与分析
2.1 生长抑制剂对老芒麦种群生物量结构的影响
生长抑制剂对老芒麦种群生物量总量、地上与地下生物量有极显著影响(P<0.01)(表2),对根、茎、叶、花序等构件的生物量均有极显著影响(P<0.01),受影响程度是根>茎>叶>花序。
拔节期施用适当浓度的生长抑制剂可显著增加茎、叶生物量;孕穗期施用则不增加甚至减少茎、叶生物量;矮壮素对茎、叶生物量的影响强于多效唑;多效唑可增加种群花序生物量,而矮壮素对种群花序生物量无增加作用。拔节期施用生长抑制剂可增加种群地上生物量,而孕穗期施用促进不明显甚至减少地上生物量的累积。牧草生产中,在拔节期,300~400mg/L的矮壮素可显著提高产量。
地下生物量由根系与茎基两部分组成,生长抑制剂对两者均有极显著影响(P<0.01)。拔节期施用生长抑制剂可促进茎基生物量累积,矮壮素与多效唑间无显著差异。拔节期施用生长抑制剂显著提高了根系生物量,而孕穗期施用效果较差。任何时期施用生长抑制剂均有利于老芒麦种群地下生物量的累积,拔节期施用600mg/L的多效唑或300~400mg/L的矮壮素极显著提高地下生物量,为提高种群的生产潜力与抗逆能力奠定基础。

表2 生长抑制剂对老芒麦生物量结构影响的多重比较Table 2 Multiple comparison on biomass structure of E.sibiricus after applying inhibitor kg/hm2
2.2 生长抑制剂对老芒麦种群能量结构的影响
2.2.1 对单位构件生物量能量值的影响 不同构件单位生物量能量值间有差异,由大到小为根>叶>花序>茎。生长抑制剂对根、花序单位生物量的能量值无显著影响(P>0.05)(表3),但显著影响叶、茎的能量值。拔节期施用600mg/L的多效唑,孕穗期施用200~600mg/L的多效唑或200~400mg/L的矮壮素,显著提高了叶片的能量值。拔节期施用100mg/L的矮壮素、孕穗期施用400~800mg/L的多效唑显著提高了茎的能量值。可见,生长抑制剂对茎、叶的营养成分组成与比例的影响大于根与花序,影响顺序为叶>茎>根>花序。
2.2.2 对构件能量及总累积的影响 生长抑制剂对种群各构件能量累积均有极显著影响(P<0.01),影响顺序为茎>叶>花序>根。各构件能量累积的极显著差异导致种群单位面积累积总能量也呈极显著差异(P<0.01)。拔节期或孕穗期施用多效唑可显著提高单位面积能量的累积,但施用浓度不能高于600mg/L。拔节期施用矮壮素的效果好于多效唑,尤其200mg/L处理下,累积能量达128 544.3kJ/hm2,比CK高出31.70%;但孕穗期施用矮壮素则显著降低了累积能量,施用400mg/L时仅为CK能量的77.50%。

表3 生长抑制剂对老芒麦能量累积影响的多重比较Table 3 Multiple comparison on energy accumulation of E.sibiricus after applying inhibitor
2.3 对老芒麦种群各构件生物量与能量比例的影响
生长抑制剂极显著影响种群构件生物量与能量分配(P<0.01)(表4),影响为花序>茎>叶>根,生物量与能量分配呈现出一定的协同性。拔节期施用矮壮素有利于生物量与能量向茎、叶分配,孕穗期施用矮壮素仅利于向茎分配,施用浓度对生物量与能量分配有显著影响(P<0.05)。多效唑有利于生物量与能量向花序分配,拔节期施用效果显著高于孕穗期。生长抑制剂极有利于生物量与能量向根系分配,施用浓度越大根系生物量、能量越大。
2.4 对老芒麦种群生物量与能量累积及分配影响的析因分析
按抑制剂种类(L)、施用时间(M)、施用浓度(N)进行三因素析因分析,结果表明各构件生物量与能量累积及分配均受L、M、N、LM、LN、MN、LMN的极显著影响(P<0.01)(表5)。
2.5 对老芒麦种群倒伏率影响及其与生物量、能量分配的相关分析
生长抑制剂显著降低了老芒麦种群的倒伏率(P<0.01)(表6),倒伏率极显著受L、M、N、LM、LN、MN、LMN的影响。多效唑效果好于矮壮素。拔节期施用多效唑效果好于孕穗期,而矮壮素孕穗期施用效果更佳。施用浓度越大倒伏率越低。
相关分析说明,倒伏率与根系生物量、能量比例呈极显著负相关(P<0.01)。叶、茎生物量、能量比例与花序生物量、能量比例呈极显著负相关(P<0.01),与倒伏率存在一定的正相关。
2.6 生长延缓剂对老芒麦草地生产能力的产量影响
生长抑制剂对老芒麦鲜草产量有极显著影响(P<0.01)(表7),拔节期施用200~300mg/L的多效唑或100~400mg/L的矮壮素可显著提高鲜草产量(P<0.05),孕穗期施用生长抑制剂则降低了鲜草产量。矮壮素对提高或降低鲜草产量的影响大于多效唑。拔节期施用200mg/L的矮壮素的产量比CK提高了10.22%。
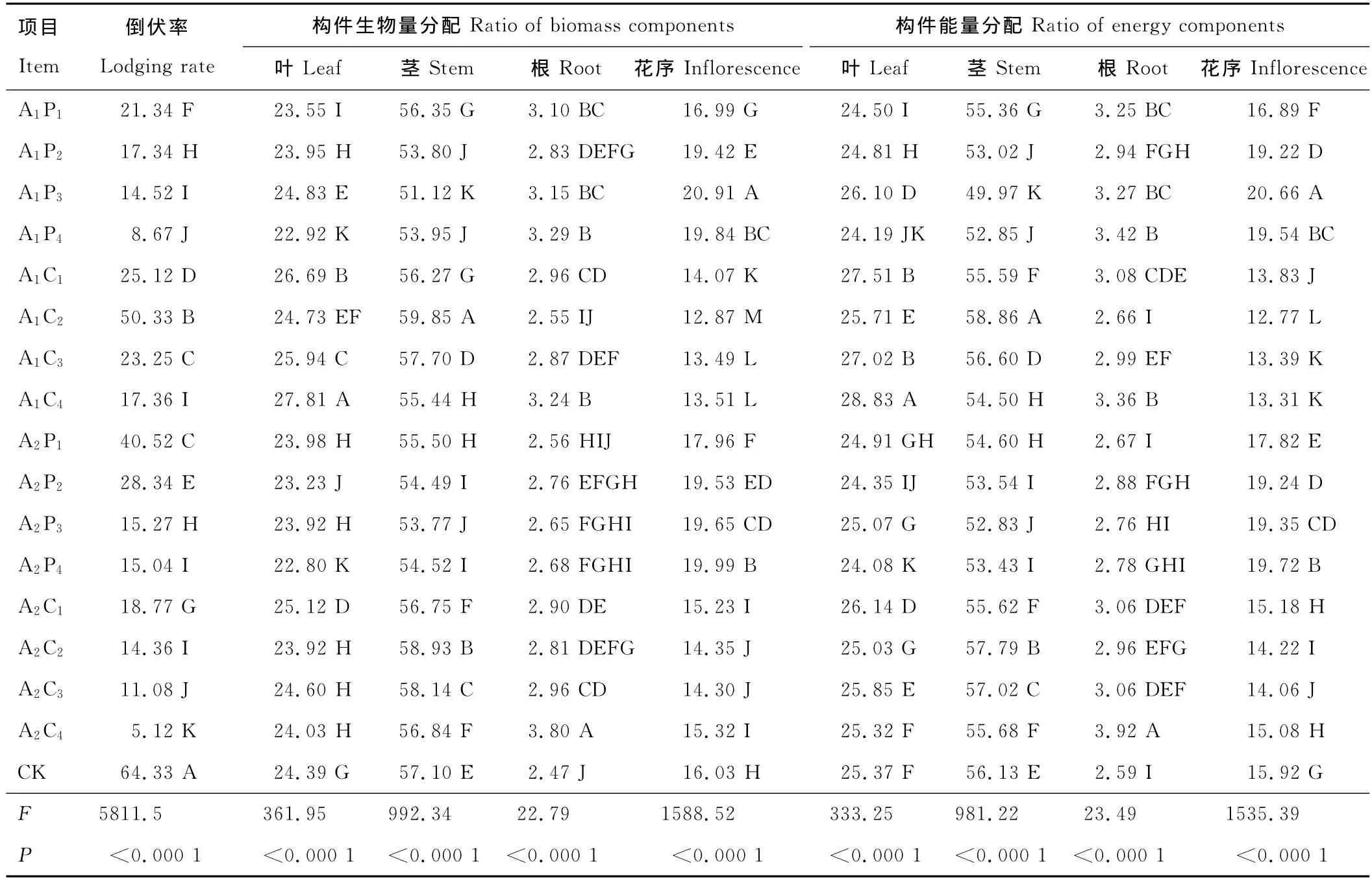
表4 生长抑制剂对老芒麦生物量与能量分配影响的多重比较Table 4 Multiple comparison on biomass and energy distribution of E.sibiricus after applying inhibitor %
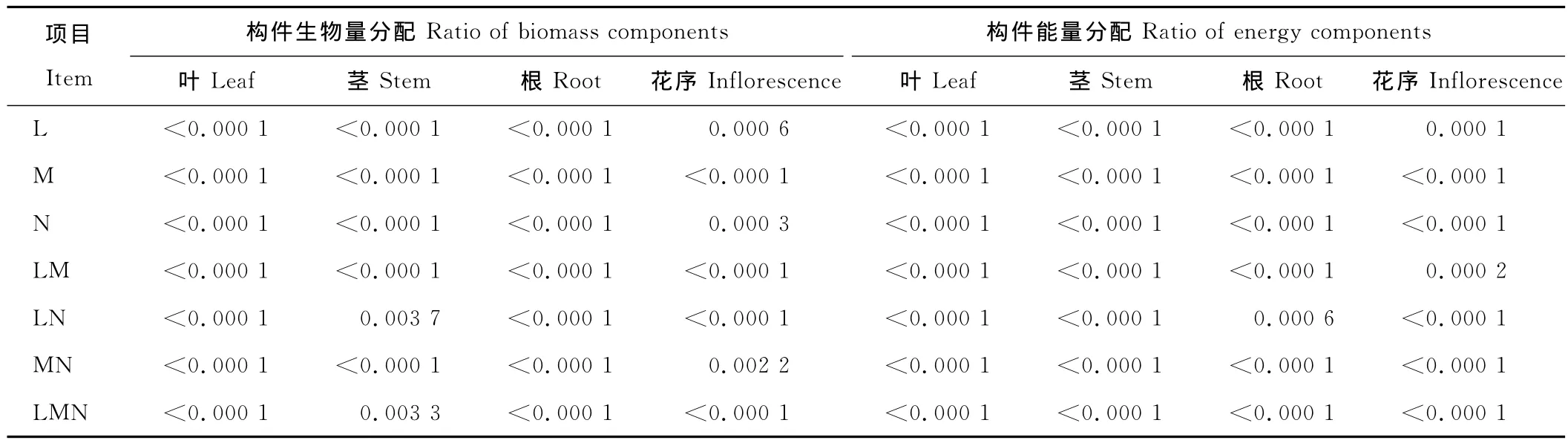
表5 生长延缓剂对老芒麦种群生物量与能量分配影响的分析(P值)Table 5 Factorial analysis on biomass and energy distribution of E.sibiricus after applying inhibitor %
潜在种子产量与实际种子产量极显著受生长延缓剂的影响(P<0.01)(表7)。多效唑提高了种群生殖枝比例,拔节期施用400~800mg/L多效唑,降低了小穗数/枝,增加了小花数/枝;孕穗期施用200~600mg/L多效唑可显著增加小穗数/枝与小花数/枝,使潜在种子产量显著提高(P<0.05)。矮壮素促进分蘖,影响营养生长向生殖生长的转化,浓度越大对潜在种子产量的抑制作用越明显,孕穗期施用的抑制作用显著高于拔节期施用的(P<0.05)。拔节期施用200~800mg/L的多效唑显著提高种子产量(P<0.05);孕穗期施用400~600mg/L增产效果明显,但高浓度则显著降低了种子产量。矮壮素对种子产量的促进作用,显著低于多效唑,孕穗期施用效果显著优于拔节期(P<0.05)。
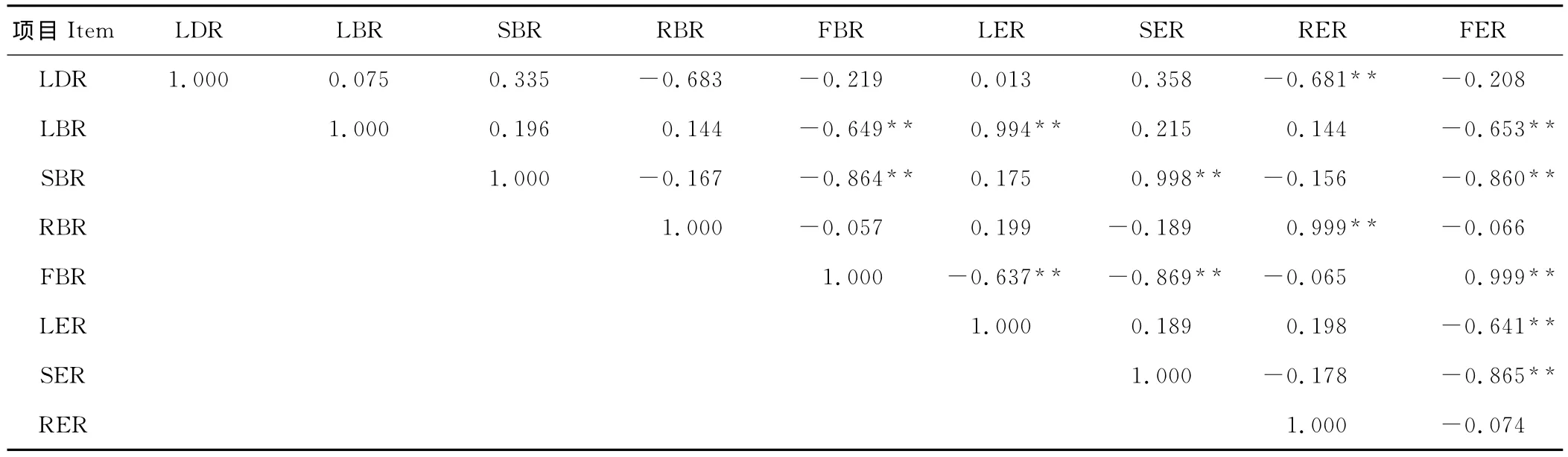
表6 倒伏率与构件生物量、能量比例的相关分析Table 6 Related analysis about lodging rate and ratio of component biomass and energy
3 结论与讨论
3.1 构件生物量累积与分配
多效唑和矮壮素是常用的2种生长延缓剂,主要抑制内源赤霉素的生物合成,通过影响根、茎、叶、花序等构件数量性状,表现出降低株高和节间长度,增加茎粗和分蘖,提高抗性与产量等效果[23]。在农作物及果树栽培中应用广泛,但施用后结论不尽相同,其喷施效果受抑制剂种类、浓度、施用时期、作物品种、植株密度及土壤水肥条件等因素的影响[24]。本研究中,生长抑制剂种类、浓度及施用时间对种群生物量结构均有极显著影响。老芒麦为分蘖潜力极强的根茎—疏丛型禾草,2种抑制剂均促进分蘖形成,矮壮素促分蘖效果好于多效唑。在拔节期施用显著增加了种群地上生物量,而孕穗期施用不增加甚至减少了地上生物量,这是因为生长抑制剂主要作用是抑制内源赤霉素、减弱顶端生长优势、促进分蘖滋生。老芒麦在拔节期,植株生长迅速、顶端优势明显,而孕穗期由营养生长转向生殖生长,2个时期生长特点的不同,致使拔节期施用生长抑制剂显著促进了茎基生物量累积,有利分蘖形成而增加了地上生物量。不同种类生长抑制剂的差异明显,矮壮素主要影响种群茎、叶生物量,而多效唑主要影响种群花序生物量。老芒麦草地管理中,必须正确选择生长抑制剂,牧草生产施用矮壮素或多效唑均可,而种子生产只能施用多效唑,同时施用浓度对构件生物量有显著影响,必须注意施用浓度。试验表明,拔节期施用200~300mg/L的多效唑或100~400mg/L的矮壮素可显著提高鲜草产量,拔节期施用200mg/L矮壮素可提高鲜草产量10.22%,拔节期施用600mg/L的多效唑使潜在种子产量、实际种子产量分别提高46.21%和65.89%,值得在生产中推广。
3.2 构件能量累积与分配
笔者曾对不同行距下老芒麦叶、茎、根、花序的单位生物量能量值进行测定,发现行距虽然影响种群密度、高度及各构件生物量比例,但对同一构件单位生物量能量值无显著影响。但施用生长抑制剂不仅改变了种群的生物量结构,对茎、叶单位生物量能量值产生了显著影响,对花序、根能量值影响较小。施用抑制剂使叶色浓绿、茎节粗短,实质是直接影响了药物受体茎、叶细胞的分裂、发育及代谢过程,引起茎、叶细胞密度和物质合成及累积的差异。根、花序不是施药的受体构件,受茎叶代谢、水热条件等内外因子的间接影响及空间时间的稀释作用,所以其单位生物量能量值差异较小。种群构件能量累积值主要由构件生物量决定,其实生物量是能量累积的结果与表达,种群生物量结构只是植物生长过程中能量累积及构件间权衡与分配的结果。生长抑制剂通过改变内源激素的比例,影响构件的细胞分裂、组织分化及器官形成,从而影响植物同化作用与能量分配,最终表现为生物量结构的差异。施用浓度、施用时间及环境条件对抑制剂效果有直接影响,致使用同一抑制剂对同一植物研究的结果大相径庭,如对小麦(Triticum aestivum)研究,有的认为显著提高产量[25,26],有的认为增产不显著[27],还有的认为产量降低[28]。所以,实践生产中要依据收获植物部位,结合植物生物学、生态学特点,结合生长情况及生境条件,适时、适量、科学地施用生长抑制剂,才能实现提高种子与鲜草产量与质量的目标。
3.3 倒伏率与根系性状
倒伏是影响川西北地区老芒麦产业化生产的主要问题之一,不仅影响光合作用与种群透气性,引起茎叶发黄腐烂、传花授粉受阻、籽粒干秕,给后期水肥管理、机械打草收种、产品加工调制带来诸多困难,造成产量与质量的下降,甚至导致种子绝收。试验表明,施用生长抑制剂可显著降低倒伏率,拔节期施用多效唑、孕穗期施用矮壮素效果最佳。抑制剂促进根系生物量累积,是提高老芒麦抗倒伏的根本原因。2种抑制剂虽然在促进生物量(能量)向茎、叶、花序分配方面存在差异,但均有利于根系的生长发育,拔节期施用多效唑,孕穗期施用矮壮素,降倒伏率效果最佳。生产实践发现,老芒麦有茎倒伏与根倒伏2种情况:茎倒伏表现为茎秆倾斜或弯曲或下折,常由茎秆细弱、节间过长、机械组织发育不良或大风等机械作用,使茎不能承受穗部或植株上部的重量而引起。根倒伏则为茎不弯曲而整株倾倒,常由根系弱浅或受伤,或土壤持水过多,或狂风暴雨引发。施用生长抑制剂可使节间缩短,植物变矮、根系发达,增强老芒麦种群的抗倒伏能力,但不能彻底解决由土壤持水过多、机械损伤等引发的倒伏。生产中必须充分利用气候条件、选择适当耕作栽培措施、加强水肥等田间管理、合理施用生长抑制剂,通过系统的综合的技术措施解决或降低倒伏带来的损失与危害。
[1] 陈默君,贾慎修.中国饲用植物[M].北京:中国农业出版社,2002:121-122.
[2] 鄢家俊,白史且,张新全,等.青藏高原东南缘老芒麦自然居群遗传多样性的SRAP和SSR分析[J].草业学报,2010,19(4):122-134.
[3] 游明鸿,刘金平,白史且,等.行距对“川草2号”老芒麦生殖枝及种子产量性状的影响[J].草业学报,2011,20(6):299-304.
[4] Abulfaith H A,Bazzaz F A.The biology of Ambrosia trifida L.Ⅳ.demography of plants and leaves[J].New Phytologist,1980,84:107-112.
[5] 董鸣,张淑敏,陈玉福.匍匐茎草本蛇莓对基质养分条件的克隆可塑性[J].植物学报,2000,42(5):518-522.
[6] 刘金平,张新全,游明鸿.野生扁穗牛鞭草无性系种群构件组成及生物量结构多样性[J].生态学报,2006,26(11):3656-3660.
[7] 刘金平,游明鸿.肥料和除草剂混施对老芒麦构件组成及生物量结构的影响[J].中国草地学报,2010,32(4):42-48.
[8] 李有涵,谢昭良,解新明.5个象草品种的构件生物量特征及分配动态[J].草业学报,2011,20(5):11-18.
[9] 丁成龙,沈益新,顾洪如.春施多效唑对高羊茅生长及种子生产的影响[J].草业学报,2002,11(4):88-93.
[10] 霍成君,韩建国,毛培胜,等.矮壮素和多效唑对草地早熟禾草坪质量的影响[J].草地学报,2000,8(2):137-143.
[11] 李世忠,赵涛,柏永华,等.多效唑对蓝茎冰草种子产量的影响[J].西北农业学报,2008,17(2):313-316.
[12] Rijckaert G.Screening Trial with Growth Regulators on White Clover Seed Production[M].Mededeling Fac.Landbou wetenschappen,Rijksuniversiteit Gent,1988:1402-1407.
[13] 苟文龙,何光武,张新跃,等.多效唑对多花黑麦草生长及种子产量的影响[J].草地学报,2005,13(4):349-351.
[14] Gilley A,Fletcher R A.Gibberellin antagonizes paclobutrazol induced stress protection in wheat seedling[J].Journal of Plant Physiology,1998,153(1):200-207.
[15] 魏小星,郭文山,孙彦.生长调节剂对紫花苜蓿种子产量及产量构成要素的影响[J].草业科学,2009,26(6):121-125.
[16] 游明鸿,刘金平,白史且,等.肥料和除草剂混施对老芒麦生产性能的影响[J].草业学报,2010,19(5):283-286.
[17] 毛培胜,韩建国,王颖,等.施肥处理对老芒麦种子质量和产量的影响[J].草业科学,2001,10(4):7-13.
[18] 徐智明,周青平,刘云芬,等.平衡施肥对老龄多叶老芒麦种子产量的影响[J].甘肃农业大学学报,2004,(6):639-643.
[19] 刘文辉,周青平,颜红波,等.高寒地区施肥对短芒老芒麦草产量和种子产量的影响[J].草地学报,2007,15(2):193-195.
[20] 贺晓,李青丰.4种微量元素对老芒麦种子质量的影响[J].草业学报,2007,16(3):88-92.
[21] 张锦华,李青丰,李显利.氮、磷肥对旱作老芒麦种子生产性能作用的研究[J].中国草地,2001,23(2):38-41.
[22] 毛培胜,韩建国,吴喜才.收获时间对老芒麦种子产量的影响[J].草地学报,2003,11(1):33-37.
[23] 袁剑平,刘华山,彭文博,等.多效唑对小麦形态和某些生理特性影响的研究[J].河南农业大学学报,1993,27(1):16-20.
[24] 张丽华,马瑞昆,姚艳荣,等.植物生长抑制剂对冬小麦茎秆特性、物质转运及产量的影响[J].中国农学通报,2008,24(10):146-149.
[25] 李春喜,尚玉磊,姜丽娜,等.不同植物生长抑制剂对小麦衰老机产量构成的调节效应[J].西北植物学报,2001,21(5):931-936.
[26] Aufhammer W,Fedrolf K G.Effect of seed treatments with plant growth regulators on development and yield of winter hard wheat[J].Bodenkultur,1992,43(2):99-108.
[27] 纪华,赵春江,王北洪,等.拔节后期施用植物生长抑制剂对小麦倒伏及穗花发育的影响[J].北京农业科学,2000,18(2):7-10.
[28] 鲍思敬,杨兆生,许红霞,等.多效唑对小麦不同品种主要性状的效应研究[J].河南农业大学学报,1995,29(2):192-195,199.

