胶质瘤细胞系摄取BPA的实验研究
杨 磊,王 潇,隋 丽,孔福全,郝小娟,郑洁莹,马南茹,崔素珍,刘权卫,赵 葵
(中国原子能科学研究院,北京 102413)
1 前言
癌症对人类健康威胁极大,癌症病人每年新增逾百万,其中恶性肿瘤的死亡率相当高,因此,癌症的诊断和治疗已成为医学上的一大难题。传统的肿瘤治疗方法有化疗、放疗和外科手术等,尽管这些治疗方法对某些癌症取得了一些成功,但对部分恶性肿瘤(如脑胶质瘤和黑色素瘤等),上述治疗方法尚无能为力。
理想的放射治疗方法要求能选择性地杀死肿瘤细胞,而不破坏正常脑组织的结构和功能。硼中子俘获治疗(boron neutron capture therapy,BNCT)从理论上能满足上述要求,预期成为一种理想的胶质瘤等恶性难治肿瘤的治疗方法。
BNCT兼有中子穿透力和重离子的杀伤力,能够同时歼灭分裂和不分裂的肿瘤细胞。有自适应定位能力,对肿瘤体周边组织无明显的辐射损伤。BNCT几乎集中所有针对恶性肿瘤放射性治疗的优点,特别适用于治疗脑胶质瘤(glioblastoma multiforme,GBM)[1,2]。我国 GBM 年发病率,据推测人数在3万~6万/年,多发于青壮年。BNCT为许多用传统方法无法治疗的肿瘤提供了一种新的治疗方法。
目前,由周永茂院士研发、凯佰特公司投资、中国原子能科学研究院设计建造的世界首台“医院中子照射器”已达临界投入运行,为开展BNCT研究提供了最重要的平台。“医院中子照射器”是一种基于微型反应堆的、在细胞尺度治疗癌症的新型核技术医疗器械。虽然该装置已于2009年12月临界,但是要达到进行BNCT的目标仍任重道远,其中包括对该装置中子特性(中子能谱、中子通量分布)的研究、含硼药物研究、中子辐射微剂量学研究以及必要的为临床准备的医学实践等。
BNCT方法的成功之处在于有足够的10B到达肿瘤细胞的同时,有很少的含硼药物到达健康组织。用适当的中子剂量照射目标组织,对肿瘤细胞产生的剂量应足够大,以使细胞中毒而又在正常组织的忍受范围之内。因此,准确地控制细胞中硼的宏观浓度在BNCT研究上非常重要。本实验对胶质瘤细胞对BPA的摄取和析出进行了相关的研究,为今后将要进行的BNCT细胞辐照实验提供了剂量计算的重要数据和实验依据。
2 实验材料及方法
2.1 实验材料
C6(大鼠脑胶质瘤)细胞系、U251(人脑胶质瘤)细胞系均购自北京协和细胞中心(Cell Resource Center)。新生Wistar大鼠购自北京芳元缘养殖场。BPA由美国俄亥俄州立大学杨伟廉教授惠赠,其结构见图1。
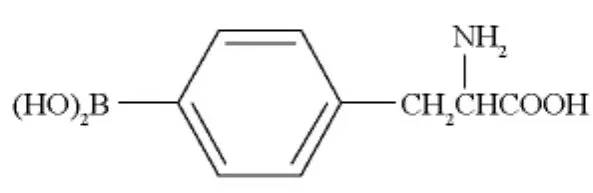
图1 BPA结构Fig.1 BPA structure
2.2 BPA-果糖溶液的配制
取 BPA 粉末 522.75 mg(2.5 mmol),果糖450 mg(2.5 mmol),溶于 80 mL 去离子水中,加入少许NaOH溶液加速溶解。待粉末完全溶解后,加HCl溶液,调节溶液pH 7.4左右。最后用去离子水定容100 mL。最终所得溶液 BPA浓度为2.5×10-5mol/mL,即10B 的浓度为 2.5 × 10-5mol/mL(250 μg/mL)。将溶液通过 0.2 μm 微孔滤膜过滤除菌,以备使用。
2.3 大鼠脑胶质细胞对BPA的摄取实验
2.3.1 大鼠胶质细胞的提取及培养
将出生1~2 d的新生Wistar大鼠脱颈处死,用75%的酒精浸泡消毒后,采用无菌方法迅速取出大脑,用Hanks液洗涤并剔除脑膜和血管,取大脑皮质,用0.25%胰蛋白酶,37℃消化数分钟,用吸管反复吹打后过滤,离心(1000 r/min,3 min),吸去上清,加入DMEM(dulbecco modified eagle medium)培养基制成细胞悬液。计数后按2×105mL接种于培养皿,并加入DMEM培养基,在37℃、5%CO2培养箱中培养,每3 d更换培养液,10 d左右细胞铺满培养皿。
选用2 d的大鼠进行星形胶质细胞培养,而且培养皿没有经过多聚赖氨酸预处理(因为在没有多聚赖氨酸的情况下,神经元细胞贴壁能力非常弱),可以最大程度地减少皮质神经元的污染。
2.3.2 实验方法
向培养皿中加入不同体积的BPA-果糖溶液,使 BPA 终浓度分别为 20、40、60、80、100 μg/mL。培养24 h后,用胰蛋白酶消化收集细胞,离心(1500 r/min,5 min),弃上清,向待测样品中加入0.3 mL的70%高氯酸、0.6 mL的30%双氧水和5 μL的磷酸,然后用磁力恒温搅拌器升温到90℃左右,进行水浴加热2 h。加入生理盐水稀释定容至5 mL,保证稀释样品中的硼浓度大于感应耦合等离子体原子发射光谱仪(induced couple plasma-atomic emission spectroscopy,ICP -AES)的检测下限,用微孔滤膜过滤后,以未经含硼培养液孵育的样本调节零点,采用感应耦合等离子体原子发射光谱法测定溶液中硼的浓度,每组样本进行3次平行测量。
2.4 U251细胞系对BPA的摄取实验
2.4.1 U251 细胞的培养
U251细胞系为人脑胶质瘤细胞系。细胞置于MEM培养基中培养,其中含15%胎牛血清(杭州四季青生物公司),100 Ku/L的青霉素,100 mg/L的链霉素。培养条件:37℃,5%CO2/95% 空气,100%相对湿度下生长。2~3 d传代一次,倒置显微镜观察细胞形态,使细胞处于未分化的对数生长期。
2.4.2 实验方法
实验过程及ICP-AES样本的制备方法同2.3.2 节。
2.5 C6细胞系对BPA的摄取及析出实验
2.5.1 C6 细胞的培养
C6细胞系为大鼠脑胶质瘤细胞系。细胞在含5%胎牛血清(杭州四季青生物公司)、15%马血清(奥地利PAA公司)、1×105U/L青霉素、100 mg/L链霉素的F10培养基中,置于37℃的5%CO2孵箱中培养,保持饱和湿度。每2~3 d换液1次,待细胞增长至70%融合时,消化以1∶3分瓶传代。
2.5.2 C6细胞对BPA的摄取实验
实验过程及ICP-AES样本的制备方法同2.3.2 节。
2.6 室温下C6细胞对BPA的析出实验
将C6细胞培养在含BPA浓度分别为20、60、100 μg/mL的培养基中,24 h后,小心吸出培养液,以PBS液洗涤3遍,然后加入不含BPA的培养基在25℃条件下继续培养,并分别在换液后的1、2、3 h后,加入0.25%的胰蛋白酶在37℃环境中消化1 min。加入常规培养液中止消化,将细胞悬液转移入离心管内,反复吹打形成单个细胞悬液,计数后,按上述方法制备样本,采用ICP-AES法测定溶液中硼的浓度,每组样本进行3次平行测量。
2.7 不同温度下C6细胞对BPA的析出实验
将C6细胞培养在含BPA浓度为60 μg/mL的培养基中,24 h后,小心吸出培养液,以PBS液洗涤3遍,然后加入不含 BPA的培养基,分别在4、25、37℃条件下继续培养,并分别在换液后的1、2、3 h后,加入0.25%的胰蛋白酶在37℃环境中消化1 min。加入常规培养液中止消化,将细胞悬液转移入离心管内,反复吹打形成单个细胞悬液,计数后,按上述方法制备样本,采用ICP-AES法测定溶液中硼的浓度,每组样本进行3次平行测量。
3 实验结果和讨论
3.1 结果
3.1.1 3种细胞内硼含量随培养基中硼浓度的变化
3种细胞(C6,U251,大鼠胶质细胞)在含不同硼浓度(0、20、40、80、100 μg/mL)的培养基中培养24 h后,细胞内硼含量(μg/107cells)变化如图2所示。每个细胞内10B原子的数据见表1。

表13种细胞每个细胞内硼原子数随培养基中硼浓度的变化Table 1 Number changes of boron atom per cell in three kinds of cells with the boron concentration of the culture medium
由图2可见,随着培养基中BPA浓度的增加,3种细胞内的10B浓度均呈上升趋势。与两种胶质瘤细胞相比,大鼠胶质细胞内10B浓度变化较为平缓。并且,在不同培养基BPA浓度的培养条件下,两种胶质瘤细胞内的10B浓度显著高于胶质细胞(P<0.01),而两种胶质瘤细胞的硼浓度相互间无显著差异(P >0.05)。在培养基中BPA浓度分别为 20、40、80、100 μg/mL 的条件下,C6 细胞内的10B浓度与胶质细胞内的10B浓度之比为2.2、1.87、2.1、2.2、2.3;U251 细胞与胶质细胞内的10B 浓度之比为 1.8、1.7、2.2、2.2、2.3。
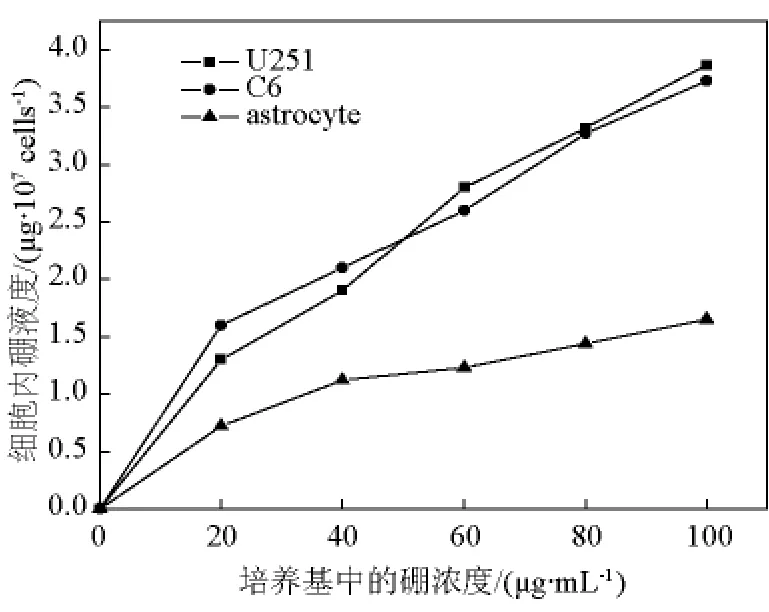
图23种细胞内硼含量随培养基中硼浓度的变化Fig.2 Boron content changes in three kinds of cells with the boron concentration of the culture medium
3.1.2 C6细胞在室温下对10B的析出
在室温(25℃)下,更换培养液后于不同的时间点(1、2、3h)检测 C6细胞内10B的含量(μg/107cells),结果分别见图3和表2。

图325℃时C6细胞内10B的析出Fig.3 10B decrease in C6 cells in 25 ℃
由结果可见,C6细胞内10B浓度随培养时间的增加而逐渐减少。3 h后,当培养基中的BPA浓度分别为20、60、100 μg/mL 时,每个 C6 细胞内的10B原子个数(由表中结果计算可得)为7.1×109、11.3×109、15.5 × 109个/cell。利用指数衰减模型模拟曲线后,可得 BPA 浓度为 20、60、100 μg/mL 时,C6细胞的10B析出速率分别为(0.127±0.012)、(0.115 ±0.005)、(0.126 ±0.005)h-1,并无显著性差异,平均值为0.123 h-1。因此在室温(25℃)下,换液后C6细胞内10B浓度C(μg/107cells)可表示为:
C = C0× e-0.123t
式中,C0为细胞内初始10B浓度,可由培养基中BPA浓度得到;t为换液后的时间。
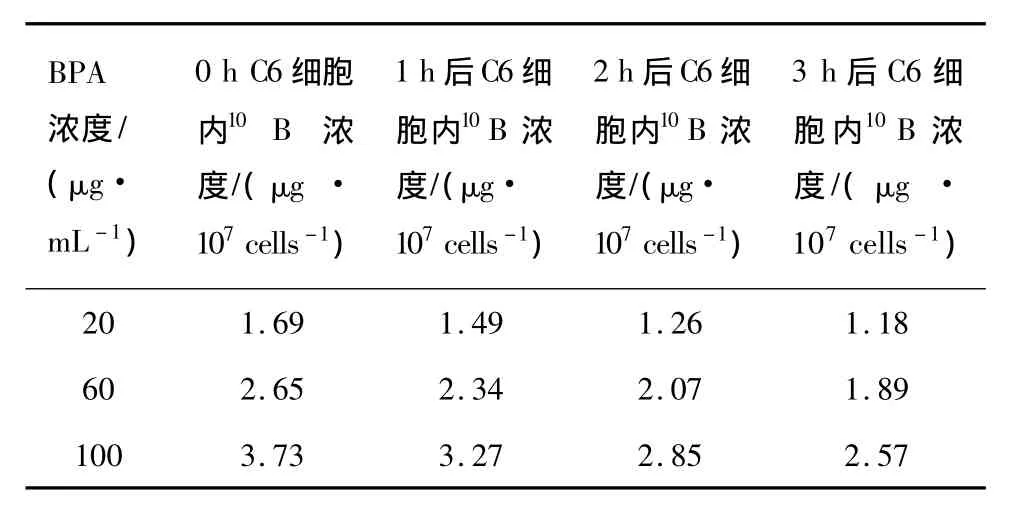
表225℃时C6细胞内10B的析出Table 2 10B decrease in C6 cells in 25℃
3.1.3 C6细胞在不同温度下对10B的析出
在不同温度(4、25、37℃)下,更换培养液后不同时间点(1、2、3 h)检测 C6细胞内10B的含量(μg/107cells),结果分别见表3和图4。
由结果可见,更换培养液后,C6细胞内10B浓度随培养时间的增加而逐渐减少,并且不同温度下,10B析出速率不同,温度越高,速率越大。利用指数衰减模型模拟曲线后,可得温度为4、25、37℃时,C6细胞的10B析出速率分别为(0.021±0.002)、(0.115 ±0.005)、(0.328 ± 0.006)h-1。并且在37℃条件下,3 h后,每个C6细胞内10B原子个数为6.1 ×109个/cell。
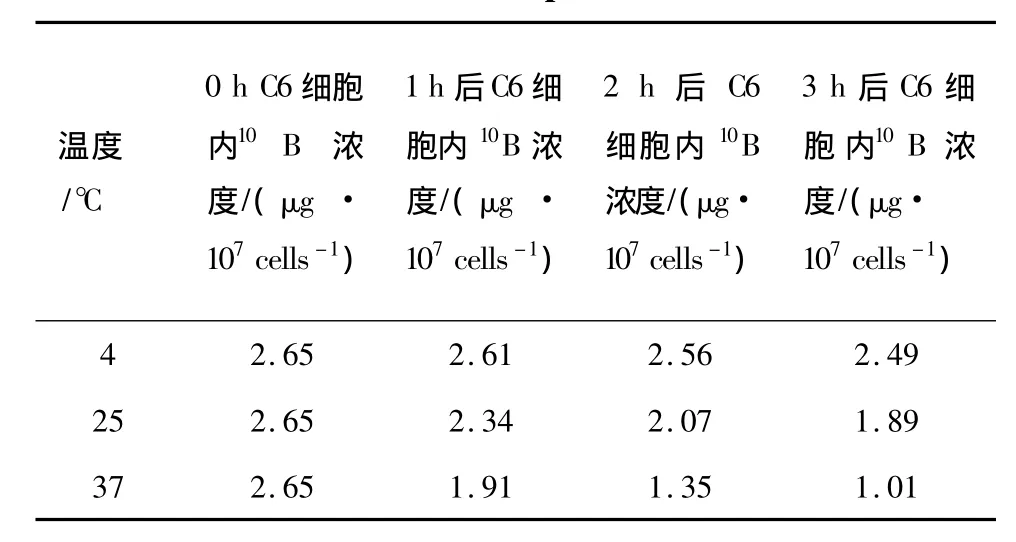
表3 不同温度下C6细胞内10B的析出Table 3 10B decrease in C6 cells in different temperatures
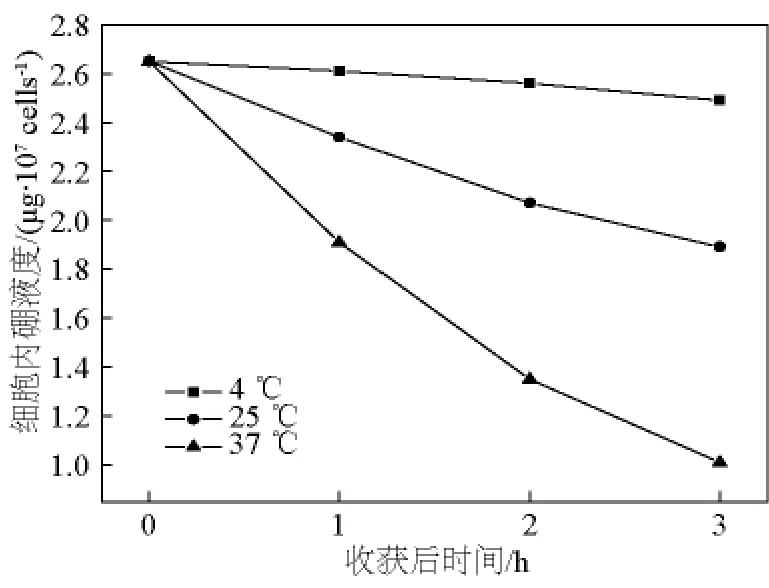
图4 不同温度下C6细胞内10B的析出Fig.4 10B decrease in C6 cells in different temperatures
3.2 讨论
1936年,Locher首次提出BNCT治疗肿瘤的设想。此后,多国科学家利用不同的硼化合物和反应堆进行了一系列的实验研究。但早期的研究结果并不理想,其主要原因之一是硼化合物对肿瘤的亲和力不够强,10B不能富集到肿瘤内。经过不懈的探索,20世纪80年代后期,日本神户大学医学院的Yutaka及其同事合成了BPA,将其用于动物实验取得了较理想的效果[3]。
作为BNCT中使用的硼携带剂,应具备以下特点:选择性结合肿瘤细胞,最好能在瘤细胞内、尤其是细胞核内聚集;不论单独使用或与其他硼化合物结合使用,其浓度应达到每个瘤细胞内约109个10B原子,或每克肿瘤组织中10B含量为20~35 μg;肿瘤与正常组织浓度比达3∶1~4∶1;在照射治疗期间能在肿瘤组织中保持一定浓度;肿瘤中聚集的硼化物对人体无毒性[4]。有实验证明,当大鼠血脑屏障未被破坏时,BPA注射2.5 h后的肿瘤与血液浓度比为8.5,肿瘤与脑组织浓度比为5.9;当血脑屏障被破坏后,注射2.5 h后,肿瘤与血液BPA浓度比达10.9,肿瘤与脑组织浓度比可达 7.5[5]。在实验中,于含硼培养液中培养24 h后,C6和U251两种胶质瘤细胞与星形胶质细胞的硼浓度比平均为2.0和2.2,有显著性差异。虽然与文献报导的体内实验结果有些差距(这可能与肿瘤组织内某些特殊的微环境因素有关,体外实验不可能完全模拟体内的状况),但此结果仍能说明BPA对胶质瘤细胞的高选择性。同时,在不同浓度含硼培养基中培养24 h后,两种胶质瘤细胞内的硼原子数均达到109个;在C6细胞的硼析出实验中,在析出速率最快(37℃)的条件下,3 h后,每个细胞内的硼原子数依然有109个,表明在实验所选择的BPA浓度跨度(20~100 μg/mL),温度跨度(4~37 ℃)和时间跨度(1~3 h)下,BPA达到了BNCT所要求的每个瘤细胞内应有109个10B原子的最低要求。
BPA是一种酪氨酸前体类似物,其选择性作用机制尚不清楚。起初有人认为,BPA仅通过自由扩散进入瘤细胞内,也有学者表明了它与另一种含硼药物BSH相比,主动运输在细胞吸收BPA的过程中起到了重要作用[6,7]。有文献报导[3],在一定浓度的含硼培养基中,随着孵育时间的延长,C6、SHG-44和BT-325三种胶质瘤细胞内BPA浓度逐渐增加,至24 h末仍有继续增加的趋势,而大鼠星形胶质细胞在孵育前12 h内逐渐上升,后12 h内浓度趋于稳定。这在一定程度上说明了除自由扩散外,尚有主动运输这一吸收方式的存在。BPA可能参与处于分裂细胞、尤其是胶质瘤细胞的生命活动。实验还表明,C6、SHG-44和BT-325三种胶质瘤细胞G2/M期与G0/G1期相比,硼含量均明显增高,说明有丝分裂的过程可以加速BPA的吸收,而主动运输也许就出现在有丝分裂过程中。同时,3种胶质瘤细胞与星形胶质细胞相比,G2/M期浓度均有显著提高,而且星形胶质细胞最终硼浓度趋向稳定,表明胶质瘤的有丝分裂过程与正常胶质细胞的差异性决定了对BPA的主动运输作用。G0/G1期的胶质瘤细胞内硼浓度与胶质细胞相比,浓度差异不如G2/M期明显,可能是因为这一期瘤细胞对BPA的吸收以自由扩散为主,而这一方式不依赖于细胞类型。并且,作为酪氨酸类似物,BPA应由细胞的L-氨基酸转运系统运输,在细胞内部不会产生代谢变化[8]。因此,在硼析出实验中,采用指数衰减模型模拟硼析出速率是合理的[9]。
实验采用的两种胶质瘤细胞系中,C6来源于大鼠,而U251为人源性。两种瘤细胞的生物学特性相近,对BPA的吸收作用也相近,这说明了BPA对胶质瘤作用的广泛适用性。
本项工作为以后将要进行的BNCT实验提供了建立10B浓度-细胞存活率数学模型,以及辐照过程中的剂量计算所需的基本数据。
为了从理论上建立相似的模型,有学者用蒙特卡罗模拟方法,通过微剂量学模型来计算高LET射线穿过核时的径迹,以期得到细胞或亚细胞水平上的吸收剂量及其生物学效应。然而,通过这种方法很难得到一个与实验结果相符的正确结论,因为在计算过程中,细胞的形态以及硼化合物在细胞内的分布都是假设值。在实际过程中,细胞的形态以及10B在细胞内的微观分布可能会随在照射过程中发生改变。这些因素对于BNCT的生物学效应的评估造成了很大的不确定性。与理论模型相反,笔者从实验结果中提取的数学模型,避免了相关的假设条件,很大程度上降低了不确定性,因而能更准确地评价硼中子俘获反应的生物学效应。
在建立此数学模型的过程中,由于是离体系统,因此细胞的外部环境一定要小心的调控,并保持恒定,特别是外界环境的温度条件,因为由硼析出实验的结果可知,温度对硼的析出速率有着较大的影响。
4 结语
实验进行了不同胶质瘤细胞系对10B的摄取及析出的实验研究,并建立了在本实验室条件下利用ICP-AES精确检测细胞内10B浓度的方法。实验结果表明,含硼药物BPA对不同的胶质瘤细胞系(U251,C6)有广泛的亲和力;并得到了在不同10B浓度和温度条件下胶质瘤细胞10B的析出速率,表明胶质瘤细胞的10B析出速率与温度之间存在依赖关系,即环境温度越高,析出速率越大,并建立了相应的计算细胞内10B浓度的数学模型。本项工作为以后将要进行的BNCT细胞实验提供了剂量计算,以及建立10B浓度-细胞存活率数学模型所需的基本数据。此模型避免了相关的假设条件,降低了系统的不确定性,可更准确地评价硼中子俘获反应的生物学效应。
但是,由于BNCT过程包含了复杂的物理和生物学因素,因此很难对于其生物学效应做出精确的评估。可以通过增加细胞内10B浓度,以及中子注量的方法来增强BNCT过程对肿瘤细胞的杀伤效果,但这也同样增加了对正常组织细胞的危害。因此,目前优化BNCT最有效的方法,仍然是加强含硼化合物对肿瘤的亲和力,最大限度地将10B浓聚于肿瘤细胞内。
[1] 罗全勇,朱瑞森.硼中子俘获治疗[J] .同位素,2004,17(3):174-177.
[2] Barth RF,Soloway AH,Fairchild RG.Boron Neutron Capture Therapy for Cancer[J] .Sci Am,1990,263:103,106 -107.
[3] 曹锐峰,章 翔,陈 伟,等.胶质瘤细胞系摄取BPA实验研究[J] .中华神经外科疾病研究杂志,2003,2(4):343-346.
[4] 张晓敏,张文仲,骆亿生.硼中子俘获治疗技术的研究现状[J] .国外医学(放射医学核医学分册),2004,28(4):188-191.
[5] Yang W,Barth RF,Rotaru JH,et al.Enhanced survival of glioma Learing rats following boron neutron capture therapy with bloodbrain barrier disruption and intracarotid injection of boronophenylalanine[J] .J Neurooncol,1997,33(1 -2):59 -70.
[6] Yang W,Barth RF,Rotaru JH,et al.Boron neutron capture therapy of brain tumors:enhanced survival following intracarotid injection of sodium borocaptate with or without blood-brain barrier disruption[J] .Int J Radiat Oncol Biol Phys,1997,37(3):663 -672.
[7] Capala J,Makar MS,Coderre JA.Accumulation of boron in malignant and normal cells incubated in vitro with boronophenylalanine,mercaptoborane or boric acid [J] .Radiat Res,1996,146(5):554-560.
[8] Witting A,Sauerwein WA,Coderre JA.Mechanisms of transport of p-borono-phenylanine through the cell membrane in vitro[J] .Radiat Res,2000,153(2):173 -180.
[9] Hsieha CH,Liub HM,Hwanga JJ,et al.A simple model for quantification of the radiobiological effectiveness of the B-10(n,a)Li- 7 capture reaction in BNCT [J] .Applied Radiation and Isotopes,2006,64:306 -314.

