猪全血中多种病原流行病学监测的初步研究
张 志,王赛赛,李 岚,李 蕾,刘 爽,张艳霞,郑 辉,吴发兴,李晓成,黄保续
(1.中国动物卫生与流行病学中心,山东青岛 2660322;2.福建农林大学,福建福州 350002;3.云南农业大学,云南昆明 650201;4.东北农业大学,黑龙江哈尔滨 150030)
近年来,我国生猪的年存栏量和出栏数居世界首位,一直保持着世界养猪总量的50%左右,在养猪业取得巨大成就的同时,还存在诸多制约我国养猪业健康发展的因素,特别是疾病已经成为最主要的制约因素。据调查,每年因疾病死亡造成的直接经济损失高达数十亿元。
一些常见传染病还没有完全控制,新的传染病又不断涌入,所以导致猪群大量存在多种病原的混合感染。既有病毒与病毒之间的混合感染,又有病毒与细菌之间以及细菌与细菌之间的混合感染。这使得猪群发病后的临床症状复杂,发病率和死亡率升高,由于缺乏有效的诊断和监测手段,配套措施不力等原因,猪群疫病的诊断和防治难度加大。
为有效防控猪病,国家急需猪群疫病相关的数据。从2006年开始,我中心监测室陆续对我国部分省市的猪群开展了一系列的疫病监测,取得了较好结果,但也遇到了一些问题,如采样不便等。传统的病原学诊断和检测大多采取剖检动物,然后取得相应组织脏器进行病原学检测,这种采样和检测的前提是必须要把动物处死,因此用于生产上的临床应用时就显得相当不便。国内外已经有不少关于用活动物的全血进行病原检测的报道,如PRRSV、PCV2等病原的检测,但是至今还未见大规模使用全血进行流行病学监测的报道和做法。
为此,我们监测室在多年开展流行病学监测的基础上,采用了采集猪全血进行多种猪病原的流行病学检测,结果证实,该方法采样方便,操作简单,为顺利开展流行病学调查和监测提供了一条新的思路和做法。
1 材料和方法
1.1 猪抗凝全血 2008和2009年,分别从我国华东、华北、东北、西南和华中等区域10省的规模猪场采集1 389份猪全血,采猪血时加入肝素钠抗凝,置-20℃保存备用。
1.2 主要试剂 DNA提取试剂盒DNAzol Reagent、RNA提取试剂盒TR Izol购自Invitrogen公司,反转录酶AMV、Taq酶购自TakaRa公司,其余试剂均为分析纯产品。
1.3 猪全血核酸的提取 每一份猪全血分别都进行RNA和DNA的提取。
猪全血RNA的提取:取猪全血样品250 μL于1.5 mL的离心管中,加入750 μL TRIZOL(Invitrogen公司),混匀,室温放置5 min;再加入200μL氯仿,振荡混匀,室温放置10 min;12 000 r/min、4 ℃离心15 min,取上清500 μL,加等体积-20 ℃预冷的异丙醇室温静置10 min或-20 ℃静置30 min,12 000 r/min、4 ℃离心10 min;弃上清,加入75%冰冷乙醇(DEPC处理水配制),8 000~9 000 g离心5 min;弃上清,倒置风干,用20 μL DEPC处理水或RNase Free H2O溶解,-20 ℃冻存备用。
猪全血DNA的提取:取猪全血100 μL于1.5 mL的离心管中,加入1 mL DNAZol,倒置混匀,室温放置3 min,10 000 g离心10 min;上清转移至另一离心管中,加入550 mL无水乙醇,颠倒混匀,室温放置5 min,6 000 g离心5 min;沉淀用1 mL 75%的酒精洗涤两次;最后用40 μL的NaOH溶解,-20 ℃保存备用。
1.4 引物和检测方法 根据参考文献[1-6],设计合成相应的检测引物,CSFV、PRRSV、BVDV和JEV等病毒的检测采用RT-PCR方法,PRV和PCV2等病毒的检测采用PCR方法,CSFV、PRRSV、BVDV、PRV、PCV2、JEV等病原的特异性扩增产物的大小预期为272 bp、773 bp、360 bp、632 bp、404 bp和1 015 bp。
1.5 RNA病毒的检测
cDNA的制备:种猪精液提取RNA后,分别用PRRSV、CSFV、BVDV和JEV的引物进行反转录,同时用我实验室已有的阳性病毒作为阳性对照。cDNA反应体系为:RNA 5μL,dNTP 4 μL,5×AMV Buffer 4 μL,反转录引物(25pM)1 μL,AMV 0.5 μL,HPRI 0.5 μL,加入适量DEPC水,总体积为20 μL。42 ℃恒温水浴锅中水浴1.5 h,取出后放入-20 ℃冰箱保存备用。
PCR扩增:分别取PRRSV、CSFV、BVDV、JEV等病毒反转录的cDNA 2.0 μL作为模板,加入10×PCR Buffer 2.5 μL, dNTPs(10 mmol/L)2 μL,分别加入PRRSV等相应病毒特异性的引物P1和P2各0.5 μL,Ex-Taq DNA聚合酶0.25 μL,ddH2O 17.25 μL混匀后采用如下程序进行PCR扩增:94 ℃预变性3 min;94 ℃ 40 s,56 ℃ 1min,72 ℃ 1 min,30个循环;72 ℃延伸10 min。BVDV和CSFV则进行巢式PCR扩增,取上述PCR产物1 μL,用引物P3和P4进行二次扩增,反应条件如下:94℃预变性3 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,32个循环;72 ℃延伸10 min。
1.6 DNA病毒的检测 每一份种公猪精液提取的
DNA样品均进行PRV和PCV2的检测,即每一份DNA分别用PRV和PCV2的特异性引物进行扩增,取提取的DNA样品2 μL,加入10×PCR Buffer 2.5 μL,dNTPs(10mmol/L)2 μL,引物P1和P2各0.5 μL,Ex-Taq DNA聚合酶0.25 μL,ddH2O 17.25 μL混匀后采用如下程序进行PCR扩增:94 ℃预变性3 min;94 ℃ 40 s,56 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃延伸10 min。
1.7 电泳 取10 μL RT-PCR和PCR的扩增产物进行琼脂糖凝胶电泳,在凝胶成像系统中进行观察有无特异性条带。
2 结果
2.1 猪全血中几种病毒PCR扩增情况 PCR或者RTPCR结束后进行电泳,在凝胶成像系统中,PRRSV、CSFV、PRV和PCV2、BVDV和JEV的特异性引物都可以从部分样品中扩增出大小约773 bp、272 bp、632 bp、404 bp、360 bp和1 015 bp的特异性条带,与已知的阳性病毒结果一致,阴性对照未扩增出特异性的条带,这说明检测的样品中含有PRRSV、CSFV、PRV、PCV2、BVDV和JEV。(图略)
2.2 2008年猪全血中几种病原的检测情况 2008年,共从华北、华中和华东地区的3省8个规模猪场采集了439份猪全血样品,分别进行了PRRSV、CSFV、PRV、PCV2和BVDV的检测,阳性率平均为15.0%、61.7%、10.3%、24.4%和2.51%,没有进行JEV的检测。三个区域中,华北地区CSFV的阳性率最高,为22.3%;华东地区的PRRSV、PRV、PCV2和BVDV的感染率均为最高,分别为72.6%、22.6%、62.9%和8.1%。详见表1。
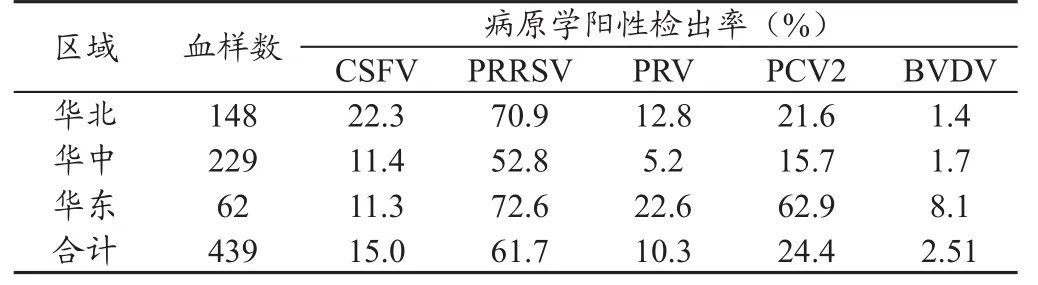
表1 2008年部分地区规模猪场全血样品病原学检测结果
2.3 2009年猪全血中几种病原的检测情况 2009年,除华北、华中和华东地区之外,我们又从东北和西北地区等省的规模猪场采集了950份猪全血样品,分别进行了,PRRSV、CSFV、PRV、PCV2、BVDV和JEV的检测,阳性率平均为19.8%、13.7%、1.1%、31.9%、0.7%和2.7%。五个区域中,华北地区CSFV的阳性率仍最高,为18.9%;东北地区PRRSV和PRV的感染率最高,分别为27.9%和3.2%;华北地区PCV2感染率最高,为37.5%;东北、华北和西北地区均没有检测到JEV;东北和华中地区没有检测到BVDV。从表2中可以看出,PRV的感染率比较低,尽管由于某些原因没有对华北和西北地区的样品进行PRV的检测,但从华东和华中地区JEV的检测结果来看,二者的感染率均为0。详见表2。
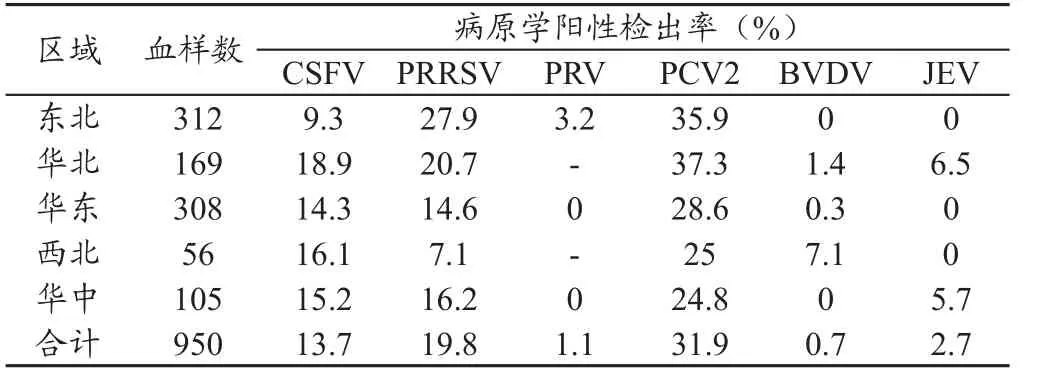
表2 2009年部分地区规模猪场全血样品病原学检测结果
3 讨论
近年来,我国猪群的疫病呈现高发、多发、混合发生的特点,一头猪往往可以感染多种病原。本研究通过对猪群血液进行病原监测,发现2008年,我国部分地区CSFV、PRRSV、PRV、PCV2和BVDV的阳性率平均为15.0%、61.7%、10.3%、24.4%和2.51%,2009年,我国部分地区CSFV、PRRSV、PRV、PCV2、BVDV和JEV的检测,阳性率平均为13.7%、19.8%、1.1%、31.9%、0.7%和2.7%,不同地区之间存在显著差异。这一结果与鞠厚斌等2006—2009年对上海地区病死猪的主要病毒感染状况的调查结果类似,他们也发现上海地区CSFV、PRRSV、PRV和PCV2病料中不同程度地存在这4种疫病的混合感染,而且其检出率分别为21.01%、25.33%、31.84%和42.93%,其中PRV的检出率比本文高[7]。张秀娟[8]采用PCR方法检测采集的临床发病猪病料,对山东省中小养猪场中的猪瘟、猪繁殖与呼吸综合征、猪伪狂犬病、猪圆环病毒病2型和猪流感等5种猪主要疫病的流行状况进行了调查,结果表明2006年5种疫病的阳性率分别为35.47%、34.72%、12.46%、33.58%和14.72%;2006—2008年各年混合感染率分别为24.91%、27.99%、20.20%。这些结果都说明:一是病原的多重感染已经成为猪群疫病的主要特点,而且感染的疫病种类主要是猪瘟、猪繁殖与呼吸综合征以及猪圆环病毒;二是我国猪群中存在了牛病毒性腹泻病毒的感染,其来源和在猪群中的危害应引起人们的重视和关注。
不同病原的特性决定了病原在动物组织内的分布呈现差异性,不同组织内不同病原的含量不同,因此,如何选择采样部位非常重要。血液作为一种比较易获取的样品一直受到兽医工作者的青睐,根据动物流行病学的研究表明,在常见的几种猪病中,猪瘟病毒、猪圆环病毒、猪繁殖障碍综合征病毒、牛病毒性腹泻病毒等病原均可以在猪血液中长期存活,提示可以通过血液检测上述几种病原。国内多年来已经使用商业化的试剂盒直接对血液中的猪瘟病毒进行检测,国外Qiang L等[9]对猪血清中的PCV进行检测,正常表现的猪可以检测到50%的阳性率。MacDonald等[10]从171份血清中进行PCV的检测,首先利用血清学方法从中检测出28份抗体阳性(滴度大于16),然后利用PCR方法从这28份血清中检测到13份病毒DNA阳性,随后从这13份血清中分离到9株PCV,这说明用血液进行PCV病毒的检测是可行有效的。本文对1 389份全血进行的病原检测也充分证实了我们这一推测的可行性。因此,在对上述几种疫病进行监测时,可以采集血液送检,这将极大方便开展流行病学调查和监测工作。
[1] 朱小甫,张志,李晓成,等.猪瘟病毒RT-nested PCR检测方法的优化和应用[J].西北农林科技大学(自然科学版),2007,35(6):11-14.
[2] 宋永峰,张志,李晓成,等.猪源牛病毒性腹泻病毒的流行初探[J].中国动物检疫,2008,25(7):25-27.
[3] 吴发兴,谢生亮,张燕霞,等.我国南方某省猪繁殖与呼吸综合征病毒分离株分子流行病学分析[J].中国动物检疫,2008,25(8):23-25.
[4] 吴发兴,郑辉,亓传德,等.猪伪狂犬病病毒PCR检测方法的建立与应用[J].动物医学进展,2009,30(5):5-9.
[5]刘 辉,熊金凤,邹浩勇,等.猪瘟病毒、猪繁殖与呼吸障碍综合征病毒和乙型脑炎病毒多重RT-PCR检测方法的建立[J].华中农业大学学报,2008(27):12-18.
[6] 董志强,张志,李晓成,等.猪圆环病毒PCR检测方法的优化[J].中国病毒学,2006,21(4):405-407.
[7] 鞠厚斌,曹火仁,张维谊,等,近年来上海地区病死猪主要病毒感染状况调查[J].中国动物传染病学报,2010,18(1):40-44.
[8] 张秀娟.山东部分地区中小规模猪场主要疫病的流行状况调查[J].山东畜牧兽医,2009,150(7):67-69.
[9] Qiang L,Li W,Phil W,et al.Quantitative,Competitive PCR Analysis of Porcine Circovirus DNA in Serum from Pigs with Postweaning Multisystemic[J].Journal of clinical microbiology,2000,38(9):3474–3477.
[10] MacDonald W F,Young K C,Sagar M G, et al. Isolation and characterization of porcine circovirus type-2 from sera of stillborn fetuses[J]. The Canadian Journal of Veterinary Research,2003,67:108-113.

