鹅细小病毒YBLJ株VP3基因的真核表达
张 颖,鲁 承,赵文婧,陈海迪,高 旭
(延边大学农学院动物医学系,吉林延吉133000)
鹅细小病毒病是由鹅细小病毒(Goose parvovirus,GPV)引起的主要侵害4日龄~20日龄雏鹅的一种病毒性传染病,该病病程短,传染性强,病死率高,给养鹅业造成了严重的危害[1-3]。该病毒由我国学者方定一于1956年在江苏扬州首次发现。研究发现VP3基因是GPV核衣壳的主要成分,约占总蛋白含量的80%,具有较高的保守性,能够诱导机体产生中和抗体,是GPV的主要保护性抗原[4-5]。本研究拟以本课题组前期分离的延边株(YBLJ)鹅细小病毒为毒株,克隆VP3基因和构建真核表达载体,并研究GPV的VP3基因在Vero细胞中表达情况,为进一步研制GPV的VP3基因核酸疫苗奠定基础。
1 材料与方法
1.1 材料
1.1.1 病毒、菌种 GPV(YBLJ株)为本实验室从延边某养鹅场发生鹅细小病毒病的病死鹅脾脏中分离得到。大肠埃希菌JM109、pcDNA3.1(+)菌株由本实验室保存。
1.1.2 主要试剂 LipofectamineTM 2000转染试剂盒为Invitrogen公司产品;限制性内切酶HindⅢ和XhoⅠ,以及ExTaq酶、DNA提取试剂盒、DNA凝胶回收试剂盒和反转录试剂盒均为宝生物工程(大连)有限公司产品;小鼠抗GPV VP3蛋白单抗为本试验室制备;FITC标记的兔抗小鼠IgG二抗为Abcam公司产品。
1.2 方法
1.2.1 引物的设计与合成 根据已克隆的鹅细小病毒 YBLJ株 VP3基因序列 (GenBank:JN836326)[6],利用Loligo 6.0软件设计合成了一对引物,由上海英骏生物技术有限公司合成,扩增片段长度为1 605bp。序列如下:上游5′-ATAAGCTTGCCACCATGGCAGAGGGAGGAG-3′(HindⅢ);下 游5′-CGGGCTCGAGTTACAGATTTTGAGTT-3′(XhoⅠ)。
1.2.2 PCR扩增及克隆 以提取的GPV基因组DNA为模板进行PCR扩增,反应程序为:95℃5min;94℃40s,58℃45s,72℃1min 40s,进行30个循环;72℃10min。纯化回收VP3基因片段,与克隆载体pMD-18T连接,转化至JM109感受态细胞。将PCR及酶切鉴定正确的重组质粒送往上海英骏生物技术有限公司进行序列测定。
1.2.3 重组表达质粒的pcDNA-VP3的构建及鉴定 将鉴定正确的克隆质粒pMD-VP3和pcDNA质粒经HindⅢ和XhoⅠ双酶切后,回收VP3片段和pcDNA载体进行连接,构建重组表达质粒pcDNA-VP3。经PCR和双酶切鉴定为阳性的重组质粒送往上海英骏生物技术有限公司进行鉴定。
1.2.4 重组质粒的转染 用双无培养液对重组质粒pcDNA-VP3和LipofectamineTM 2000进行稀释后,通过脂质体介导法转染Vero细胞,具体方法参照说明书进行操作。
1.2.5 RT-PCR检测 采用Trizol法提取细胞总RNA[7-8],按照宝生物工程(大连)有限公司反转录试剂盒说明书将其反转录成cDNA,并进行PCR扩增。
1.2.6 间接免疫荧光试验(IFA)检测 收集转染的Vero细胞,在载玻片上包被后进行冷丙酮固定,以小鼠抗GPV的VP3蛋白单抗为一抗,荧光素标记的兔抗小鼠IgG为二抗,进行IFA检测,在荧光显微镜下观察。
2 结果
2.1 VP3基因的克隆及真核表达载体的构建
以提取的GPV基因组DNA作为模板进行PCR扩增,在约1 605bp处出现了与预期片段大小相符的特异性目的条带(图1)。对PCR鉴定为阳性的真核质粒pcDNA-VP3进行酶切鉴定得到约5 428bp和1 605bp的2个片段(图2),表明重组质粒构建正确。同时测序结果也验证了真核表达载体已成功构建。

图1 VP3基因PCR扩增结果Fig.1 PCR amplification of VP3gene
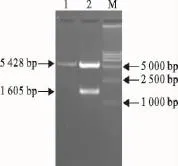
图2 重组质粒酶切鉴定结果Fig.2 Identification of recombinant plasmids by enzyme digestion
2.2 RT-PCR检测
提取转染重组质粒的Vero细胞培养物总RNA,进行RT-PCR扩增,在约1 605bp处有一个明显的目的条带(图3)。
2.3 IFA检测结果
在荧光显微镜下观察到转染重组质粒的Vero细胞中出现绿色荧光,未转染质粒的Vero细胞未出现绿色荧光(图4),表明VP3基因在Vero细胞中获得表达。
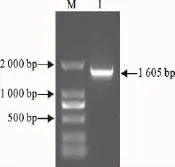
图3 RT-PCR检测结果Fig.3 Result of RT-PCR amplification

图4 表达产物的IFA检测结果 (200×)Fig.4 IFA detection result of gene expression in Vero cells(200×)
3 讨论
细小病毒(Parvovirus)分为自主复制型细小病毒和依赖型细小病毒,鹅细小病毒(GPV)属于自主复制型细小病毒,复制过程不需要辅助性病毒存在,病毒为无囊膜单链DNA病毒。GPV主要侵害4日龄~20日龄雏鹅,病毒可垂直传播,种鹅是主要的传染源,通过种蛋使雏鹅感染,由于雏鹅免疫系统不健全,导致感染雏鹅大批死亡,有的死亡率高达100%,因此鹅细小病毒病又名小鹅瘟,严重危害养鹅业的健康发展[9-11]。目前,国内外GPV疫苗以传统疫苗为主,但其存在着灭活不彻底、毒力返强和散毒等缺点,致使GPV在鹅群中长期存在,无法净化,而核酸疫苗避免了以上诸多缺点。因此,研制GPV核酸疫苗仍是当务之急。
在GPV的3种结构蛋白(VP1、VP2和VP3)中,衣壳蛋白VP3是病毒的主要结构蛋白和病毒核衣壳的主要成分,暴露于病毒粒子表面,是病毒刺激机体产生保护性中和抗体的重要抗原蛋白,所以VP3基因是研制 GPV 核 酸疫苗的首选基 因[1,5,12]。目前常用的真核表达载体有pVAX1、pcDNA3.1和pJW4304等,均含有CMV启动子,能够高水平的表达外源基因,其中pcDNA3.1质粒较小,易被细胞摄取,有助于维持mRNA的稳定性,利于在哺乳动物细胞中高水平表达重组蛋白。张建远等[13]应用pcDNA载体构建的SARS冠状病毒核酸疫苗和猪圆环病毒核酸疫苗免疫动物后,结果显示所构建的核酸疫苗能诱导机体产生较好的免疫反应。因此,本试验采用pcDNA作为真核表达载体,构建了pcDNA-VP3真核表达载体。在转染方面采用操作简单易行、可靠的脂质体介导法进行真核细胞转染,通过LipofectamineTM 2000将真核表达质粒pcDNA-VP3转染至Vero细胞中,结果表明在外源启动子的起始下,重组质粒能够在Vero细胞中稳定表达VP3基因,经IFA检测证明表达的VP3蛋白具有反应活性,提示已成功构建了GPV VP3基因的真核表达载体。本试验的研究结果为进一步研究GPV VP3基因在雏鹅体内的表达情况提供了理论依据,为研制GPV核酸疫苗奠定了基础。
[1] Yu T F,Ma B,Gao M C,et al.Localization of linear B-cell epitopes on goose parvovirus structural protein[J].Vet Immunol Immunopathol,2012,145(1-2):522-526.
[2] Ju H,Wei N,Wang Q,et al.Goose parvovirus structural proteins expressed by recombinant baculoviruses self-assemble into virus-like particles with strong immunogenicity in goose[J].Biochem Biophys Res Commun,2011,409(1):131-136.
[3] Yang J,Yang R,Cheng A,et al.A simple and rapid method for detection of goose parvovirus in the field by loop-mediated isothermal amplification[J].Virol J,2010,21(7):14.
[4] Shien J H,Wang Y S,Chen C H,et al.Identification of sequence changes in live attenuated goose parvovirus vaccine strains developed in Asia and Europe[J].Avian Pathol,2008,37(5):499-505.
[5] Zhang Y,Li Y,Liu M,et al.Development and evaluation of a VP3-ELISA for the detection of goose and Muscovy duck parvovirus antibodies[J].J Virol Meth,2010,163(2):405-409.
[6] 高 旭,张 颖,鲁 承.鹅细小病毒强毒YBLJ分离株的分离鉴定与vp3基因的进化分析[J].中国预防兽医学报,2011(12):121-124.
[7] Ji J,Xie Q M,Chen C Y,et al.Molecular detection of Muscovy duck parvovirus by loop-mediated isothermal amplification assay[J].Poult Sci,2010,89(3):477-483.
[8] 萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].北京:科学出版社,2002.
[9] Zhu L Q,Ding X Y,Tao J,et al.Identification of target cells for Goose parvovirus infection in the immune system organs[J].Acta Virol,2010,54(3):211-215.
[10] Lee J W,Lin Y M,Yen T Y,et al.CpG oligodeoxynucleotides containing GACGTT motifs enhance the immune responses elicited by agoose parvovirus vaccine in ducks[J].Vaccine,2010,28(50):7956-7962.
[11] Qiu Z,Tian W,Yu T,et al.Monoclonal antibodies against NS1protein of goose parvovirus[J].Hybridoma,2012,31(2):125-130.
[12] Palya V,Zolnai A,Benyeda Z,et al.Short beak and dwarfism syndrome of mule duck is caused by a distinct lineage of goose parvovirus[J].Avian Pathol,2009,38(2):175-180.
[13] 张建远,王红宁,陈锦锐.猪圆环病毒核酸疫苗pcDNAPCV-ORF2-ISS的构建及分子佐剂联合免疫研[J].2009(12):1511-1515.

