番茄同源四倍体离体诱导及生理特性分析
吴志刚 刘丹赤 宋 明 丁立孝
(1日照职业技术学院,山东日照 276826;2西南大学园艺园林学院,重庆 400715)
人工诱导多倍体是番茄(Lycopersicon esculentumMill.)育种的重要手段之一。传统诱导番茄多倍体的方法主要有愈伤组织法、秋水仙素处理种子或幼苗生长点等方法,而利用组织培养技术进行番茄四倍体的离体诱导鲜有报道。利用组织培养技术与秋水仙素相结合的方法培育植物多倍体,具有嵌合体少、试验条件易控制、重复性好、诱导效率高等诸多优点,并在荷花(Yamamoto & Matsumoto,1990)、黄瓜(张承妹和陆家安,1995)等多种植物上都取得了成功。本试验对番茄同源四倍体的离体诱导技术进行了系统研究,为番茄品种改良和种质资源的丰富与创新提供了一条新的途径。同时对番茄四倍体与二倍体植株的形态指标、生理指标进行比较分析,从而为番茄四倍体植株的鉴定、优良四倍体株系的筛选提供理论依据。
1 材料与方法
1.1 试验材料
本试验于2007年在西南大学重庆市蔬菜学重点实验室进行。供试番茄品种为渝粉109。
1.2 试验方法
1.2.1 番茄四倍体的离体诱导 将番茄种子灭菌后,接种到1/2MS固体培养基上,置于28 ℃的恒温箱中进行培养(吴志刚 等,2006)。待子叶平展后,切取健壮无菌苗的子叶进行分化培养。分化培养基为 MS+30 g·L-1蔗糖+7.5 g·L-1卡拉胶+1 mg·L-16-BA+0.2 mg·L-1IAA,pH 5.8~6.0。
愈伤组织分化形成绿芽生长点后,选择芽点较多、生长正常的愈伤组织为材料,分别在含秋水仙素的固体培养基和液体培养基中进行诱导。固体培养:秋水仙素浓度分别为 0.05%、0.10%、0.20%、0.40%,处理24~96 h;液体培养:秋水仙素浓度分别为0.05%、0.10%、0.20%,处理12~72 h。对照接入到不含秋水仙素的培养基上。每处理30个愈伤组织,处理后转移到继代培养基中进行培养。继代培养20 d后,观察并统计分化情况和外植体死亡率。培养得到完整植株后,用根尖进行植株倍性鉴定,统计诱导率。
倍性鉴定采用陈学森(2004)和王志敏等(2010)的方法进行直接鉴定。当试管苗不定根长至2~3 cm时,切取根尖1 cm左右,用饱和对二氯苯溶液预处理55 min;然后将处理好的根尖放入60 ℃ 1 mol·L-1的HCl溶液中处理8 min,清水冲洗彻底后进行染色体压片。对于染色体记数清晰、形态完整的压片制作成永久封片。
1.2.2 四倍体与二倍体植株特性的比较分析 ① 形态学比较:在相同生长阶段和生长条件下,选择移栽40 d后的二倍体与四倍体番茄各4株进行形态指标的比较。分别测量株高、成熟叶片长度及宽度、基部茎粗和第 1~3节间长度,取平均值。② 生理指标比较:叶绿素含量测定参照李合生(2001)的 95%乙醇浸提法,选择生长阶段和生长条件相同的二倍体与四倍体番茄各3株,摘取新鲜的成熟叶片,分别测定并计算叶绿素a、叶绿素b、类胡萝卜素含量及叶绿素总含量;过氧化物酶(POD)活性测定采用愈创木酚法,以每分钟内A470变化0.01为1个酶活性单位;可溶性蛋白含量测定采用考马斯亮蓝 G-250染色法;超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)法;丙二醛(MDA)含量测定采用硫代巴比妥酸(TBA)法(李合生,2001)。
2 结果与分析
2.1 番茄四倍体的离体诱导
2.1.1 固体培养法诱导效果 愈伤组织分化形成绿芽生长点后,将愈伤组织接入到含不同浓度秋水仙素的固体培养基中进行离体诱导。此时不定芽生长点正处于细胞分裂的活跃时期,容易被秋水仙素诱导而加倍,从而使部分不定芽最终发展成为四倍体植株。诱导结果见表 1,采用固体培养法进行离体诱导,共获得9株四倍体植株,取得了较好的诱导效果。
四倍体诱导的关键就是既要获得较高的加倍频率,又要保证外植体的成活率及再生植株的数量,因此诱导时间和药剂浓度相适应,才能达到理想的诱导效果。表 1表明:在秋水仙素浓度为0.20%、处理时间为48 h时,6株再生植株中获得3株变异植株,诱导效果最佳。
2.1.2 液体培养法诱导效果 番茄外植体对秋水仙素较为敏感,由于液体培养比固体培养作用更为直接,所以对外植体的伤害程度也较大。外植体经秋水仙素溶液浸泡后,多数不定芽停止生长,死亡率较固体培养大幅增加,处理后获得再生植株数较少,仅有 2株变异植株(表 2)。
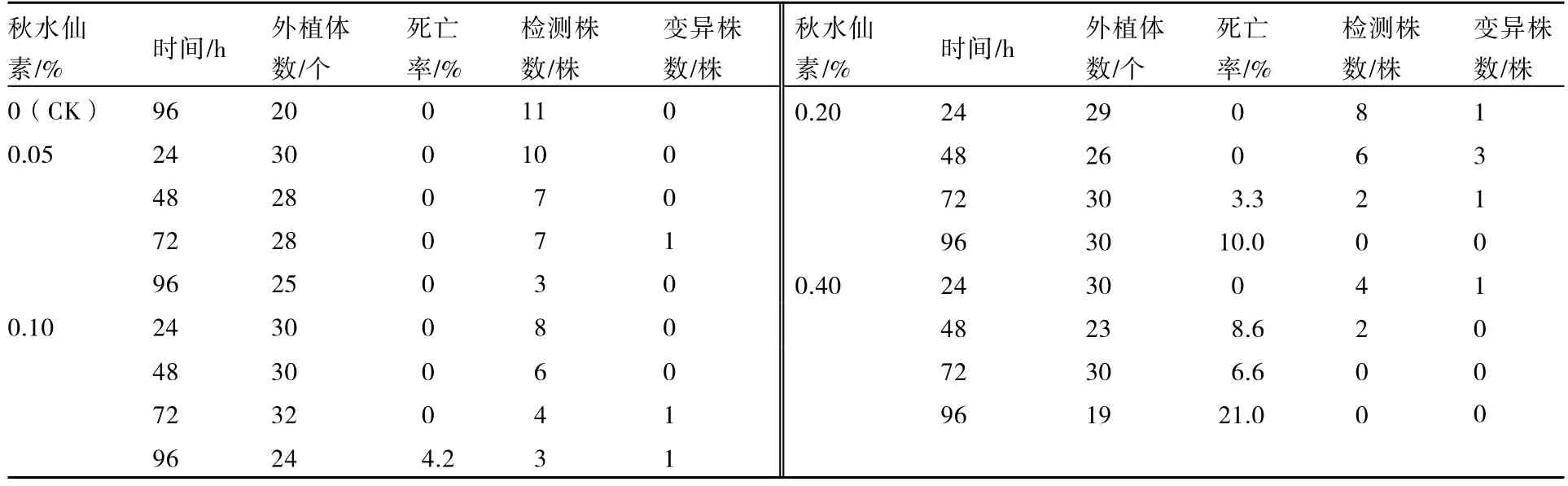
表1 固体培养法对带绿芽生长点愈伤组织的诱导效果
2.2 倍性鉴定
利用根尖压片检测染色体数目,未经秋水仙素处理的试管苗,其体细胞染色体数目为2n=2x=24(图 1-a)。经秋水仙素诱导后的再生植株中,存在一定比例的嵌合体;其中变异植株经连续多代继代培养,获得了部分纯合四倍体植株,其体细胞染色体数目为 2n=4x=48(图1-b)。检测中也发现了含八倍体细胞的嵌合体类型,染色体数目为2n=8x=96(图1-c),这可能是由于处理时间过长,诱导产生的四倍体细胞在秋水仙素作用下再次加倍所致。
2.3 番茄四倍体与二倍体的比较分析
2.3.1 四倍体与二倍体植株形态比较 试管苗培养阶段,四倍体与二倍体相比,植株相对粗壮,节间短,叶色深,根数较多,但植株形态差异并不十分明显(图2)。

表2 液体培养法对带绿芽生长点愈伤组织的诱导效果
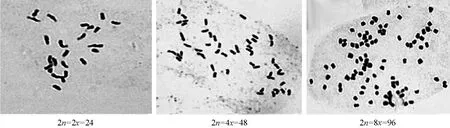
图1 不同倍性番茄体细胞染色体数目
移栽40 d后的番茄四倍体植株高大,茎秆粗壮,节间长,叶片宽大,叶色深绿,与二倍体植株差别明显(图3,表3)。
2.3.2 生理指标比较 四倍体植株叶绿素总量为2.42 mg·g-1,明显高于二倍体(1.77 mg·g-1),而且叶绿素a含量和叶绿素b含量均明显高于二倍体,但叶绿素a/b值差别不大;四倍体植株类胡萝卜素含量也高于二倍体,为二倍体的133%(表4)。
通过对POD和SOD活性的测定发现(表5),四倍体番茄植株酶活性加强,生活力提高。四倍体植株POD活性为9 U·g-1,二倍体为4 U·g-1;四倍体植株SOD活性为201.7 U·g-1,而二倍体仅为140.2 U·g-1。

图2 四倍体与二倍体组培苗形态比较

图3 四倍体与二倍体植株同位裂片大小比较
丙二醛(MDA)是膜脂过氧化的产物,反映细胞膜脂过氧化程度和植物对逆境条件的反应强度。四倍体植株MDA含量为7.1×10-3μmol·g-1,二倍体为 8.9×10-3μmol·g-1(表5),在一定程度上反映了二倍体植株较四倍体更易受外界环境的影响。四倍体植株可溶性蛋白含量与二倍体之间差异明显,分别为 34.4 mg·g-1和 24.1 mg·g-1(表 5)。
上述生理指标的分析表明,在相同的栽培环境下,四倍体植株的生理状态优于二倍体,这为四倍体植株抗逆性奠定了良好的基础。而四倍体植株抗逆性的具体表现还有待进一步研究。
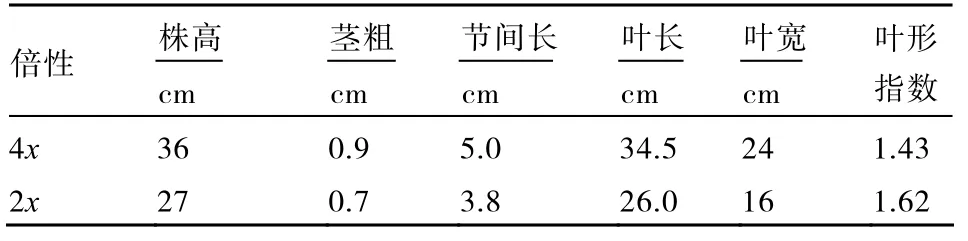
表3 四倍体与二倍体植株形态比较

表4 四倍体与二倍体植株叶片光合色素含量比较
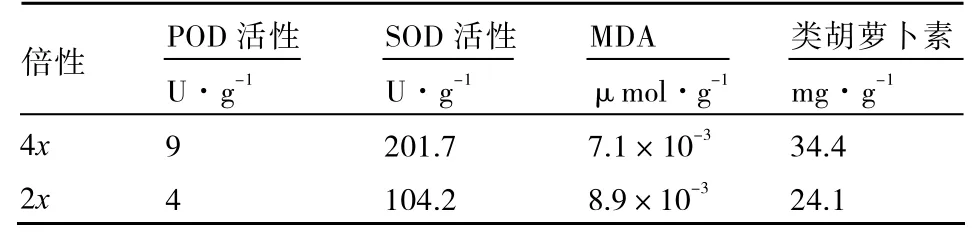
表5 四倍体与二倍体植株生理指标比较
3 讨论
番茄多倍体育种研究已经很多年,其诱导方法以秋水仙素处理番茄幼苗茎尖(刘艳俊 等,1991;饶升土 等,1996)和种子为主(乔永刚,2003),而利用组织培养技术与秋水仙素相结合进行离体诱导的方法鲜有报道。本试验找到了一条通过离体诱导番茄同源四倍体的有效途径,且研究结果为:多倍体植物叶片在形态上会表现出巨大性、叶绿素含量随倍性的增加而增加等内容与许多研究者的结论一致(刘惠吉 等,1990;刘文革 等,2003a,2003b;王镇 等,2010)。为进一步提高诱导率,可以尝试变温诱导、添加二甲基亚砜(DMSO)、选择其他化学诱变剂等方法开展诱导工作。同时应适时移栽进行田间试验,观测番茄四倍体植株生长状态,掌握多倍体材料的生育期、育性以及果实性状、结实率等特征,并检测后代倍性及表现型的稳定性,为优良株系的选育奠定基础。
目前番茄多倍体育种中真正有价值的多倍体材料很少。如其他植物一样,染色体加倍后会引起一系列生理生化变化和不良放应,如孕性降低、结实率差、群体中非整倍体比例增高等。只有在良好培育条件下,生理状态得以调整和恢复,并辅以严格的人工选择,发掘其优良性状,与其他的育种手段相结合,同源四倍体才可能在生产上利用。
陈学森.2004.植物育种学实验.北京:高等教育出版社:139.
李合生.2001.植物生理生化实验原理和技术.北京:高等教育出版社:134-135,164-165.
刘惠吉,曹寿椿,王华.1990.南农矮脚黄四倍体不结球白菜新品种的选育.南京农业大学学报,13(2):33-40.
刘文革,王鸣,阎志红.2003a.蔬菜作物多倍体育种研究进展.长江蔬菜,(1):29-30.
刘文革,阎志红,王鸣.2003b.不同染色体倍性西瓜植株光合色素的研究.中国西瓜甜瓜,(1):1-3.
刘艳俊,田丽霞,赵述定.1991.诱导番茄同源四倍体的研究.山西农业大学学报,11(2):118-120.
乔永刚.2003.近无籽实心多倍体番茄新品系的选育〔硕士论文〕.太谷:山西农业大学.
饶升土,徐根娣,周建华.1996.秋水仙素处理番茄幼苗染色体加倍的研究.浙江师范大学学报:自然科学版,19(1):62-64.
王镇,党选民,詹园凤.2010.不同倍性小型西瓜主要农艺性状的比较分析.中国蔬菜,(2):51-55.
王志敏,牛义,宋明,汤青林.2010.姜四倍体离体诱导及其形态学分析.中国蔬菜,(4):41-46.
吴志刚,宋明,王志敏,牛义.2006.番茄组织培养中无菌苗培养条件的优化.中国农学通报,22(4):335-337.
张承妹,陆家安.1995.黄瓜组织培养与诱导四倍体植株的研究.上海农业学报,11(3):31-36.
Yamamoto Y,Matsumoto O.1990.In vitroinduction of tetraploid plants in lotus(Nelumbo nuciferaGaertn)and their characteristics.Bulletin of the Yamaguchi Agricultural Experiment Station,42:7-12.

