不同化感效应的小麦根系分泌物对黄瓜幼苗生长及根系生理生化特性的影响
杨 平 吴凤芝
(东北农业大学园艺学院,黑龙江哈尔滨 150030)
近年来,我国设施园艺发展迅速,截至2010年底设施园艺面积约达到466.7万hm2(喻景权,2011)。设施黄瓜(Cucumis sativusL.)作为主要栽培种类之一,由于多年连作造成连作障碍严重。小麦(TriticuMaestivuML.)是典型的化感型作物,主要通过根系分泌及残体分解等方式影响自身或邻近植物的生长发育。有研究表明,小麦与黄瓜轮作可以显著提高土壤微生物多样性指数、丰富度指数和均匀度指数,使土壤容重显著降低,土壤总孔隙度显著提高,显著降低土壤盐分积累及土壤EC值,明显改善土壤微生物的区系组成及土壤微生态环境,提高黄瓜产量(吴凤芝和王学征,2007;吴凤芝 等,2008;王玉彦 等,2009)。目前关于小麦化感作用的研究主要集中在土壤微生态环境(柴强,2004;王德胜,2008)、化感作用强弱的测定(沈慧敏等,2005;李逢雨 等,2008)以及化感物质组分分析(赵媛,2005;于翠平,2009)三个方面,而关于小麦化感作用对受体植株生理生化方面影响的研究较少。
本试验通过不同化感效应的小麦根系分泌物处理黄瓜幼苗根系,研究小麦根系分泌物对黄瓜幼苗生长及根系生理生化特性的影响,为揭示小麦与黄瓜轮作提高产量的生理生化机制、缓解设施黄瓜连作障碍、建立合理的栽培制度提供理论依据。
1 材料与方法
1.1 试验材料
供试黄瓜品种为津优1号,购于哈尔滨华威种业有限公司;化感促进作用小麦品种04-0348(A)及化感抑制作用小麦品种龙辐17(B)(马亚飞 等,2011)购于黑龙江省农业科学院。供试土壤取自东北农业大学园艺试验中心,土壤基本肥力:有机质含量82.57 g·kg-1,碱解氮234.70 mg·kg-1,速效磷346.75 mg·kg-1,速效钾305.64 mg·kg-1,电导率0.33 mS·cm-1,pH值7.22(鲍士旦,2000)。
1.2 试验方法
1.2.1 小麦根系分泌物的收集 2010年6月12日,小麦播种于东北农业大学园艺试验站,待长至15~20 cm时将小麦幼苗完整取出,用自来水将小麦根系冲洗干净后,将整株小麦放入定量的蒸馏水中(根据收集的不同化感效应小麦的具体数量,水量以刚没过所有小麦根系为宜),培养24 h,收集根系分泌物,定容使其浓度为1 ML·株-1(1 ML蒸馏水中含有1株小麦根系分泌物),先用3层滤纸过滤,再过0.45 μm微膜灭菌,4 ℃保存备用(吴凤芝 等,2002)。
1.2.2 小麦根系分泌物对黄瓜幼苗的处理 黄瓜种子于2010年6月19日浸种、催芽,播于8 cm×8 cm营养钵内,常规管理,待幼苗一叶一心时分别浇灌20 ML浓度为1 mL·株-1的不同小麦根系分泌物A或B,以蒸馏水作为对照,每处理3次重复,每重复25株,小区间设有保护行,随机排列,常规管理。分别在处理后6、12 d和18 d随机取样,测定黄瓜幼苗生长、光合特性及根系生理生化指标。每次取样后,分别向剩余的幼苗补加20 ML小麦根系分泌物。
1.3 测定项目
1.3.1 生长指标及光合特性指标测定 黄瓜幼苗经不同化感效应的小麦根系分泌物处理后6、12 d和18 d,分别取样测定黄瓜植株的株高(子叶节到生长点的距离,米尺)、茎粗(子叶下1 cm处,游标卡尺)、叶面积(打孔称重法,电子天平)、全株干质量(电子天平)。每处理测3株,3次重复;光合特性指标采用美国Li-COR公司的LI-6400便携式光合测定仪进行测定。
1.3.2 生理生化指标测定 超氧化物歧化酶(SOD)活性测定采用氮蓝四唑光还原法;过氧化物酶(POD)活性测定采用愈创木酚法;过氧化氢酶(CAT)活性测定采用高锰酸钾滴定法;可溶性蛋白含量测定采用考马斯亮蓝G-250染色法;可溶性糖含量测定采用苯酚法;游离脯氨酸含量测定采用茚三酮法;丙二醛(MDA)含量测定采用硫代巴比妥酸比色法(郝再彬 等,2004)。
试验数据采用Microsoft Excel 2003软件进行处理,采用SAS 9.0软件进行差异显著性分析。
2 结果与分析
2.1 不同化感效应的小麦根系分泌物对黄瓜幼苗生长的影响
从表1可以看出,经不同化感效应的小麦根系分泌物处理后6 d,A处理的株高显著高于对照,全株干质量显著低于对照,B处理的茎粗、全株干质量均显著低于对照;处理后 12 d,A处理的茎粗、叶面积均显著高于对照,B处理叶面积显著低于对照;处理后18 d,A处理的株高显著高于对照,B处理株高显著低于对照。
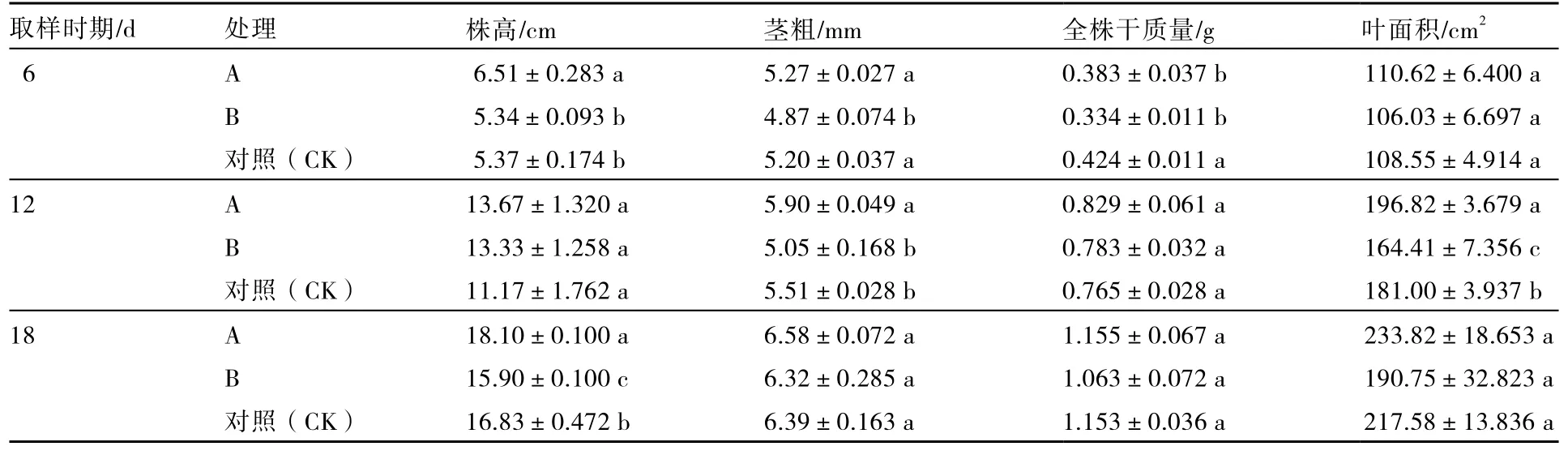
表1 不同化感效应的小麦根系分泌物对黄瓜幼苗生长的影响
2.2 不同化感效应的小麦根系分泌物对黄瓜幼苗光合特性的影响
从表2可以看出,经不同化感效应的小麦根系分泌物处理后6 d,A、B处理的光合速率、气孔导度、胞间CO2浓度及蒸腾速率均显著高于对照;处理后12 d,A处理的光合速率、气孔导度、胞间 CO2浓度均显著高于对照,蒸腾速率却显著低于对照,B处理的气孔导度、蒸腾速率均显著低于对照;处理后18 d,A处理的蒸腾速率显著高于对照,气孔导度显著低于对照,B处理的光合速率、气孔导度及蒸腾速率均显著低于对照。
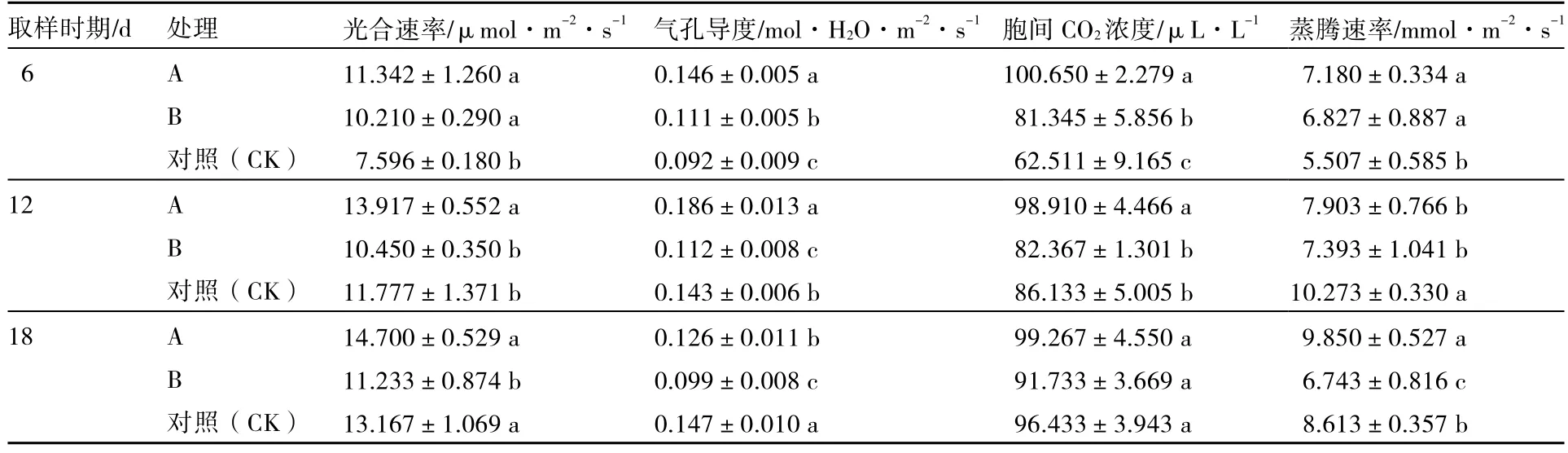
表2 不同化感效应的小麦根系分泌物对黄瓜幼苗光合特性的影响
2.3 不同化感效应的小麦根系分泌物对黄瓜幼苗根系生理生化指标的影响
2.3.1 对黄瓜幼苗根系SOD活性的影响 由图1可见,经不同化感效应的小麦根系分泌物处理后6 d,A处理SOD活性显著高于对照,B处理与对照差异不显著;处理后12 d,A、B处理SOD活性均显著低于对照;处理后18 d,A处理SOD活性显著高于对照,B处理与对照差异不显著。
2.3.2 对黄瓜幼苗根系CAT活性的影响 由图2可见,经不同化感效应的小麦根系分泌物处理后6 d,A、B处理CAT活性与对照差异均不显著;处理后12 d,A、B处理CAT活性均显著高于对照;处理后18 d,A处理CAT活性显著对照,B处理显著低于对照。
2.3.3 对黄瓜幼苗根系POD活性的影响 由图3可见,经不同化感效应的小麦根系分泌物处理后6 d,A、B处理POD活性均显著高于对照;处理后12 d,A处理POD活性显著高于对照,B处理显著低于对照;处理后18 d,A、B处理POD活性均显著低于对照。
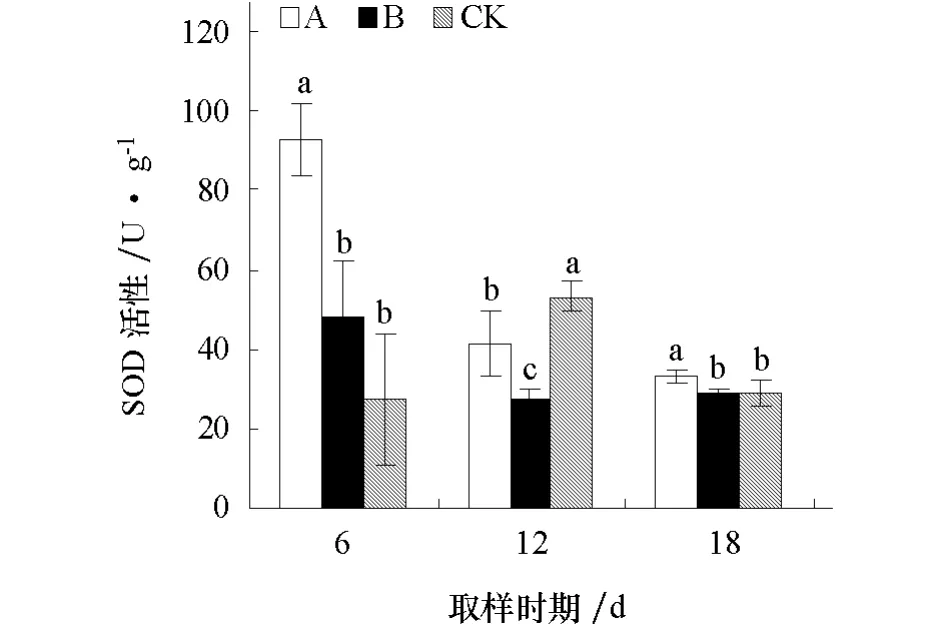
图1 不同化感效应的小麦根系分泌物对黄瓜幼苗根系SOD活性的影响

图2 不同化感效应的小麦根系分泌物对黄瓜幼苗根系CAT活性的影响
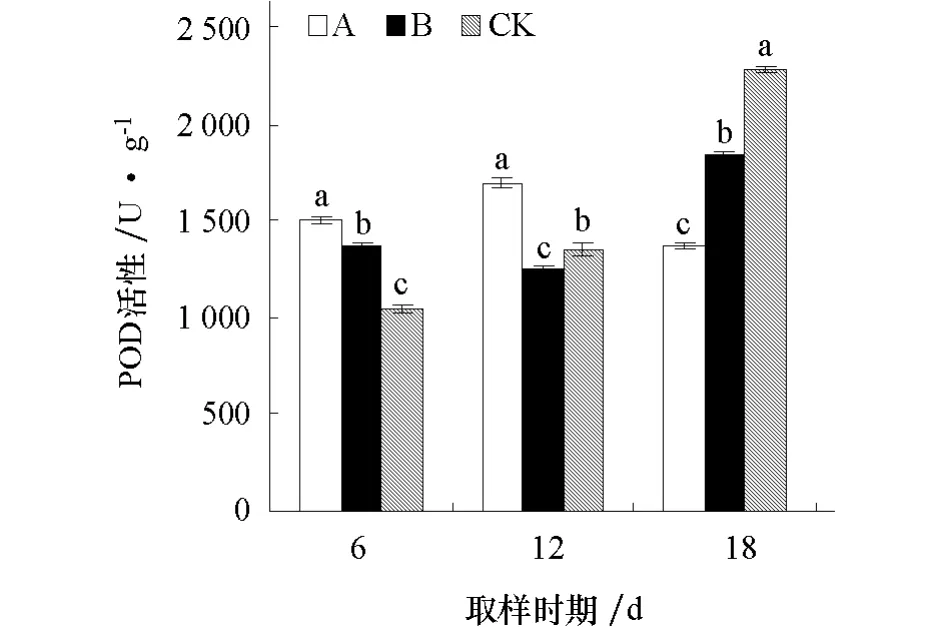
图3 不同化感效应的小麦根系分泌物对黄瓜幼苗根系POD活性的影响
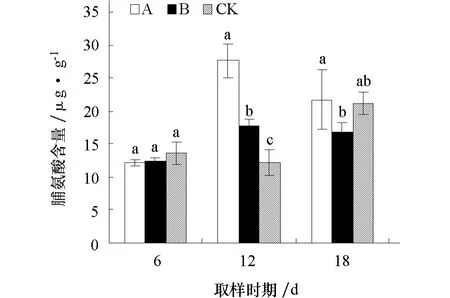
图4 不同化感效应的小麦根系分泌物对黄瓜幼苗根系游离脯氨酸含量的影响
2.3.4 对黄瓜幼苗根系游离脯氨酸含量的影响 由图 4可见,经不同化感效应的小麦根系分泌物处理后6、18 d,A、B处理游离脯氨酸含量与对照差异均不显著;处理后12 d,A、B处理游离脯氨酸含量均显著高于对照。
2.3.5 对黄瓜幼苗根系可溶性蛋白含量的影响 由图5可见,经不同化感效应的小麦根系分泌物处理后6 d,A处理可溶性蛋白含量显著高于对照,B处理显著低于对照;处理后12 d,A处理可溶性蛋白含量显著高于对照,B处理与对照差异不显著;处理后18 d,A处理可溶性蛋白含量显著低于对照,B处理与对照差异不显著。
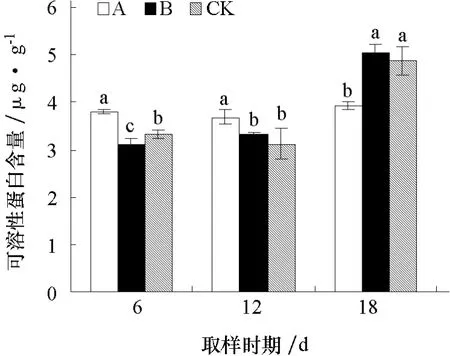
图5 不同化感效应的小麦根系分泌物对黄瓜幼苗根系可溶性蛋白含量的影响
2.3.6 对黄瓜幼苗根系可溶性糖含量的影响 由图6可见,经不同化感效应的小麦根系分泌物处理后6 d,A、B处理可溶性糖含量与对照差异均不显著;处理后12、18 d,A处理可溶性糖含量显著高于对照,B处理显著低于对照。
2.3.7 对黄瓜幼苗根系MDA含量的影响 由图7可见,经不同化感效应的小麦根系分泌物处理后6 d,A、B处理MDA含量与对照差异均不显著;处理后12 d,A处理MDA含量显著低于对照,B处理显著高于对照;处理后18 d,A处理MDA含量与对照差异不显著,B处理显著高于对照。
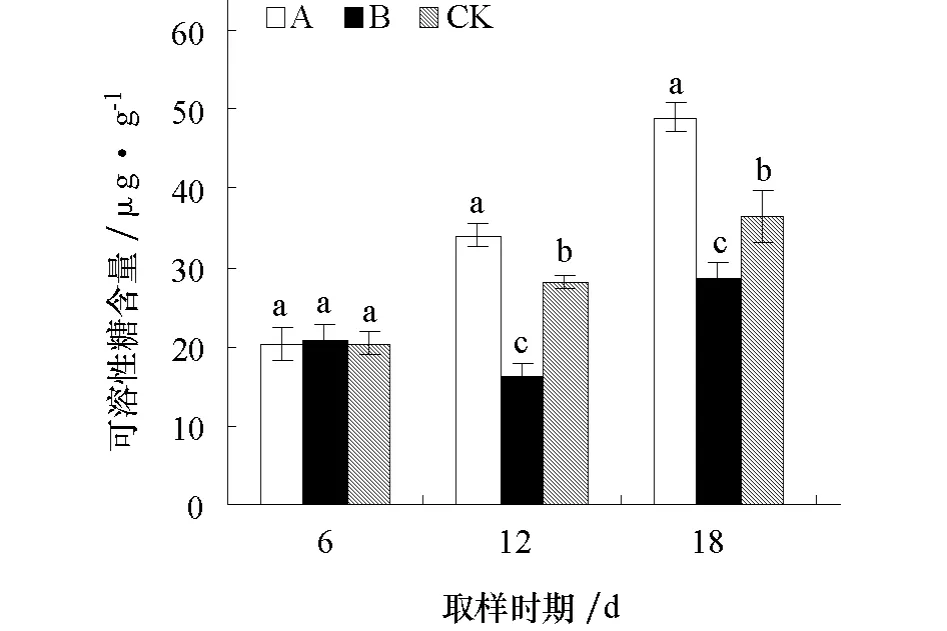
图6 不同化感效应的小麦根系分泌物对黄瓜幼苗根系可溶性糖含量的影响

图7 不同化感效应的小麦根系分泌物对黄瓜幼苗根系丙二醛含量的影响
3 结论与讨论
一般认为自毒作用是导致设施黄瓜连作障碍严重的重要原因之一,由于连续种植,根系分泌物释放的自毒物质积累到一定浓度,就会抑制下茬黄瓜的生长(喻景权和杜尧舜,2000)。黄瓜根系分泌物、根系提取液和自毒物质对水培黄瓜保护酶活性和光合作用具有显著的影响,增加了膜质过氧化(Wu et al.,2002;Yu et al.,2003;吴凤芝 等,2005)。化感物质可以对受体植物的细胞分裂、膜功能、光合作用和生物合成等生理生化反应产生影响(赵福锁 等,2004)。本试验通过测定不同化感效应的小麦根系分泌物对受体黄瓜幼苗生长指标(株高、茎粗、全株干质量、叶面积)、光合特性、保护酶活性(SOD、POD、CAT)、渗透调节物质含量(可溶性糖、可溶性蛋白、游离脯氨酸)及脂膜过氧化(MDA)的变化,间接反映了不同化感效应的小麦根系分泌物中化感物质对黄瓜幼苗化感作用的生理生化机制。
本试验结果表明,不同化感效应的小麦根系分泌物对黄瓜幼苗的生长状况、光合作用、保护酶活性、渗透调节物质含量及膜脂过氧化程度的影响不同。经具有化感促进效应的小麦根系分泌物处理后,黄瓜幼苗株高,茎粗,叶面积,光合速率,气孔导度,胞间 CO2浓度,蒸腾速率,根系 SOD、CAT、POD活性,可溶性蛋白、可溶性糖、脯氨酸含量在不同时期分别显著提高,脂膜过氧化作用显著降低,总体表现为促进黄瓜幼苗生长;经具有化感抑制效应的小麦根系分泌物处理后,黄瓜幼苗的生长指标、光合作用、保护酶活性、渗透调节物质含量显著降低,脂膜过氧化作用显著提高,总体表现为抑制黄瓜幼苗生长。因此,小麦对黄瓜幼苗的化感作用生理生化机制可能是通过改变黄瓜幼苗体内保护酶活性、渗透调节物质含量及脂膜过氧化来表现的。
在本试验结果中,不同化感效应的小麦根系分泌物对黄瓜幼苗根系中保护酶活性、渗透调节物质含量、脂膜过氧化作用及黄瓜幼苗生长的影响不同,这一结果与Wu等(2000)关于不同品种小麦对黑麦草的化感作用结果相似。Putnam和Duke(1974)认为不同品种间的化感作用差异可能是从其野生祖先遗传而来的。因此,造成不同品种小麦化感差异的原因可能是因为其遗传背景不同。
具有化感促进效应的小麦根系分泌物对黄瓜幼苗根系各项生理生化指标及幼苗生长状况总体表现为促进作用。这一结果与亓延凤(2006)关于玉米和小麦的秸秆均可以显著提高黄瓜植株的株高、茎粗、最大叶面积及产量的研究结果一致。具有化感抑制效应的小麦根系分泌物对黄瓜幼苗根系各项生理生化指标及幼苗生长总体表现为抑制作用。造成这一结果的原因可能是由于不同化感效应的小麦根系分泌物中所含的化感物质不同,或者是小麦根系分泌物处理后经过土壤微生物的分解产生有利或有害的物质,影响黄瓜幼苗生长,其具体原因有待进一步研究。
化感作用具有浓度效应(孔垂华 等,1998;韩丽梅 等,2002),侯维(2008)研究百里香化感作用结果表明,萝卜幼苗株高在水浸液最高和最低浓度受促进,中间浓度受抑制。董沁方(2006)研究表明百合水浸液对受体植物表现为低浓度促进,高浓度抑制的双重效应。本试验中,同一测定指标在经同一小麦根系分泌物处理后的不同时期,有时表现不同甚至是相反的规律,造成这一现象的原因可能是化感物质的浓度和时间效应,也可能是土壤养分及土壤微生物分解等,其具体原因有待进一步研究。
鲍士旦.2000.土壤农化分析.3版.北京:中国农业出版社:34-35,56-58,81-82,109-110.
柴强.2004.化感作用对复合群体根区土壤微生物及酶的影响研究〔博士论文〕.兰州:甘肃农业大学.
董沁方.2006.百合(Lilium)植物水浸液及根系分泌物的化感作用研究〔硕士论文〕.杨凌:西北农林科技大学.
韩丽梅,沈其荣,鞠会艳,阎石,阎飞.2002.大豆地上部水浸液的化感作用及化感物质的鉴定.生态学报,22(9):1425-1430.
郝再彬,苍晶,徐仲.2004.植物生理实验.哈尔滨:哈尔滨工业大学出版社:67-68,104-105,110-115.
侯维.2008.百里香化感作用研究与化感物质鉴定〔硕士论文〕.雅安:四川农业大学.
李逢雨,孙锡发,冯文强,秦鱼生,王昌全,涂仕华.2008.水稻秸秆水浸提液对小麦的化感作用研究.西南农业学报,21(4):960-964.
马亚飞,杨平,吴凤芝.2011.不同品系小麦根系分泌物对黄瓜化感作用的初步研究.中国蔬菜,(10):23-27.
孔垂华,徐涛,胡飞.1998.胜红蓟化感作用研究Ⅱ:主要化感物质的释放途径和活性.应用生态学报,9(3):257-260.
亓延凤.2006.作物秸秆对日光温室连作土壤特性及黄瓜生育的影响研究〔硕士论文〕.泰安:山东农业大学.
沈慧敏,郭鸿儒,黄高宝.2005.不同植物对小麦、黄瓜和萝卜幼苗化感作用潜力的初步评价.应用生态学报,16(4):740-743.
王玉彦,吴凤芝,周新刚.2009.不同间作模式对设施黄瓜生长及土壤环境的影响.中国蔬菜,(16):8-13.
王德胜.2008.不同品种小麦化感物质在土壤中的滞留、迁移及其活性变化研究〔硕士论文〕.杨凌:西北农林科技大学.
吴凤芝,孟立君,文景芝.2002.黄瓜根系分泌物对枯萎病菌丝生长的影响.中国蔬菜,(5):26-27.
吴凤芝,潘凯,周秀艳.2005.苯丙烯酸对黄瓜幼苗生理特性的影响.应用生态学报,16(5):915-918.
吴凤芝,王学征,潘凯.2008.小麦和大豆茬口对黄瓜土壤微生物生态特征的影响.应用生态学报,19(4):794-798.
吴凤芝,王学征.2007.黄瓜与小麦和大豆轮作对土壤微生物群落物种多样性的影响.园艺学报,34(6):1543-1546.
于翠平.2009.苗期不同化感潜力小麦根际土壤微生态特性研究〔硕士论文〕.福州:福建农林大学.
喻景权,杜尧舜.2000.蔬菜设施栽培可持续发展中的连作障碍问题.沈阳农业大学学报,31(1):124-126.
喻景权.2011.“十一五”我国设施蔬菜生产和科技进展及其展望.中国蔬菜,(2):11-23.
赵福锁,何龙飞,罗庆云.2004.植物逆境生理生态学.北京:化学工业出版社:24-27.
赵媛.2005.小麦幼苗中丁布的含量、异株克生活性与诱导效应研究〔硕士论文〕.杨凌:西北农林科技大学.
PutnaMA R,Duke W B.1974.Biological suppression of weeds evidence for allelopathy in accessions of cucumber.Science,185:370-372.
Wu H W,Haig T,Pratley J,Lemerle D,An M.2000.Distribution and exudation of allelochMicals in wheatTriticuMaestivum.Journal of CheMical Ecology,26(9):2141-2154.
Wu F Z,Huang C H,Zhao F Y.2002.Effect of phenolic acids on growth and activities of membrane protective enzymes of cucumber seed lings.Agricultural Sciences in China,1(8):900-904.
Yu J Q,Su F Y,Ming F Z,Wen H H.2003.Effect of root exudates and aqueous root extracts of cucumber(Cucumis sativusL.)and allelochemicals,on photosynthesis and antioxidant enzymes in cucumber.Biochemical Systematics and Ecology,31:129-139.

