辽北地区鸡致病性大肠杆菌的耐药性研究
刘山辉 辽宁职业学院,辽宁铁岭 112001
1 试验材料
1.1 试验菌种来源
来源于本地区11家肉种鸡场和商品肉鸡场发病鸡病料分离培养物。
1.2 药品与试剂
(1)革兰氏染液、美蓝染液、微量发酵管(由辽宁检验检疫局检测中心提供)。
(2)致病性大肠杆菌阳性血清购自中国兽药监察所。
(3)抗菌原液:将各种抗菌药物稀释成2mg/ml,中草药稀释成相当于含原生药1g/ml。
(4)中草药组方(每克)
双黄连:金银花:0.4g黄连0.6g
白头翁散:白头翁0.35g黄连0.25g黄柏0.25g秦皮0.15g
三黄加白散:黄连0.35g黄柏0.25g黄岑0.25g白头翁0.15g
苦参合剂:苦参0.6g黄连0.4g鱼腥草粉剂:鱼腥草粉剂1g穿心莲粉剂:穿心莲粉剂1g
1.3 培养基
普通营养琼脂培养基、伊红美兰琼脂培养基、乳糖胆盐肉汤培养基。
1.4 药敏纸片
购自北京天坛药物生物技术开发公司,中草药药敏纸片为自制(相当于含原生药10mg/片)。
1.5 仪器
微量移液器、恒温箱、微生物接种用具。
2 试验步骤
2.1 致病性大肠杆菌的分离与鉴定
2.1.1 菌种的分离
剖检病死鸡,无菌操作采取病死鸡的心血、肝脏病料接种于乳糖胆盐肉汤培养基中进行增菌培养,进一步移接至伊红美兰琼脂培养基,37℃培养24h,挑选典型菌落接种到斜面培养基上,作为试验菌种保存。
2.1.2 生化试验
将试验菌种分别接种于微量发酵管,置灭菌培养皿中37℃培养24~48h,观察发酵情况。在培养48 h后,加入靛基质试剂于蛋白胨水中,检查是否有靛基质生成。
生化试验结果显示,分离的菌种能发酵甘露醇、麦芽糖、葡萄糖、蔗糖、乳糖、鼠李糖、蕈糖、果糖产酸产气,靛基质试验和M.R试验阳性,山梨醇、鸟氨酸试验结果阳性。V-P试验、卫矛醇、肌醇、硝酸盐、酒石酸盐、水杨素、精氨酸水解酶、阿拉伯醇、血清菊糖、鸟氨酸、精氨酸脱羧酶、丙氨酸盐、乙酰胺利用试验结果阴性。经生化特性鉴别,证明病料中分离出的细菌是病原性大肠杆菌。
2.1.3 血清型鉴定
采用试管凝集方法,用每ml含10~60亿菌体抗原的肉汤培养物,加上等量的被检动物菌体抗原阳性血清,菌体抗原阳性血清分别为摇晃均匀,在 2~3m in内,如发生凝集反应者为阳性反应,不凝集者则为阴性反应,根据阳性血清的抗原种类判定被检菌株的血清型。结果如表1。

表1 大肠杆菌血清型鉴定结果
2.2 诱导前药敏试验
根据血清学试验,将优势血清型O78作为进一步试验研究对象。试验前将试验菌种在无药乳糖胆盐肉汤培养基上继代接种培养10代,尽量消除已产生的耐药性。采用纸片扩散法进行药敏试验,用无菌棉拭蘸取菌液,无菌操作涂布接种在普通营养琼脂培养基表面,粘贴药敏纸片,置37℃恒温箱内培养16~18h后观察结果。结果如表2。

表2 诱导前药敏试验结果
2.3 耐药诱导试验
根据试验结果,选取原始药敏试验中抑菌直径大于等于15mm的抗菌药物作为进一步试验研究对象,进行耐药诱导试验。操作方法如下:
(1)取已加入5m l乳糖胆盐发酵培养基试管27支,在无菌操作台上将每管中分别用微量移液器移入一种抗菌药物原液,计算移入药液量,使各管中抗菌药物浓度达到抗菌原液的10-5,混匀,并作好标记,余一管作空白生长对照。
(2)无菌操作将试验菌种接入各试管中,作抗菌药物的适应性培养,37℃培养24h,结果大肠杆菌均能在该浓度培养液中生长良好。
(3)另取已加入5m l乳糖胆盐发酵培养基试管27支,同样的无菌操作方式,将试管中各抗菌药物抗菌原液加至10-4,同样作好标记,将上述适应培养的大肠杆菌相对应的移接至该浓度培养基中,37℃ 培养 24h。
(4)当大肠杆菌在培养基中生长良好时即可移接入下一个10倍梯度的对应抗菌药物培养基中继代培养,否则仍在同一梯度中继代培养,直至生长良好,同时记录细菌的生长情况。观察培养结果。耐药诱导试验结果如表3。
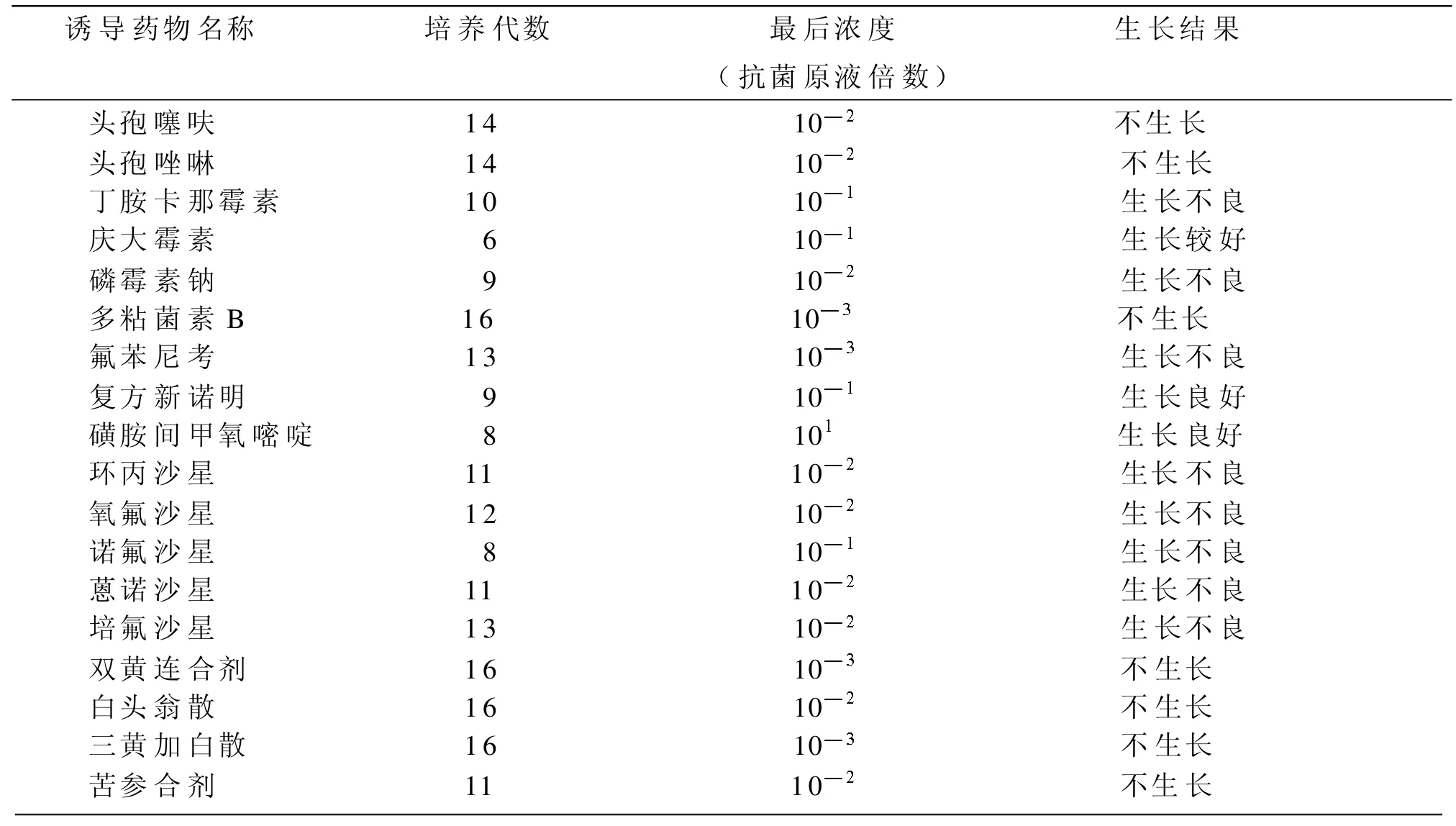
表3 耐药诱导试验结果
2.4 诱导耐药后的药敏试验
当细菌不断的适应含药培养基环境而产生耐药性后,随着抗菌药物浓度的10倍递增,在某一浓度仍无法继续良好的生长和继代时,即可停止该药物的耐药试验,保留末代产生耐药的菌种,并分别用纸片法作末代耐药菌种对抗菌药物敏感试验。结果如表4。

表4 耐药后的药敏试验结果
2.5 敏感性恢复试验
将已经产生耐药性的大肠杆菌末代培养物分别移接至无药的乳糖胆盐肉汤中继代培养,并作原耐药名称的标记,37℃培养24h为一代。每代培养后,均用原抗菌药敏纸片作药敏试验,直至细菌对已耐药的抗菌药物敏感性最大程度的恢复,即可停止继代培养,并记录试验结果。结果如表5。
3 试验结果分析
3.1 铁岭地区鸡大肠杆菌病普遍存在,分离的致病性大肠杆菌血清型为 O1、O2、O35、O36、O78、O111,其中O78为优势血清型。
3.2 从该地区分离出的鸡致病性大肠杆菌对中草药复方制剂呈高度敏感状态,并且几乎不产生耐药性,因此应为本地区的鸡性大肠杆菌病防治的首选药物。
3.3 从该地区分离出的鸡致病性大肠杆菌对氟苯
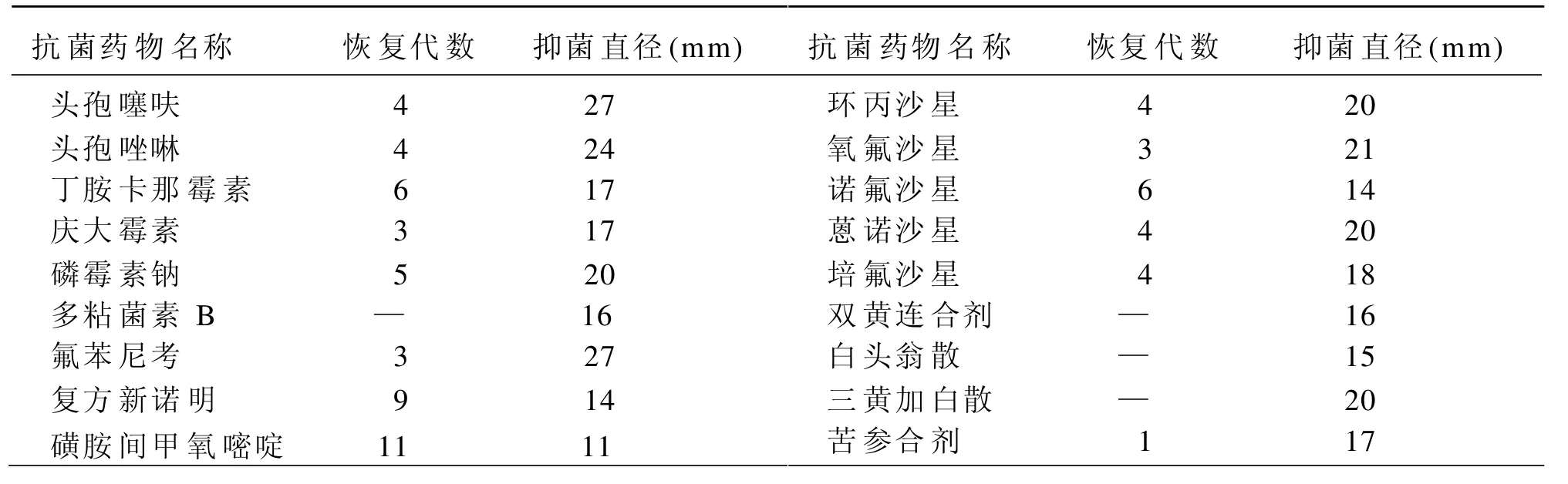
表5 敏感性恢复药敏试验结果
尼考、头孢噻呋、头孢啉唑、多粘菌素B均为高度敏感,产生一定耐药后仍呈现出高度敏感性,产生耐药性慢并且恢复较快。因此适于本地区的鸡性大肠杆菌病的防治。。
3.4 从该地区分离出的鸡致病性大肠杆菌对庆大霉素、丁胺卡那霉素、环丙沙星、氧氟沙星、蒽诺沙星、培氟沙星,磷霉素钠呈高度敏感状态,但很容易产生耐药,耐药产生速度快,耐药后敏感性明显降低,呈现出中敏或低敏。但停药后又能有不同程度的恢复。因此可突击性使用防治本地区的鸡性大肠杆菌病,不宜连续使用。
3.5 分离出的鸡致病性大肠杆菌对磺胺类药耐药产生速度快、耐药产生明显,一定时期内无法恢复敏感性。
3.6 本次试验的操作不在于设备和仪器的先进程度,主要是充分的应用了兽医专业的微生物学和药理学的基本理论,灵活机动地设计出试验的步骤和方法,利用常规微生物实验室和药理实验室的基本设备即可完成试验内容,对于其他类抗菌药物和新型的抗菌药物的试验和测试有一定的借鉴价值。
[1]赵新先.中药注射剂学(M).第一版.广东:广东科技出版社,2000.
[2]曹文斌等.细菌耐药机制及控制对策(J).中国畜牧兽医,2005,32(11):52-53.
[3]褚德明.兽医药理学(M).第一版.南京:东南大学出版社,2000:24-42.
[4]方定一,甘肃农业大学主编.兽医微生物学实验指导(M).第一版.北京:中国农业出版社,1987:83-84.
[5]甘肃农业大学.兽医微生物学[M].第二版.北京:农业出版社,1991.
[6]梁运霞.动物药理与毒理(M).第一版 北京:中国农业出版社,2006:36-72.
[7]王福远,刁有祥.鸡大肠杆菌的耐药性分析(J).农业知识,2002,24(12):26-27.
[8]中国兽药典委员会编.中国兽药典(M).北京:中国农业出版社,1992, (3):194-205.

