表观健康的猪肉携带猪链球菌的调查
臧莹安,谢乐新,李家侨,庞木生,李 淼,宋 帅,李春玲
(1.仲恺农业工程学院动物科学系,广东 广州 510225;2.广东省农业科学院兽医研究所 广东省兽医公共卫生公共实验室,广东 广州 510640;3.广东省动物疫苗供应站,广东 广州 510225)
猪链球菌病(SS)是由猪链球菌引起的人兽共患传染性疾病,给养猪业及公共卫生安全构成了严重的威胁。人和猪感染发病的临床症状相似。以往对猪肉进行食品安全检测的项目多集中在致泻大肠杆菌、沙门菌、单增李斯特菌等食源性病原菌,检测过程中,偶尔也能分离到链球菌,但多数是没有致病性的[1-2]。在经济高度发达的时代,食品安全越来越成为人们关注的焦点,本次通过对广州大型农贸市场销售的屠宰猪肉的随机抽样,初步了解表观健康的猪肉携带猪链球菌的情况和耐药性情况,为防范食源性猪链球菌病感染人及耐药性的传播提供理论依据。
1 材料与方法
1.1 主要仪器 PCR仪,DYY-5型稳压稳流电泳仪,全自动数码凝胶图像分析系统-Tanon-1600,Fast win台式离心机Fc-16c,SW-CJ-2FD双人单面净化工作台,HZQ-X100震荡培养箱,均购自杭州博日科技有限公司。
1.2 主要试剂 新生牛血清,购自北京鼎国昌盛生物技术有限责任公司;血平板,购自广东环凯微生物科技有限公司;托-休二氏液体培养基(Todd-Hewitt broth,简称THB)和托-休二氏固体培养基(Todd-Hewitt Agar,简称THA)均为自行配制。猪链球菌分型试剂盒、药敏试验纸片和猪链球菌乳胶凝集标准诊断试剂盒,均购自杭州天和微生物试剂有限公司。
根据猪链球菌2型溶血素基因设计引物,PCR引物序列为:GTTGAGTCCTTATACACCTGTT,CAGAAAATTCATATTGTCCACC
1.3 样品的采集 2010年7~8月,在广州某大型农贸市场集中采集样品66份,用消毒后的手术刀切开猪肉暴露切口,再用灭菌棉签拭猪肉的新鲜切口,放入装有1mLTHB液体培养基的试管中,于37℃恒温摇床180r/min中震荡培养18h。
1.4 猪链球菌的分离 在超净工作台中采用划线分离培养法用接种环挑取菌液接种于血平板上,37℃培养14~16h,经培养无杂菌者,选取α溶血、光滑圆形、半透明、直径1~2mm的小菌落,每个样品挑去3~6个疑似菌落,分别接种3mL THB培养基中,37℃培养16~18h后,仔细观察分离菌经培养后的生长情况,并挑取单个可疑菌落和液体培养物分别作革兰染色镜检。
1.5 猪链球菌的PCR鉴定 利用16SrRNA的PCR检测猪肉中的猪链球菌,具体步骤如下。
PCR扩增采用25μL反应体系。在反应管中依次加入 10×PCR Buffer 2.5μL、25 mmol/L MgCl22.0μL、2.5 mmol/L dNTPs 2.0μL、10 pmol/μL引物1.0μL、模板1.0μL、5U/μL Taq酶0.5μL,然后加ddH2O调整终体积至25μL。94℃变性5min后进入循环,94℃0s,60℃1min,72℃1.5min,35个循环后72℃保温10min。将得到的PCR产物用1.5%琼脂糖凝胶进行电泳。取6.5μL PCR产物和1μL 6×Buffer上样缓冲液充分混匀置2.0%琼脂糖凝胶 (含溴化乙锭替代物Goldview)电泳。电压5V/cm,电流130mA,用凝胶成像仪观察结果并拍照。
1.6 猪链球菌的生化试验 将分离的菌株接种于THB培养基中37°C培养16~18h,用1mL灭菌注射器各吸取0.05~0.08mL(约1~2滴)的菌悬液加入每种微量发酵管。放于37℃培养箱中培养24h。记录结果。
1.7 猪链球菌的血清分型 分离出来的猪链球菌,采用凝集的方法进行分型[3]。
1.8 猪链球菌的分群 按猪链球菌乳胶凝集标准诊断试剂盒说明书进行。
1.9 猪链球菌的药敏试验 采用纸片扩散法进行[4]。
2 试验结果
2.1 猪肉中猪链球菌的阳性率 66份表观健康的猪肉,经PCR扩增确定9份为猪链球菌阳性样品,总体阳性率为13.6%。
2.2 猪链球菌的生化试验 分离到的9株猪链球菌发酵乳糖,血清菊糖,棉子糖,七叶苷,水杨素,海藻糖;不发酵6.5%NaCl,马尿酸钠,甘露醇,山梨醇。
2.3 猪链球菌的血清型分型结果 9株猪链球菌采用凝集的方法进行血清型分型,确定其中8型,9型,18型,26型各1株,27型3株,32型2株。
2.4 猪链球菌的分群结果 9株猪链球菌分群的结果:确定5株是C群,4株是D群。
2.5 猪链球菌的药敏试验结果 见表1。
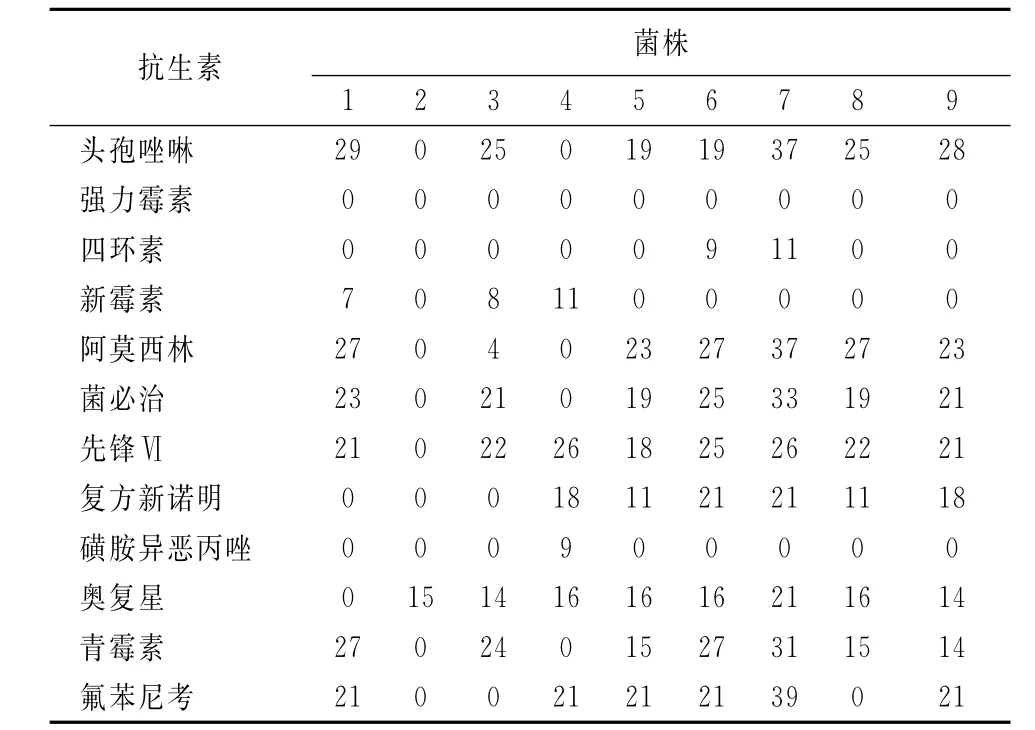
表1 药敏试验结果 (mm)
由表1可知,分离到的9株链球菌对12种抗菌药物呈现不同程度的耐药性,且以多重耐药为主。链球菌对同一种药物的敏感性有很大的差异,总体来说分离的菌株对头孢唑啉,先锋Ⅵ ,阿莫西林,氟苯尼考,奥复星高度敏感;对青霉素中度敏感;对强力霉素,四环素,新霉素,菌必治,复方新诺明和磺胺异恶丙唑耐药。
3 讨论与分析
本次从广州某大型农贸市场采集了66份表观健康的猪肉,采用PCR的方法进行检测,猪链球菌的阳性率达到了13.6%。此次试验不同于其他试验从猪的扁桃体,脾脏或者血液中检测猪链球菌的携带情况,而是考虑到食品的安全和人体健康,直接从表观健康的猪肉中进行猪链球菌检测的。2010年从上海屠宰猪扁桃体中调查猪链球菌感染率,取样231份样品中共确定24份猪链球菌,阳性率达到10.4%[5]。相比之下,屠宰猪扁桃体和表观健康的猪肉中猪链球菌的阳性率基本一致,说明猪链球菌的携带方式不仅仅是内脏或者血液,猪肉中也同时携带猪链球菌。猪链球菌是急性热性人兽共患传染病,而猪肉作为日常生活中不可或缺的肉制品,为了保证食品的安全和人体的健康,确实是有待加强猪链球菌病的监测和防控工作。
生化试验的结果是能发酵乳糖,血清菊糖,棉实糖,七叶苷,水杨素,海藻糖;不发酵6.5%NaCl,马尿酸钠,甘露醇,山梨醇。从生化试验的结果来看,这与其他省、市所报道的猪链球菌主要流行群基本一致,本试验验菌株的生化特性与其他报道[6-7]没有区别,生化指标可作为细菌鉴定的一个参考。同时也佐证了PCR方法作为猪链球菌鉴定方法的准确性和精确性。
猪链球菌的血清型有1~34型和1/2型,共35种血清型[8],在分离到的阳性的菌株采用血清凝集试验进行血清分型,确定其中8型,9型,18型,26型各1株,27型3株,32型2株。虽然这次试验并没有发现严重危害人类健康的2型猪链球菌,但是从猪肉中检出2型猪链球菌的例子是屡见不鲜。2007年从非法屠宰的猪肉中检出猪链球菌2型,由公安部门和兽医卫生监督部门查获和送检的,推断在屠宰前该批猪就已感染猪链球菌2型,或是屠宰前就是猪链球菌2型病死猪,送检时猪肉可能受到血液或实质器官污染[9]。
本次从猪肉中分离到的9株猪链球菌对12种抗菌药物的敏感性有一定的差异性,呈现不同程度的耐药性,且以多重耐药为主。总体来说分离的菌株对头孢唑啉,先锋Ⅵ,阿莫西林,氟苯尼考,奥复星高度敏感;对青霉素中度敏感;强力霉素,四环素,新霉素,菌必治,复方新诺明和磺胺异恶丙唑呈耐药。此次的试验说明,猪链球菌都产生多重耐药性。这给临床治疗带来了很大的困难,严重威胁着人类和动物的生命及健康安全,也给新药的开发带来了巨大的压力。建议猪场在防治猪链球菌病时,对菌株进行药敏试验,根据试验结果用2~3种敏感药物按疗程和足够的剂量交替使用。
[1]李春玲,余炜烈,王贵平.猪链球菌扁桃体分离株的毒力因子分布特征与致病性[J].中国预防兽医学报,2009(2):645-648.
[2]倪艳秀,何孔旺,王继春,等.检测猪链球菌2型的溶菌酶释放蛋白(MRP)的PCR方法的建立[J].中国预防兽医学报,2001,23(1):20-22.
[3]高志勇,庄辉.人-猪链球菌病研究进展[J].中华流行病学杂志,2005(9):645-648.
[4]陈泽祥,吴礼结,许力干,等.广西猪源链球菌分离株的分群鉴定[J].中国畜牧兽医,2005,32(12):38-40.
[5]Han D U,Choi C,Ham H J,et al.Prevalence,capsular type and antimicrobial susceptibility of Streptococcus suis isolated from slaughter pigs in Korea[J].Can J Vet Res,2001,65(3):151-155.
[6]王丽平,陆承平,唐家琪.链球菌对大环内酯类抗生素的耐药性及耐药表型[J].南京农业大学学报,2004,27(4):81-84.
[7]闫若潜,赵明军,张志凌,等.河南省致病性猪链球菌血清型及耐药性状况调查[J].河南畜牧兽医,2007,28(5):25-27.
[8]田云,孙彦伟.猪链球菌鉴定方法的研究进展[J].广东畜牧兽医科技,2006,31(4):6-8.
[9]李小军,张苏华,刘佩红,等.从非法屠宰的猪肉中检出猪链球菌2型[J].畜牧与兽医,2007,39(8):45-48.

