雷公藤多苷对佐剂性关节炎大鼠P物质表达的影响
戴巧定 宋欣伟 浙江中医药大学附属第一医院 杭州 310006康海英 杭州市余杭区第五人民医院
类风湿关节炎(rheumatoid arthritis,RA)是一种以慢性多关节肿痛为主要临床表现,严重影响患者生活质量的自身免疫性疾病。确切病因及发病机制迄今不明,其基本病理特征为滑膜炎,细胞因子在滑膜病变中起核心作用,其中肿瘤坏死因子(tumor necrosis factor-a,TNF-α)和白介素(interleukin-1β,IL-1β)均是RA发病机制中居中心地位的促炎细胞因子[1]。有研究显示[2-5],RA患者在神经免疫调节方面有诸多异常改变,与多种神经肽有关,其中P物质(substance P,SP)是一种神经递质,在炎症、疼痛的发生机制中都占有重要的地位,对关节炎的发生发展有重要促进作用。雷公藤(Tripterygium wilfordii.Hook)治疗RA疗效肯定,具有缓解症状和改善病情的双重作用[6]。本研究应用佐剂性关节炎大鼠模型,予雷公藤多苷灌胃治疗,观察大鼠血液、关节滑膜等外周组织以及中枢脊髓后角的SP水平的变化,初步探讨其作用机制。
1 实验材料
1.1 实验动物 健康Wistar雄性大鼠,体重150±10g,清洁级,由浙江中医药大学实验动物中心提供。1.2 试剂与仪器 不完全弗氏佐剂:Sigma公司;冻干注射用灭毒卡介苗(BCG):上海生物制品研究所;P物质放免试剂盒:北京华英生物技术研究所;TNF-α、IL-1β放免试剂盒:北京北方生物技术研究所;SN-695型智能放免r测量仪:上海原子核研究所日环仪器一厂;GC-911-r-放射免疫技术仪:中国科技大学实业总公司;雷公藤多苷片,上海医科大学红旗制药厂,批号060603,规格10mg/片,临用前用蒸馏水配成0.5mg/mL混悬液。
2 实验方法
2.1 模型建立 造模组大鼠右侧后肢足跖部皮内注射0.1 mL完全弗氏佐剂,正常组注射0.1mL生理盐水。致炎前,用电子天平测量大鼠体质量,用足趾容积测量仪测量每只大鼠右后足(标记线以下)的足容积(mL3),作为模型前的足基础容积,代表造模前情况。致炎后15天,再次称重、测量大鼠两侧脚掌的体积,并根据成功评判指标[7]判断造模是否成功,并剔除造模不成功者。
2.2 分组及给药 实验大鼠随机分为正常组、模型组、雷公藤组,各10只。造模成功(致炎后15天)后开始给药,雷公藤组给予雷公藤多苷片,每鼠每次给药2 mL,每天灌胃2次;正常及模型组每鼠每次给蒸馏水2 mL,每天灌胃2次,共30天。
2.3 观察指标与标本采集 致炎前用足趾容积测量仪首先测量并记录各组大鼠右后足的足容积(mL3),致炎后密切观察足跖肿胀情况,并分别于致炎后1、15、30、45天测量各组大鼠体质量及右后足的足容积(mL3),同时观察治疗药物对大鼠足跖肿胀的影响。给药30天后取各组大鼠的静脉血,离心后提取血浆,剩余全血离心后提取血清,均置于-20℃保存备用;同时迅速取出AA大鼠脊髓腰段及L3~5对后根神经节,经液氮冻存后,用打孔法取出脊髓后角,经4℃低温离心机4 000 r/min离心10 min后,提取上清液并-70℃密封保存,备测;制备大鼠膝关节滑膜并提取上清液,-70℃保存备检。
2.4 标本放射免疫法测定 严格按照试剂盒说明操作,将制备好的血浆、血清、脊髓上清液、滑膜上清液分别进行P物质、TNF-α、IL-1β测定。
3 实验结果
3.1 各组大鼠右足跖肿胀程度 致炎后第1、15天,模型组大鼠右足跖与正常组比较肿胀明显(P<0.05);雷公藤组予灌胃治疗30天后,与模型组比较,右足跖肿胀明显减轻,差异有统计学意义(P<0.05),见表1。
表1 各组大鼠右足跖肿胀程度比较(±s)mL3
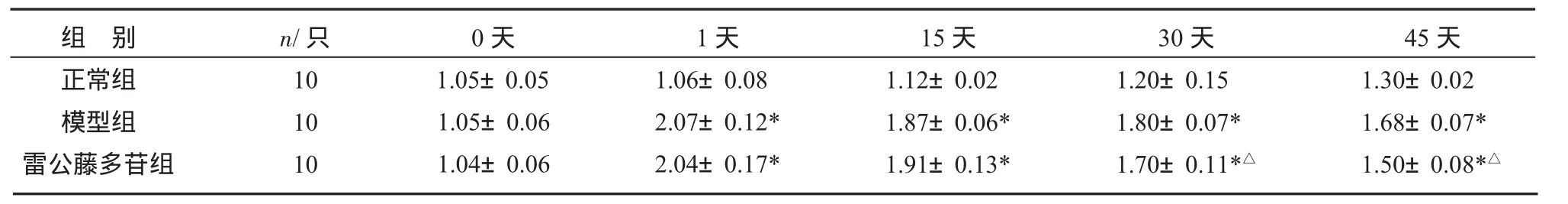
表1 各组大鼠右足跖肿胀程度比较(±s)mL3
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05
15天1.12±0.02 1.87±0.06*1.91±0.13*组 别正常组模型组雷公藤多苷组n/只10 10 10 0天1天1.05±0.05 1.05±0.06 1.04±0.06 1.06±0.08 2.07±0.12*2.04±0.17*30天1.20±0.15 1.80±0.07*1.70±0.11*△45天1.30±0.02 1.68±0.07*1.50±0.08*△
3.2 各组大鼠体质量变化 致炎后大鼠体质量较正常大鼠增长明显缓慢,予雷公藤多苷干预后,体质量增加较模型组快,但差异无统计学意义(P>0.05),见表2。
表2 各组大鼠体质量比较(±s)g

表2 各组大鼠体质量比较(±s)g
注:与正常组比较,*P<0.05
15天200.00±9.32 174.40±6.80*170.00±6.20*组 别正常组模型组雷公藤多苷组n/只10 10 10 1天162.12±2.78 159.31±1.03 151.20±3.62 30天266.25±7.54 190.40±9.55*196.80±7.56*45天302.00±8.04 209.20±5.11*221.80±7.56*
3.3 各组大鼠SP水平比较 造模成功后,模型组大鼠脊髓后角、血浆和滑膜中的SP水平均明显高于正常组(P<0.05);药物干预后,与模型组比较,雷公藤组大鼠血浆、滑膜SP水平降低(P<0.05),其中滑膜SP水平接近正常组水平(P>0.05),但脊髓后角SP水平在治疗30天后无明显下降(P>0.05),见表3。
表3 各组大鼠血浆组织SP含量比较(±s)pg/mL
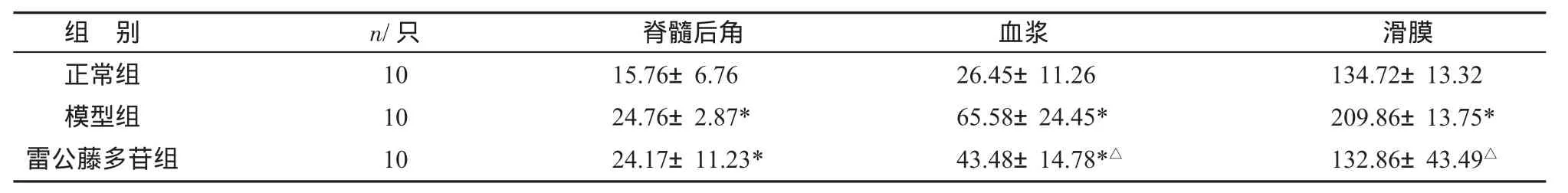
表3 各组大鼠血浆组织SP含量比较(±s)pg/mL
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05
组 别正常组模型组雷公藤多苷组n/只10 10 10脊髓后角15.76±6.76 24.76±2.87*24.17±11.23*血浆26.45±11.26 65.58±24.45*43.48±14.78*△滑膜134.72±13.32 209.86±13.75*132.86±43.49△
3.4 各组大鼠TNF-α、IL-1β水平比较 与正常组比较,造模成功后,模型组大鼠血清、滑膜中的TNF-α、IL-1β 水平显著升高(P<0.05);给药后,与模型组比较,雷公藤组大鼠血清、滑膜中TNF-α水平及滑膜中 IL-1β 都显著降低(P<0.05),见表4。
表4 各组大鼠血清组织TNF-α、IL-1β水平比较(±s)pg/mL
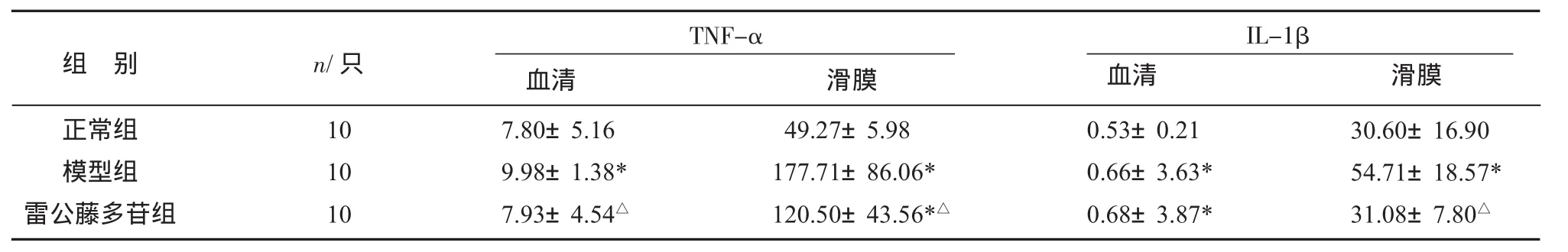
表4 各组大鼠血清组织TNF-α、IL-1β水平比较(±s)pg/mL
注:与正常组比较,*P<0.05;与模型组比较,△P<0.05
TNF-α血清 滑膜0.53±0.21 0.66±3.63*0.68±3.87*组 别正常组模型组雷公藤多苷组n/只10 10 10 7.80±5.16 9.98±1.38*7.93±4.54△49.27±5.98 177.71±86.06*120.50±43.56*△IL-1β血清 滑膜30.60±16.90 54.71±18.57*31.08±7.80△
4 讨论
目前认为,多基因和环境因素共同诱发RA病理性自身免疫反应,并导致RA表现以破坏性多关节炎和不同的关节外炎症病变,其中细胞因子在其病变中具有重要作用,TNF-α、IL-1β均是RA发病机制中居中心地位的促炎症细胞因子。在RA患者血液及炎性滑液中均可检测出高浓度的TNF-α和IL-1β,并与关节炎活动程度相一致,应用TNF-α单克隆抗体以及IL-1受体拮抗剂可以明显改善RA患者的病情[8]。
SP是最早发现的一种神经肽,属于哺乳动物速激肽家族,在哺乳动物体内广泛存在,具有重要的免疫调节功能。SP对伤害性感受器及炎症有初级的始动作用,即周围神经末梢由于组织损伤或炎症时释放的化学介质变得敏感,释放SP。SP作用于T、B淋巴细胞膜上的SP受体,能增强T细胞增殖功能,调节B细胞合成免疫球蛋白,促进肥大细胞脱颗粒,释放组胺及5-羟色胺,促进各种细胞因子如IL-1、IL-6、TNF-α等的产生,进一步加重炎症。SP也是一种舒血管物质,能增强血管通透性,导致血浆渗出和水肿,因此在关节炎的病理状态下,关节局部SP浓度上升可导致毛细血管扩张,通透性增加,出现红肿的临床表现[9]。Lotz等[10-11]等对类风湿关节炎患者的滑膜组织进行体外培养,显示SP能使类风湿关节滑膜组织增生,刺激胶原酶、前列腺素E2释放,后两者又增加了RA滑膜细胞增殖,且这种作用可被SP拮抗剂抑制,提示神经末梢释放的SP可以直接参与类风湿关节炎的病理过程。这表明SP在关节炎的血管翳形成、软骨与骨破坏中起重要作用。并有最新研究显示[3],依那西普(TNF-α抑制剂)治疗RA患者11例,血清中SP水平明显下降。
SP既是炎症介质,同时又是一种疼痛递质,处于致痛机制中的中心地位,在脊髓背角胶质区富含SP传入纤维末梢,持续电、热、化学等外周伤害性刺激可引起传入纤维末梢SP释放,脊髓背角的SP明显增多。傅开元等[12]发现疼痛性颞下颌关节紊乱综合征(TMJDS)患者关节液SP含量明显高于无痛性TMJDS。SP能传导及易化初级伤害性刺激,还能促进另一种疼痛介质前列腺素E2的分泌,激活依靠前列腺素的感受伤害途径,这可能是关节疼痛传递的机制之一。SP还可刺激肥大细胞脱颗粒,释放组织胺等非神经源性疼痛介质而致痛。另外,SP诱导的IL-1β、IL-6和TNF-α等炎性细胞因子具有明显的诱导痛觉过敏的作用。SP的这些作用均促进疼痛的产生,加重疼痛反应[13]。
雷公藤为卫茅科植物,研究表明,雷公藤具有抗炎、免疫抑制及抗增殖等作用,广泛应用于类风湿性关节炎(RA)、肾小球肾炎、皮肤病、肿瘤等多种疾病的治疗,疗效肯定。雷公藤治疗RA的细胞与分子生物学主要机制:通过抑制细胞内转录因子活性减少炎症部位炎症介质、细胞因子、趋化因子、黏附分子等水平,减少炎症反应;通过诱导T淋巴细胞和滑膜细胞发生细胞凋亡,产生免疫抑制和抑制血管翳增殖作用,达到控制RA活动进展的目的[6]。临床发现,雷公藤多苷既具有抗炎免疫抑制作用,又有镇痛作用。李振军等[14]认为,中枢SP与免疫功能有关,提示雷公藤多苷对佐剂性关节炎的治疗可能是通过提高中枢SP含量抑制免疫。本研究结果显示,SP在AA大鼠的外周及中枢组织中高表达,与TNF-α、IL-1β的水平相一致,提示SP在RA的炎症及疼痛过程中起重要作用,与以往研究结果一致。雷公藤多苷治疗后,关节肿胀改善,其作用途径可能通过抑制血液及滑膜中的SP、TNF-α和IL-1β水平而起到抗炎免疫抑制及镇痛作用,且对滑膜的影响大于血液,但对中枢SP水平无影响,可能与用药剂量、作用时间或样本量等多种因素有关。同时SP作为疼痛介质,中枢SP是否与疼痛关系更为密切,非甾体消炎药的治疗能否降低其水平,尚有待于进一步研究。
[1]蒋明,David Yu,林孝义,等.中华风湿病学[M]. 北京:华夏出版社,2004:706-733.
[2]BaerwaldCG,PanayiGS.Neurohumoralmechanismsin rheumatoid arthritis[J].Scand J Rheumatol,1997,26(1):1-3.
[3]Origuchi T,Iwamoto N,Kawashiri SY,et al.Reduction in serum levels of substance P in patients with rheumatoid arthritis by etanercept,a tumor necrosis factor inhibitor[J].Mod Rheumatol,2011,21(3):244-250.
[4]Ahmed AS,Li J,Ahmed M,et al.Attenuation of pain and inflammation in adjuvant-induced arthritis by the proteasome inhibitor MG132[J].Arthritis Rheum,2010,62(7):2160-2169.
[5]Dirmeier M,Capellino S,Schubert T,et al.Lower density of synovial nerve fibres positive for calcitonin gene-related peptide relative to substance P in rheumatoid arthritis but not in osteoarthritis[J].Rheumatology(Oxford),2008,47(1):36-40.
[6]陈哲,李瑞林,涂胜豪.雷公藤治疗类风湿关节炎细胞和分子生物学机制的研究与进展[J].中国中西医结合杂志,2009,29(2):183-186.
[7]陈柏松,徐玉东,钟淑琦.大鼠佐剂性关节炎模型的建立与评价[J].哈尔滨医科大学学报,2005,39(6):489-491.
[8]Furst DE,Keystone EC,Braun J,et al.Updated consensus statement on biological agents for the treatment of rheumatic diseases,2010[J].Ann Rheum Dis,2011,70 (Suppl 1):i2-36.
[9]Saito T,Koshino T.Nerve distribution in synovium of osteoarthritic knees[J].Clin Calcium,2002,12(1):59-62.
[10]Lotz M,Carson DA,Vaughan JH.Substance P activation of rheuma toid synoviocytes:neural pathway in pathogenosis of arthritis[J].Science,1987,235(4791):893-895.
[11]Bring DK,Heidgren ML,Kreicbergs A,et al.Increase in sensory neuropepti des surrounding the Achilles tendon in rats with adjuvant arthritis[J].J Orthop Res,2005,23(2):294-301.
[12]傅开元,边景檀.颞下颌关节紊乱综合征关节液P物质及其临床意义[J].Chin J Stomatol,1996,31(1):6-8.
[13]Grider JR.Interleukin-1 beta selectively increases substance P release and augments the ascending phase of the peristaltic reflex[J].Neurogastroenterol Motil,2003,15(6):607-615.
[14]李振军,刘燕,徐承焘,等.P物质在佐剂性关节炎发病中的作用[J].基础医学与临床,2001,21(2):185-186.

