微小RNA在直肠癌组织中的表达及其临床意义
伍尚标 陈 戎 全天一 李志发
广州医学院第三附属医院胃肠外科,广东 广州 510150
MicroRNA(minRNAs)又称微小 RNA,是一类不具有蛋白质编码功能的单链RNA,一般长度仅为25个核苷酸左右。近年来研究发现,MicroRNA在生物体中参与许多生理病理过程,并发挥着极其重要的作用。其参与的细胞分裂、分化及凋亡活动中与肿瘤的关系最为密切。
直肠癌作为消化道恶性肿瘤极为常见。据统计,近年来我国直肠癌患者明显增多,发病率上升明显,严重威胁人民身心健康。因此,早诊断、早治疗对直肠癌患者的预后改善有着极其重要的意义。
以MicroRNA为主要研究方向的癌症靶向治疗及其肿瘤分子标记技术已经成为世界热点课题,具有很广泛的应用前景,但是MicroRNA在直肠癌诱发机制中的作用研究还处于起步阶段[1-2]。随着实时荧光定量PCR(Real-time PCR)技术的大量应用,为基因在肿瘤调控机制中的作用提供技术支持。
1 资料与方法
1.1 一般资料
我院2009年1月~2011年6月实施手术治疗的直肠癌患者60例,其中,男37例,女23例,患者中位数年龄49岁,标本均通过病例检验为直肠癌。在术中分离直肠肿瘤组织和远离肿瘤组织的正常直肠样本,并即时采用液氮冻存。
1.2 试剂与仪器
RNAiso Plus (TaKaRa), Premix Ex TaqVersion 2.0,(TaKaRa),RNA PCR Kit (AMV)Ver.3.0 (TaKaRa), 伊文蓝(Invitrogen),T4 多核苷酸激酶(Invitrogen),[r-32P]ATP(北京原子能研究所),7500 Fast荧光定量 PCR 仪(ABI)。
1.3 RNA提取
低温环境下使用一次性RNase-free塑料器皿,对上述收集的我院60例直肠癌患者肿瘤组织和远离肿瘤组织的正常直肠样本标本研磨,应用Total RNA提取试剂RNAiso Plus经行总RNA提取。应用紫外分光光度计检测RNA纯度。OD260/OD280(R)值在 1.8~2.0 之间。
1.4 引物及探针的合成
根据Chen、Schmittgen等[3-4]所述设计并挑选部分前体miRNA设计PCR引物,并以miRNA-47和miRNA-152反向互补序列设计Northern blot探针(由美国Invitrogen公司合成)。
1.5 MicroRNA的反转录PCR
取 1 μL 总 RNA 进行 RT-PCR,20℃孵育 15 min,50℃反应30 min,95℃ 5 min得到cDNA。PCR反应条件,94℃预变性 5 min,90℃变性 30 s,55℃退火 30 s,70℃延伸 90 s,35个循环。
1.6 Northern印迹杂交
取20 μL总RNA与甲酰胺1∶1混合,进行尿素SDS-聚丙烯酰胺凝胶电泳。电泳完毕后进行转膜,将转好的膜与被[r-32P]ATP标记的探针杂交。内参选定为5S rRNA。
1.7 MicroRNA的实时荧光定量PCR
以制备好的cDNA为模板,荧光染料为伊文蓝,设定ABI 7500 Fast荧光定量PCR仪参数为:95℃预变性2 min,95℃ 10 s,60℃ 40 s,40 个循环。
1.8 PAM法分析
对MicroRNA在直肠癌组织及其癌旁正常组织中表达量进行分析,根据表达量变化对标本进行癌和非癌定性判断。随机选取直肠癌组织40例,确定判断标准即直肠癌组织与癌旁正常组织中表达量比值低于0.66。对另外20例标本组织进行组内随机编号,应用Real-time PCR方法检测显著表达差异的MicroRNA,然后进行20例标本组织中癌和非癌定性鉴定,即可进行判定。
1.9 统计学方法
所得数据使用SPSS 13.0统计软件包进行Student检验,结果以均数±标准差()表示,以P<0.05为差异有统计学意义。
2 结果
2.1 MicroRNA的实时荧光定量PCR
以管家基因U6 RNA做内参,用△△Ct法对Real-time PCR结果分析。其中,△△Ct=Ct miRNA-Ct U6,每个MicroRNA相对表达量为2-(△△Ct)。直肠癌组织与癌旁正常组织中表达量比值低于0.66的MicroRNA有41种。见表1。
2.2 Northern印迹杂交
根据Real-time PCR结果,随即选取miRNA-152进行Northern blot。miRNA-152 表达量降低(图 1),与其 Real-time PCR结果吻合,可旁证实时荧光定量PCR结果准确可信。
2.3 PAM分析
根据60例直肠癌标本筛选出的具有与癌旁正常结肠组织显著表达差异的MicroRNA,对另外20例组内随即编号的直肠癌组织与其正常直肠组织进行定性判断,即组内样品中MicroRNA表达量显著降低的标本即可判定为直肠癌组织。其结果与病理检验完全一致,吻合率为100%。
3 讨论
直肠癌是发达国家常见的恶性肿瘤之一[5],近年来我国经济发展,人民生活水平不断提高,伴随而来的却是直肠癌发病率年增长速度的居高不下,年增率已接近4%,2倍于世界平均水平。直肠肿瘤通常是由直肠黏膜病变,而逐渐演变为腺瘤状息肉,最后形成恶性肿瘤,瘤的形成较慢。如果在发病初期进行干预治疗,直肠癌患者可达90%的存活率,但是,早期直肠癌患者并无显著症状,有40%以上的患者属于中晚期,预后较差,存活率大大降低。因此,直肠癌发生分子机制的研究对于早期诊断治疗具有重大的临床应用价值。
表1 60例直肠癌组织(T)及其癌旁正常结肠组织(N)中miRNA的比较()
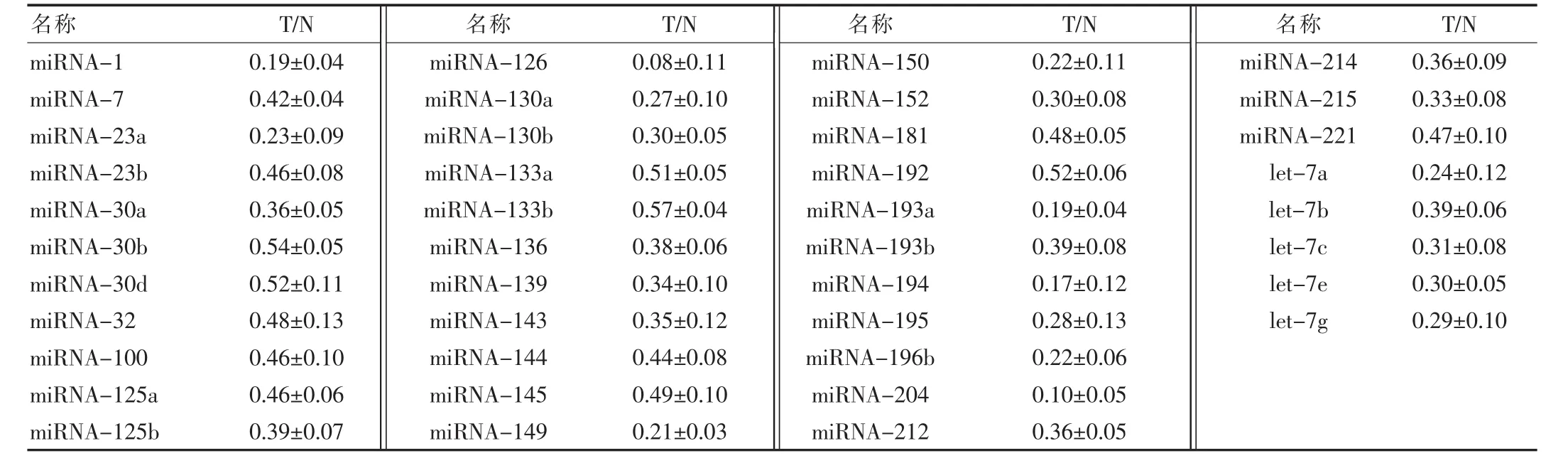
表1 60例直肠癌组织(T)及其癌旁正常结肠组织(N)中miRNA的比较()
名称 T/N 名称 T/N 名称 T/N 名称 T/N miRNA-1 miRNA-7 miRNA-23a miRNA-23b miRNA-30a miRNA-30b miRNA-30d miRNA-32 miRNA-100 miRNA-125a miRNA-125b 0.19±0.04 0.42±0.04 0.23±0.09 0.46±0.08 0.36±0.05 0.54±0.05 0.52±0.11 0.48±0.13 0.46±0.10 0.46±0.06 0.39±0.07 miRNA-126 miRNA-130a miRNA-130b miRNA-133a miRNA-133b miRNA-136 miRNA-139 miRNA-143 miRNA-144 miRNA-145 miRNA-149 0.08±0.11 0.27±0.10 0.30±0.05 0.51±0.05 0.57±0.04 0.38±0.06 0.34±0.10 0.35±0.12 0.44±0.08 0.49±0.10 0.21±0.03 miRNA-150 miRNA-152 miRNA-181 miRNA-192 miRNA-193a miRNA-193b miRNA-194 miRNA-195 miRNA-196b miRNA-204 miRNA-212 0.22±0.11 0.30±0.08 0.48±0.05 0.52±0.06 0.19±0.04 0.39±0.08 0.17±0.12 0.28±0.13 0.22±0.06 0.10±0.05 0.36±0.05 miRNA-214 miRNA-215 miRNA-221 let-7a let-7b let-7c let-7e let-7g 0.36±0.09 0.33±0.08 0.47±0.10 0.24±0.12 0.39±0.06 0.31±0.08 0.30±0.05 0.29±0.10

图1 直肠癌与癌旁正常组织miRNA-152表达变化(Northern blot)
最近对MicroRNA的研究已经成为肿瘤学研究的热点。研究表明,肿瘤发生或个体的肿瘤易感性都与MicroRNA扩增和变异有相关性。很多MicroRNA的调控靶位点与抑癌基因偶联,若这类MicroRNA功能紊乱则可导致下游基因表达的改变,进而可能会引发肿瘤的形成。据研究,有占50%以上的MicroRNA位于癌相关基因序列中,其随着癌基因的表达而发生明显变化[6-7]。因此,研究关键MicroRNA在肿瘤发生过程中的网络调控机制和鉴定,可以作为肿瘤研究新的标记分子,开创肿瘤分子诊断学和癌症临床治疗学的进新时代。
本实验对60例直肠癌标本的MicroRNA进行实时荧光定量PCR检测,发现其中有41种MicroRNA的表达量显著下降,并用Northern印迹杂交进行验证,结果一致。经PAM分析MicroRNA作为直肠癌检验依据结果可靠,方法可行。MicroRNA作为新的直肠癌标志物,具有灵敏度高、检验成本低等优点,可用于直肠癌早期筛查和普查。同时,由于能作为检验的MicroRNA种类多,所以能够避免个体差异而产生的检验错误。
综上,作为直肠癌的早期诊断和细胞靶向治疗,对MicroRNA检测都有临床价值。但是MicroRNA在肿瘤中的作用机制还未完全明确,在临床应用方面还未深入进行[8-9]。相信随着生物医学技术的不段进步,在直肠癌的早期有效诊治方面MicroRNA将发挥极其重要的作用。
[1]Guamieri DJ,DiLeone Pd.MicmRNAs:a new class of gene regulators[J].Ann Med,2008,40(3):197-208.
[2]Cheng HY,Obrietan K.Revealing a role of microRNAs in the regulation Ann Med,2008,40(3):197-208.
[2]Cheng HY,Obrietan K.Revealing a role of microRNAs in the regulation of the biological clock[J].Cell Cycle,2007,6(24):3034-3035.
[3]Chen CF,Ridzon DA,Broomer AJ,et al.Real-time quantification of microRNAs by stem-loop RT-PCR[J].Nucleic Acids Res,2005,7(4):33-79.
[4]Sehmittgen TD,Jiang J,Liu Q,et al.A high-throughput method to monitor the expression of microRNA precursors[J].Nucleic Acids Res,2004,1(3):32-43.
[5]Jemal A,Siegel R,Ward E.Cancer statistics 2007[J].CA Cancer J Clin,2007,57(2):43-66.
[6]Esquela Kerscher A,Slack FJ.Oncomirs-mieroRNAs with a role in cancer[J].Nat Rev Cancer,2006,6(3):259-269.
[7]Calin GA,Croce CM.MicroRNA signatures in human cancers [J].Nat Rev Cancer,2006,6(12):857-866.
[8]Jay C,Nemunatitis J,Chert P,et al.miRNA profiling for diagnosis and prognosis of human cancer[J].DNA Cell Biol,2007,26(13):270-293.
[9]Gartel AL,Kandel ES.miRNAs:Little known mediators of oncogenesis[J].Semin Cancer Biol,2008,18(3):103-110.

