土壤中产淀粉酶菌株的分离、鉴定及提高产酶能力的研究
傅 冰,王东明
(丽水职业技术学院 环境工程分院,浙江 丽水323000)
1 引言
淀粉酶是能催化淀粉水解转化成葡萄糖、麦芽糖及其他低聚糖的一类酶的总称。在淀粉糖工业和食品工业中被广泛利用,是最早实现工业化生产,迄今为止用途最广、产量最大的酶制剂品种[1]。按水解淀粉方式不同,把淀粉酶分为α-淀粉酶、β-淀粉酶、糖化酶和异淀粉酶4类。目前工业生产上都以微生物发酵法大规模生产α-淀粉酶[2],其中枯草芽孢杆菌生产的淀粉酶极其应用处于整个酶制剂的首位。自然界中具有十分丰富的产淀粉酶菌种资源,本实验从土壤中分离出高产淀粉酶能力的菌株,通过常规方法结合18SrDNA序列分析鉴定该菌株。通过化学诱变、物理诱变及复合诱变等方法诱变菌株,进一步筛选获得具有更高产淀粉酶能力的菌株,为今后获得能够应用于工业生产的高产淀粉酶菌株奠定了一定的基础。
2 材料与方法
2.1 材料
Taq酶、dNTPs、EasyPure Quick胶回收试剂盒、MarkerIII均购自TransGen Biotech生物公司;Mastercycle personal PCR 仪 (eppendorf,美 国);Dolphlin-DOC Plus凝胶成像系统(Wealtec,美国);HWY-100A恒温摇床(东莞吉之垄电子仪器有限公司);DHZ-CA恒温摇床(江苏太仓实验设备厂);2C40809023-723型分光光度计(上海欣茂仪器有限公司);XW-80A混匀器(上海棋特分析仪器有限公司)。
平板初筛选及试管斜面保存培养基为胰化蛋白胨1%,酵母浸膏0.5%,NaCl 0.5%,可溶性淀粉2%,琼脂2%,pH值为7.0;液体复筛培养基为胰化蛋白胨1%,酵母浸膏0.5%,NaCl 0.5%,可溶性淀粉2%,pH值为7.0;验证有无组成型突变菌株培养基配方为胰化蛋白胨1%,酵母浸膏0.5%,NaCl 0.5%,可溶性淀粉2%,葡萄糖2%,琼脂2%,pH 值为7.0。
2.2 产淀粉酶菌株的筛选
2.2.1 筛选产酶菌株的土壤处理
从丽水职业技术学院的花坛地下5~20cm处,获取熟化、有机质含量高的肥沃土壤,分离菌株。对土壤做以下几种处理:不做任何处理为对照;刮去离地面5cm表土层,翻倒土壤,深度为5cm,边长为15cm,面积为225cm2,拌入50g可溶性淀粉;拌匀后,轻拍土壤,上盖薄膜保湿。培养5d。刮去离地面5cm表土层,翻倒土壤,深度为5cm,边长为15cm,面积为225cm2,拌入50g可溶性淀粉、10g蛋白胨,拌匀后,轻拍土壤,上盖薄膜保湿。培养5d。刮去离地面5cm表土层,翻倒土壤,深度为5cm,边长为15cm,面积为225cm2,拌入50g可溶性淀粉、10g硫酸铵,拌匀后,轻拍土壤,上盖薄膜保湿,培养5d。刮去离地面5cm表土层,翻倒土壤,深度为5cm,边长为15cm,面积为225cm2,拌入50g可溶性淀粉、10g硝酸钾,拌匀后,轻拍土壤,培养5d。
2.2.2 平板初筛菌种
取1g土壤,稀释106倍,分别取103~106稀释液涂平板,37℃培养48h,接着用0.1%稀碘液显色1~2min,挑选菌落水解圈直径与菌落直径比值大的单菌落挑至斜面上,对菌株进行编号。
2.2.3 液体培养基复筛测定淀粉酶活力
制备106个/mL孢子悬浮液,含40mL液体复筛培养基150mL三角瓶接种1mL菌悬液或孢子悬浮液,37℃培养48h,转速170r/min。以1mL滤液5min内水解淀粉生成1μmol还原糖量定义为1个活力单位(U),3,5-二硝基水杨酸法测定还原糖含量,挑选产酶活力最大值的菌株为目的菌株。
2.3 菌株鉴定
2.3.1 菌株形态观察
在平板初筛培养基平板上观察霉菌的菌落形态,利用水浸片法在高倍镜下观察菌丝体、孢子器及孢子形态。
2.3.2 18SrDNA鉴定菌种
(1)PCR反应扩增18SrDNA。基因组DNA的提取采用改进的CTAB法[3],18SrDNA序列扩增采用18SrNDA通用引物,PCR产物经琼脂糖凝胶电泳(电泳强度为5V/cm)检测后,利用胶回收试剂盒回收PCR产物,交于测序公司测定序列。
(2)18SrDNA序列分析。序列同源性用NCBI数据库中的BLAST工具进行比较,并利用DNAS-tar软件绘制进化树。
2.3.3 菌株的诱变处理,提高菌株产酶活力
(1)紫外诱变。取1mL106个/mL的孢子悬浮液于平皿中,采用20W紫外灯,照射距离为30cm,时间分别为5、8、10、15min,取1 02、103、104倍稀释液各0.1mL涂布平板,35℃暗室培养至出现单菌落。挑选出挑选单菌落周围溶圈与单菌落直径比值大的菌株挑至斜面上,确定初筛菌株后再通过摇瓶发酵进行复筛。
(2)化学诱变。取1mL 106个/mL的孢子悬浮液于平皿中,加入一定浓度的亚硝酸钠1mL,28℃水浴反应5min,加2mL pH值为4.5的醋酸缓冲液,分 别 反 应 5、8、10、20min,加 浓 度 0.7mol/L Na2HPO42mL终止反应,按一定比例稀释,取0.1mL涂布平板,35℃培养至出现单菌落,酶活鉴定同紫外诱变。
(3)复合诱变。紫外诱变后,挑选的菌株进行NaNO2诱变。NaNO2诱变后,挑选的菌株进行紫外诱变。
(4)验证有无组成型突变菌株。制备菌悬液或孢子悬浮液,稀释涂平板,在菌落上滴加0.1%稀碘液显色1~2min,观菌周围是否有淀粉水解圈。
3 结果与分析
3.1 产淀粉酶高产菌株的分离
不做任何处理的土壤稀释液涂平板,分离得到3株产酶活力较大的细菌菌株,水解圈直径与菌落直径比值分别为2.650、2.867、3.324;拌入50g可溶性淀粉土壤稀释液涂平板,分离得到两株产酶活力较大的细菌菌株,水解圈直径与菌落直径比值分别为2.983、4.053;拌入50g可溶性淀粉、10g蛋白胨稀释液涂平板,分离得到3株产酶活力较大的细菌菌株和2株产酶活力较大的真菌菌株,水解圈直径与菌落直径比值分别为5.025、3.895、4.243、4.356、3.112;拌入50g可溶性淀粉、10g硫酸铵土壤稀释液涂平板,分离得到4株产酶活力较大的细菌菌株,水解圈直径与菌落直径比值分别为4.449、4.500、4.356、4.264;拌入50g可溶性淀粉、10g硝酸钾土壤稀释液涂平板,分离得到3株产酶活力较大的细菌菌株,水解圈直径与菌落直径比值分别为4.250、5.011、4.800。对分离得到菌株依次编号为:ba-1、ba-2、ba-3、ba-4、ba-5、ba-6、ba-7、ba-8、fu-1、fu-2、ba-9、ba-10、ba-11、ba-12、ba-13、ba-14、ba-15,菌株ba-6平板培养,水解圈直径与菌落直径比值最大,为5.025。分离得到17个菌株中,15个细菌菌株,2个霉菌菌株,未见放线菌菌株,与土壤中微生物数目培养时间、培养条件有关,土壤中细菌数目最多,其次为霉菌孢子数,细菌形成菌落一般为1~2d,霉菌3~4d,放线菌6~7d。土壤用可溶性淀粉富集培养后,筛选得到的产淀粉酶菌株产酶活力高,说明富集培养有利于高产菌株筛选。细菌菌株平板培养,以ba-5酶活力最高,水解圈直径与菌落直径比值为5.025,ba-1产酶活力最低为2.650,真菌中fu-1酶活力最高为4.356。
从液体培养基复筛测定淀粉酶活力的结果可以看出,菌株平板培养、液体培养产酶活力不一致,微生物平板培养、液体培养,菌体的生长扩散速度及养分和氧气的供应等都有差异,造成产酶能力变化不一致,以1mL滤液5min内水解淀粉生成1μmol还原糖量定义为1个活力单位(U),液体培养,菌株ba-3滤液酶活力最低,为14.8U/mL。菌株fu-1滤液酶活力最高,为36.9U/mL,选择菌株fu-1为出发菌株。
3.2 菌株鉴定
3.2.1 菌株fu-1形态特征
菌落初为白色,后变成黑色厚绒状。分生孢子梗顶部形成球形顶囊,顶囊球形,其上全面覆盖一层梗基和一层小梗,小梗上长有成串褐黑色的球状分生孢子,分生孢子褐色球形。有时在新分离的菌株中能找到白色、圆形、直径约1mm的菌核(图1、图2)。
图1 菌株菌丝体形态

图2 菌株顶囊、分生孢子形态
3.2.2 菌株fu-1鉴定
(1)18SrDNA序列分析。基因组提取及PCR扩增,提取分离菌株fu1的基因组,用真核生物通用引物SPF1、SPR1扩增基因组DNA,结果显示:分离菌株fu1 18SrDNA PCR产物大小约为1 700bp。
(2)18SrDNA基因序列,获得分离菌株的18S rDNA的PCR产物后,交于南京金斯特生物科技有限公司测序。
(3)分离菌株fu-1SrDNA基因序列系统进化分析,获得fu-1SrDNA基因序列后,提交NCBI进行BLAST分析,NCBI登录号为lcl|15007,同时用DNAStar软件绘制系统进化树(图3),比对结果显示fu1SrDNA基因序列与Aspergillus niger strain Ym33182相似性达到99%,结合形态特征,可以认为分离菌株为黑曲霉(Aspergillus niger)。将分离分离菌株fu-1命名为黑曲霉An。
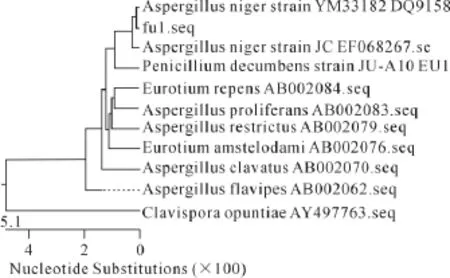
图3 分离菌株fu-1 18SrDNA基因序列与已知相关序列的聚类进化树
3.3 诱变处理,提高菌株产酶活力
3.3.1 紫外线诱变
以黑曲霉菌株An为出发菌株,诱变处理5min,诱变后的菌株中共有7株水解圈/菌株直径比值 大 于 4.356,分 别 为 4.563、4.782 、4.877、4.471、4.688、4.874、4.844,诱变处理8min,诱变后的菌株中共有4株水解圈/菌落直径比值大于4.356,分别为5.174、4.812、4.381、4.688,诱变处理10min,诱变后的菌株中共有2株水解圈/菌落直径比值大于4.356,分别为4.542、4.733,诱变处理15min,诱变后的菌株中仅有1株水解圈/菌落直径比值大于4.356,为4.755,上述菌株依次编号为An-1u至An-14u。紫外线诱变结果显示,绝大多数突变为负变,仅得到14个水解圈/菌落直径比值大于原菌株的突变株,诱变处理5min效果较好,正变菌株数目最多,有7株,诱变处理8min,水解圈/菌落直径比值5.174的菌株为正变幅度最大的菌株。
原始菌株为36.9U/mL,诱变所分的菌株An-1u至An-14u液体培养产酶活力分别为;39.1、30.5、26.1、32.1、45.6、45.4 、41.0 、51.2 、31.5 、45.2、31.6、26.8、35.3、38.2U/mL,仅有7个菌株液体培养的滤液酶活力大于原始菌株,与水解圈/菌落直径比值的结果不一致,是由于液体、固体培养条件不一致。液体培养产酶活力最大的菌株为An-8u,其滤液酶活力为51.2U/mL。
3.3.2 NaNO2诱变
以黑曲霉菌株An为出发菌株,分别用0.02、0.05、0.1mol/lHNO2处理孢子悬浮液5min、8min、10min、20min。
0.02mol/L NaNO2处理孢子悬浮液5min、分离到水解圈/菌落直径比值分别为5.467、4.706、5.538、5.810、5.440的菌株;处理8min,分离到水解圈/菌落直径比值分别为5.086、5.273的菌株;处理10min,分离到水解圈/菌落直径比值分别为6.325、4.043的菌株;处理20min,分离到水解圈/菌落直径比值为4.543的菌株;共计10个菌株,依次编号为An-1c至An-10c。
0.05mol/L HNO2处理孢子悬浮液5min,分离到水解圈/菌落直径比值分别为 4.808、4.719、4.888的菌株;处理8min,未分离到水解圈/菌落直径比值大的菌株,可能是分离的平板数目不足够多的原因;处理10min,分离到水解圈/菌落直径比值分别为4.727、5.168、4.741的菌株,处理20min,分离到水解圈/菌落直径比值为4.855的菌株,共计7个菌株,依次编号为An-11c至An-17c。
0.1mol/l NaNO2处理孢子悬浮液,仅在处理8min的孢子悬浮液中,分离到水解圈/菌落直径比值分别为4.717、4.509的菌株依次编号为 An-18c、An-19c。
以上结果显示低浓度NaNO2处理、且处理时间短,平板分离的正突变株数目多,高浓度NaNO2处理或处理时间长,平板分离的正突变株数目少,可能因高浓度处理或长时间处理造成孢子死亡率增加有关。
菌株An-1c至An-19c液体培养,滤液酶活力分别为52.1、39.9、26.3、33.6、42.0、35.8、57.6、38.9、33.4、34.6、41.2、43.7、43.2 、43.9、40.9、45.0、50.7、48.2、42.0U/mL,出发菌株黑曲霉菌An液体培养,酶活力为36.9U/mL,19个突变株中有14个菌株为正突变。突变株An-7c突变率最大,其滤液酶活力为57.6U/mL。
3.3.3 复合诱变
诱变剂的复合处理常常呈现一定的协同效应,NaNO2诱变后采用紫外诱变,紫外诱变后采用NaNO2诱变。
以菌株 An-8u为出发菌株,0.02mol/lNaNO2处理孢子悬浮液,处理5min,分离得到水解圈与菌落直 径 比 值 分 别 为 5.261、5.727 突 变 株,处 理8min,分离得到水解圈与菌落直径比值分别为5.307突变株,处理10min,分离得到水解圈与菌落直径比值分别为5.531、6.242突变株,依次编号为An-8u-1c、An-8u-2c、An-8u-3c、An-8u-4c、An-8u-5c。
以菌株An-7c为出发菌株,紫外诱变处理5min,分离得到水解圈与菌落直径比值分别为5.456、6.313、5.767突变株,紫外诱变处理8min,分离得到水解圈与菌落直径比值为5.403突变株,紫外诱变处理8min,分离得到水解圈与菌落直径比值为5.984突变株,依次编号为An-7c-1u、An-7c-2u、An-7c-3u、An-7c-4u、An-7c-5u。
验证有无组成型突变菌株培养基配方:胰化蛋白胨1%,酵母浸膏0.5%,NaCl 0.5%,可溶性淀粉2%,葡萄糖2%,琼脂2%,pH7.0。制备An-8u-1c、An-8u-2c、An-8u-3c、An-8u-4c、An-8u-5c、An-7c-1u、An-7c-2u、An-7c-3u、An-7c-4u、An-7c-5u孢子悬浮液,涂布到验证有无组成型突变菌株培养基的平板上,在菌落上滴加0.1%稀碘液显色1-2min,菌落周围没有水解圈,说明分离到上述突变菌株中没有组成型突变,葡萄糖抑制了淀粉对淀粉酶的诱导作用,因而菌落周围没有水解圈。
An-8u-1c、An-8u-2c、An-8u-3c、An-8u-4c、An-8u-5c、An-7c-1u、An-7c-2u、An-7c-3u、An-7c-4u、An-7c-5u液体培养,滤液酶活力分别为61.0、73.6、72.3、76.1、81.8、77.2、93.4、80.6、89.3、77.6U/mL,菌株 An-7c-2u滤液酶活力最高,确定为目的菌株。
4 结语
本实验从土壤中筛选分离17个菌株,以液体产酶活力最高的菌株fu1,作为出发菌株。通过18S rDNA PCR扩增测序,结合形态学观察,鉴定该菌株为黑曲霉。通过紫外诱变、化学诱变及复合诱变的方法,最终筛选到具有更高产淀粉酶能力的菌株An-7c-2,其酶活提高到了出发菌株的253.11%。
前人对产淀粉菌株分离筛选及如何提高其产酶能力已经有一定的研究:赵铭钦等对α-淀粉酶和菌株的诱变,其α-淀粉酶为出发菌株的1.964倍[4];陈远钊等以从醋醅中筛选出产α-淀粉酶的酵母菌为出发菌进行N+离子注入诱变,使产物酶活提高了219%[5];余诗庆等以一株产耐高温α-淀粉酶菌株(地衣芽孢杆菌)为出发菌株,原生质体制备后经NTG(亚硝基胍)药物诱变,最终筛选到具有高产淀粉酶能力的菌株[6]。从这些研究中我们可以看到,高产淀粉酶分离筛选主要取决于两方面:筛选地的选择、诱变方法。筛选地的选择因人而已,燕卫东从贫瘠土壤中筛选淀粉酶生产菌株[7],陈远钊等以从醋醅中筛选产α-淀粉酶的酵母菌[5],王晓红等从海洋沉积样品及鱼肠道中筛选出产淀粉酶的酵母菌菌株[8];目前常用的诱导方法有物理诱变、化学诱变及复合诱变,陈远钊等以N+离子注入诱变从醋醅中筛选出的产α-淀粉酶酵母菌[5],郭宏文等进行了紫外线和硫酸二乙酯复合诱变处理。筛选得到1株高产异淀粉酶的菌株[9]。由于筛选地选择的随机性以及基因突变的不确定性,因此能够投入工业生产的高产淀粉酶菌株的筛选及选育需要较大的精力、物力投入。
由于时间关系,本研究未对发酵条件进行优化,未来需要通过单因子实验及正交试验对pH值、碳源、氮源等发酵条件进行优化,已期获得适合产业化生产的最佳发酵条件。
[1]张树政.酶工业制剂(下册)[M].北京:科学出版社,1998.
[2]孙晓菲,李爱江.α-淀粉酶的应用及研究现状[J].畜牧兽医科技信息,2008(6):13~14.
[3]周延清.DNA分子标记技术在植物研究中的应用[M].北京:化学工业出版社,2005.
[4]赵铭钦,李晓强,王豹祥,等.α-淀粉酶和蛋白酶高产菌株的诱变选育[J].烟草科技,2008(8):53~57.
[5]陈远钊,罗俊成,胡 佳,等.酸性α-淀粉酶菌株的诱变及酶的性质研究[J].中国酿造,2007(3):10~13.
[6]余诗庆,王宇建.一种耐高温α-淀粉酶高产菌株的选育方法[J].淮阴工学院学报,2005(10):51~54.
[7]燕卫东.贫瘠土壤中淀粉酶产生菌株的筛选[J].中国酿造,2008(12):73~74.
[8]王晓红,池振明.产淀粉酶海洋酵母菌的筛选及鉴定[J].中国海洋大学学报,2007(12):95~100.
[9]郭宏文,冮 洁,田 明,等.酸性异淀粉酶产生菌的诱变育种[J].高师理科学刊,2007(3):54~56.
Isolation and Identification of Bacterial Strains Yielding Amylase in Soil and Improvement of Yielding Amylase Ability

