临床病例讨论(step by step)——自体干细胞移植后发热、呼吸困难
康 颖,段明辉,周道斌
(中国医学科学院北京协和医学院北京协和医院血液科,北京 100730)
患者女性,28岁,确诊非霍奇金淋巴瘤(弥漫大B细胞型Ⅳ期A IPI 2分)18月。已行10程化疗(R-CHOP×6次,R-CHO×1次,R-DICE×1次,R-MINE×2次),1程外周血造血干细胞动员,复查PET/CT提示病情复发,又予3程巩固化疗(R-ESHAP×2次,DICE×1次)后,拟行自体外周血造血干细胞移植(autologous peripheral blood stem cell transplantation,APBSCT)于2010-03-24 入院。
入院查体:T:36.7℃,P:80次/分,R:19次/分,BP:13.3/9.31 kPa,左侧腹股沟可触及一肿大淋巴结,直径约1 cm,质韧,无压痛,活动可。余浅表淋巴结未触及。双肺呼吸音清,未闻及干湿啰音。心律齐,未闻及杂音。腹软,肝脾肋下未触及,移动性浊音(-),双下肢不肿。
2010-03-31开始BEAM(卡莫司汀、依托泊苷、阿糖胞苷、马法兰)+美罗华方案预处理,常规预防感染。2010-04-06回输自体外周血干细胞,单个核细胞数 (mononuclear cells,MNC)2.31×108/kg,CD34+细胞2.89×106/kg。+3 d起中性粒细胞绝对 计 数 (absolute neutrophilcount,ANC) <0.5×109/L,开始给予头孢他啶2 g q12h静脉输注预防感染,同时给予粒细胞集落刺激因子(G-CSF)治疗。
+9 d时血 WBC 上升至0.25×109/L,ANC 0.15×109/L。+10 d时出现高热,Tmax 39.7℃,伴畏寒,无寒战,无咳嗽、咳痰。当天血 WBC 1.96 ×109/L,ANC 1.59 ×109/L。
+11 d时(2010-04-17)患者再次出现高热,Tmax 39.5℃,伴畏寒、寒战,轻微咳嗽,无痰,无呼吸困难。此时血WBC升至3.63×109/L。血气提示PO299 mmHg。床旁胸片:双肺纹理略厚,未见其他病变。
APBSCT后骨髓抑制期,感染是主要并发症,其主要原因是大剂量化、放疗所致的中性粒细胞严重缺乏。此外,预处理期间易并发的口腔黏膜破溃,以及深静脉插管等因素也是出现感染的常见原因。移植患者在骨髓抑制期出现发热,首先应考虑细菌感染,需要尽早使用广谱抗生素治疗,否则可引起严重败血症而危及生命。
患者虽然已过严重骨髓抑制期,粒细胞开始恢复,但仍处于粒细胞缺乏的易感阶段,此时出现高热,首先应考虑感染。美国感染性疾病学会(IDSA)2002的用药指南推荐,对于重症感染和高危患者,应首选高效的广谱抗菌药物,此患者应用头孢他啶预防已1周时间,突然出现高热,应考虑耐药细菌感染可能,例如超广谱β内酰胺酶阳性的革兰氏阴性菌,碳青霉烯类是此类细菌感染的首选经验性治疗药物,因此在抽血进行血培养后,更换抗生素为美罗培南1 g q8h,同时加用对症退热治疗。
应用美罗培南1 d后仍有高热,但抗生素疗效判断需要48~72 h,因此暂不更改。患者出现咳嗽,首先考虑肺部感染可能,但胸部X线检查未见明显异常。因不能排除深静脉导管感染,予拔除深静脉置管,导管尖端送病原学检查,因导管相关感染的病原通常为革兰阳性细菌,因此加用替考拉宁0.4 g q12h。由于患者坚持氟康唑预防,因此暂时不考虑真菌感染。另外患者造血功能已经重建,粒细胞缺乏期已过,仍出现高热,需警惕植入综合征(engraftment syndrome,ES)可能,因此在充分抗感染的前提下,予加用地塞米松5 mg bid。
此后每日仍然发热,之前伴有畏寒,体温均在上午迅速升高,需要给予解热镇痛药,至凌晨体温才能逐步降至正常。+13 d时体温高峰达40.3℃,伴畏寒、寒战及干咳。血常规:WBC 11.59×109/L;(图1)血 ALT 282 U/L,Alb 35 g/L,GGT 325 U/L,ALP 152 U/L, AST 182 U/L, LDH 315 U/L, Cr 49 μmol/L。
因为替考拉宁和美罗培南应用时间已经超过48h,故改用哌拉西林/他唑巴坦治疗。之前所用广谱抗生素已覆盖革兰氏阳、阴性菌,且粒细胞计数完全恢复正常,体温不降反升,不能排除真菌感染,加用两性霉素B治疗,并完善相关检查。因一直坚持阿昔洛韦抗病毒预防,故暂不考虑病毒感染,先查巨细胞病毒(cytomegalovirus,CMV)指标。虽系淋巴瘤复发患者,但因为刚刚进行过强化疗,故原发病进展可能性不大。干细胞植入的早期阶段(图1),出现高热且常规抗生素治疗无效,肝酶指标异常,需要考虑ES可能,但按照标准尚不足以诊断,同时担心对抗感染不利,因此停用地塞米松。粒细胞已恢复正常,故停用G-CSF。
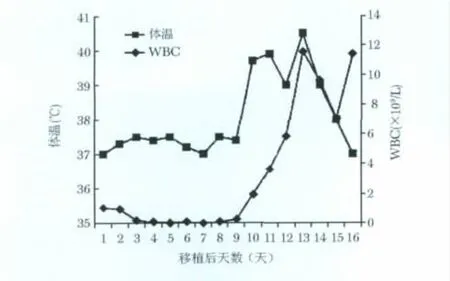
图1 移植后WBC变化趋势与体温之间的相关关系
+14 d(2010-04-20)上午体温正常。前期4次血培养结果回报均为阴性。深静脉导管尖培养阴性。前降钙素原(PCT):4.14 μg/L。G 试验:40.93 pg/mL。CMV-PP65阴性。血涂片见到异型淋巴细胞1%,未见肿瘤细胞。同日中午体温升至39.4℃,伴畏寒、寒战、剧烈干咳。予对症退热后大量出汗,体温降至37.5℃。04∶30PM外出检查后诉呼吸困难,脉搏增快达150次/分,血压降至68/39 mmHg,鼻导管吸氧8 L/min时指测氧饱和度86%。更换储氧面罩吸氧,并快速补液及应用血管活性药物。
07:00PM复测体温36.3℃,心率160次/分,血压97/48 mmHg,氧饱和度80%,患者谵妄、烦躁不安,立即予气管插管、呼吸机辅助呼吸,其间发现气管内分泌物较少,未吸出血性分泌物。呼吸机采用容量控制模式,PEEP为10 cm H2O,供氧浓度100%,血气提示PO270 mmHg。床旁X线和胸部高分辨CT(High Resolution CT,HRCT)结果显示病变明显(图 2,3)。
09∶30PM复查心率 170 次/分,血压 106/65 mmHg,PEEP 12 cm H2O,氧浓度 95%,PaO278 mmHg,血清Alb 13 g/L。经过快速输注血浆、白蛋白及红细胞,心率渐降至120次/分,血压维持在120/80 mmHg左右,每小时尿量约100~150 mL,血压>90/70 mmHg,指氧>97%(呼吸机条件逐渐下降,PEEP 10 cm H2O,吸氧浓度50%)。此时查体双肺未闻及明显干湿啰音,腹软,移动性浊音(+),全身显著水肿。最终统计24 h入量10 369 mL,出量2 320 mL。
突然发生呼吸困难,血气及胸片提示符合急性呼吸窘迫综合征 (acute respiratory distress syndrome,ARDS),同时血流动力学不稳定,出现休克迹象,这些表现真的是感染性休克合并ARDS吗?虽然PCT结果升高,但多次血培养及深静脉导管尖培养阴性,在粒细胞水平恢复正常的前提下,广谱抗生素治疗效果不佳,反而出现严重的肺部病变伴休克表现,这些现象无法单纯用细菌感染解释。G试验虽有轻度升高,但在坚持应用抗真菌预防,且更换两性霉素B以后,病情迅猛进展,也无法用真菌感染解释。
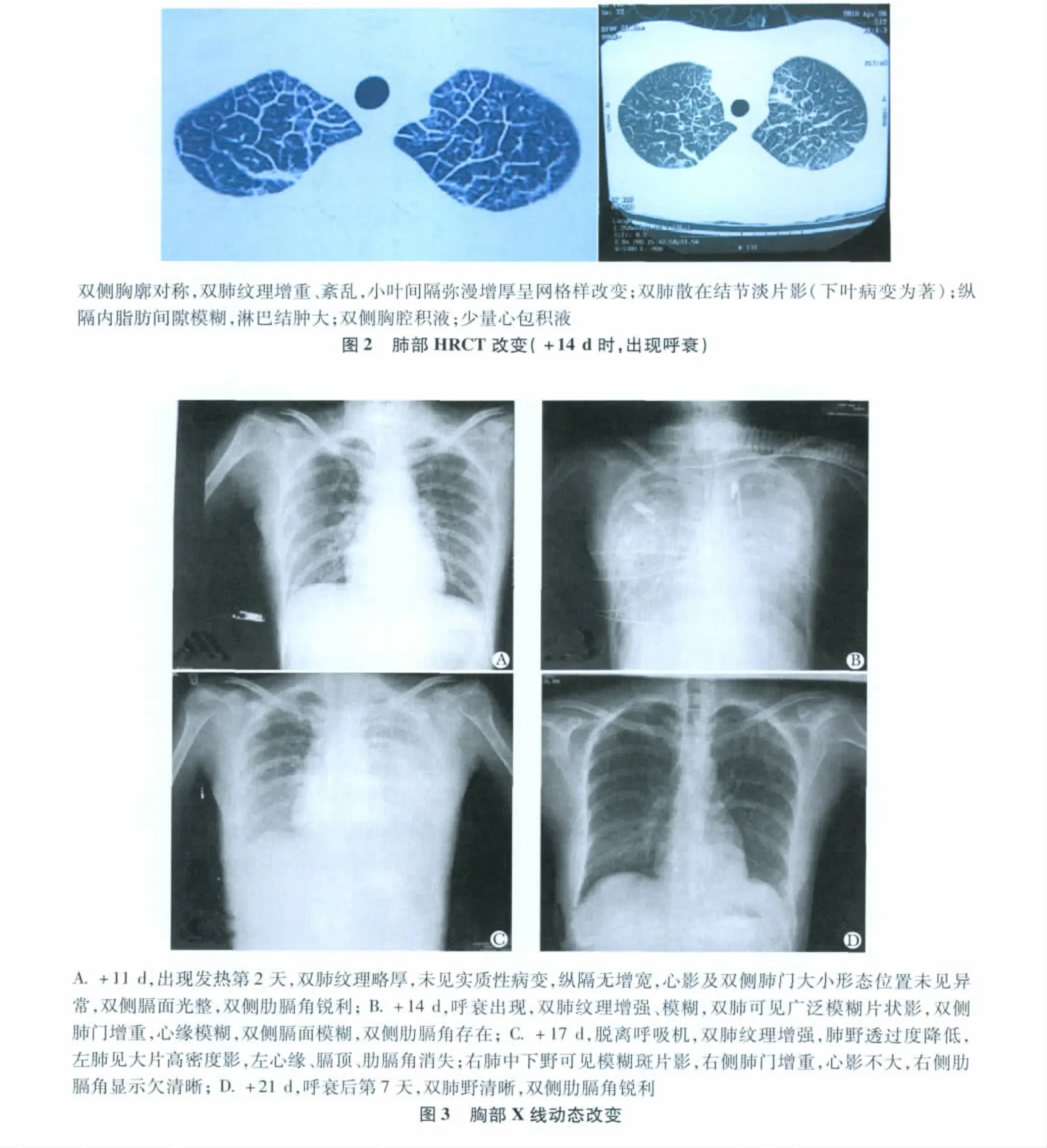
HRCT结果进一步证实,肺部出现迅速变化,严重的小叶间隔水肿可以解释临床上ARDS的表现,虽然这种病变本身不具有特异性,但是对ARDS的病因判断具有重要价值。首先,肺部变化过于迅速,小叶间隔增厚,这些均非肺部感染常见表现,结合患者粒细胞恢复,多次血和导管尖端培养阴性,广谱抗生素和抗真菌治疗无效,因此考虑常见细菌、真菌感染可能性不大。患者为恶性淋巴瘤,曾经采用多程化疗和抗CD20单克隆抗体靶向治疗,可能存在免疫功能抑制,需要考虑卡氏肺孢子菌感染(PCP肺炎)可能,但因为坚持复方磺胺甲口恶唑预防,且HRCT显示与PCP肺炎不符,因此可能性也不大。CMV病毒感染在自体移植患者中少见,肺部改变不支持,CMV-PP65阴性,故也可排除。因此,非感染因素可能是引起肺部改变的原因。
在非感染性肺部病变中,首先需要考虑NHL累及肺,但患者刚刚经历一次高剂量化疗,且肺部病变弥散而非肿块表现,故此可能性不大。其次需要考虑药物性肺炎,临床上表现为使用某药治疗过程中出现发热、咳嗽、呼吸困难等症状,X线胸片示弥漫性的颗粒状、斑片状、网状阴影。本病的CT表现顺序为:1)最早为磨玻璃样改变。2)分布于肺叶中央的粗糙不均匀的线样阴影。3)随后则为胸膜下较大的融合趋势的阴影,并可观察到肺泡和间质性浸润。4)药物用量少的轻症病变范围小,病灶完全可吸收,严重者表现为局限性磨玻璃样和线样阴影,沿支气管和中心支气管血管束(肺纹理)分布[1]。本例近期未新加用药物,且CT表现不符合,考虑可能性不大。第三,医源性心源性水肿也需要排除,本例症状加重前没有大量输液,反而有大量出汗史,而且肺HRCT表现不符合心源性肺水肿。第四,弥漫性肺泡出血(diffuse alveolar hemorrhage,DAH)也是HSCT后常见的肺部并发症,一般发生于HSCT后的30天内。临床主要表现为呼吸困难(92%)、发热(67%)、干咳(56%)及咯血(15%)等非特异性症状[2]。DAH的重要特征是血性支气管肺泡灌洗液,其病因及病理生理机制不清,但因为常见于异基因移植后,估计与移植物抗宿主病(graft vesus host disease,GVHD有一定关系,自体移植者发生者较少,本例患者的临床表现和肺HRCT均不支持DAH。最后,在自体移植造血恢复期出现发热、一过性脑病和肺部浸润,ES应该首先考虑,HRCT结果提示肺部小叶间隔明显增厚水肿,符合ES的肺部表现。血清白蛋白在1 d之内由35 g/L迅速降至13 g/L,合并严重的低钠血症,结合其肺部浸润、多浆膜腔积液表现,考虑毛细血管渗漏综合征(capillary leak syndrome,CLS)诊断成立,而CLS出现在自体HSCT后造血恢复阶段,且之前伴有严重高热,这些表现均支持ES的诊断。大量补液后心率反而下降,插管后气道分泌物少,进一步证实心源性肺水肿可能性不大。大量的液体潴留也是ES的重要表现,由于毛细血管渗透性增加,体内的水分主要潴留在组织间隙和体腔,血管内容量明显不足,这可能是患者低血压的主要原因。
结合上述考虑,在保持哌拉西林/他唑巴坦、阿昔洛韦、复方磺胺甲口恶唑联合抗感染治疗的同时,予甲强龙80 mg qd静点。
+15 d时(2010-04-21)患者转入ICU,当日最高体温37.7℃,监测中心静脉压波动在12~16 cm H2O。继续应用皮质激素、抗感染,并补充胶体液和利尿治疗。
+16 d时(2010-04-22)行右侧胸腔穿刺引流900 mL,胸水为黄色微混,细胞总数390×106/L,白细胞总数100×106/L,单核细胞 90%,多核细胞10%,黎氏试验(+),比重 1.024;胸水总蛋白36 g/L,胸腔引流液培养阴性。气管镜灌洗液涂片阴性,培养阴性,多次血培养、痰培养阴性,痰六胺银染色阴性。当天患者呼吸状况好转,顺利脱离呼吸机并拔除气管插管。此后症状迅速缓解,胸部X线病变迅速好转(图3),患者顺利痊愈出院。
在呼吸机支持下,经激素及抗生素等治疗后患者体温正常,呼吸状况迅速好转,气管插管时间小于36 h,肺部病变在1周之内戏剧性好转,体液潴留迅速消失,治疗效果进一步印证植入综合征的诊断。在大量输液后,中心静脉压基本在正常值上限,也进一步排除了心源性肺水肿的可能。血、痰、胸腔积液、气管灌洗液等多方寻找病原学均回报阴性,基本可以排除感染可能,因此,回顾该患者移植后发生的一系列症状,包括发热、血容量下降、体液潴留、肺部病变,均可以用ES圆满解释,针对性治疗后病情的迅速好转进一步印证了该诊断。
造血干细胞移植过程中,30% ~60%的患者会出现肺部并发症,其中61%因此死亡[3]。近年来研究发现,非感染性肺部并发症的发生率比感染性更多见[3],ES即为常见类型之一。该综合征为 CLS的一种,病死率14% ~60%[4]。1994年由 Radford等首先提出,主要发生HSCT后粒细胞恢复早期,表现为非感染性发热、皮肤红斑、皮疹、非心源性肺水肿、多器官功能衰竭,自体移植后发生率7% ~55%[5]。ES的肺部表现又被称为植入呼吸窘迫综合征(peri-engraftment respiratory distress syndrome,PERDS),发病中位时间为+11 d。ES发病机制复杂且不完全清楚,推测其主要病理生理过程如下:移植后高细胞因子血症及预处理造成血管内皮细胞损伤,最终导致毛细血管渗漏现象。ES诊断的主要标准为:1)体温≥38.3℃,无明确感染;2)非药物性皮肤红斑性皮疹,皮疹超过25%体表面积;3)非心源性肺水肿,弥漫性肺部浸润及低氧血症。次要标准:1)肝功能异常(总胆红素≥20 mg/L或天冬氨酸转移酶≥2倍正常值);2)肾功能不全(血肌酐≥2倍基础水平);3)体重增加≥2.5%基础体重;4)不能用其他原因解释的一过性脑病[5]。前提是发生在ANC植入后96 h以内,符合3项主要标准或2项主要加1项次要标准即可确诊。实际工作中,由于ES临床特征复杂多变,上述诊断标准并未获得公认。一般根据出现症状的时间,结合非心源性血压下降、全身水肿、体腔积液、低氧血症、影像学肺间质渗出性改变等可以作出诊断。但在ES出现的早期往往不能确诊,只能兼顾多方面进行治疗,多数患者需要根据治疗效果和疾病的戏剧性变化回顾性获得确诊。
一些研究提出ES的危险因素,PBSCT多于骨髓移植[5],女性实体瘤如乳腺癌移植者多见[6],移植后使用大剂量G-CSF也是危险因素之一[7],使用两性霉素B可增加ES发生率[8],POEMS综合征患者移植期间ES发生率也明显增高[9]。ES根据病情轻重进行治疗,轻者(一过性低热及局部皮疹)无需治疗,密切观察、去除诱因、对症处理即可;若病情严重,尤其累及肺部,发生PERDS时,肾上腺皮质激素疗效确凿[5,10],且应用越早疗效越好。除药物治疗外,支持治疗同样重要,包括预防各种感染、注意血容量、慎用袢利尿剂,必要时需机械通气。小结:
ES系造血干细胞移植过程中严重并发症,早期因为对此认识不足,死亡率一度高达60%,多数患者死于ARDS和多器官功能不全综合征(multiple organ dysfunction syndrome,MODS),机械通气和转入ICU的比例也显著增高。随着对本病认识的深入,早期合理应用皮质激素可明显改善患者预后。因此,提高在移植过程中对ES的警惕以便做出早期诊断,能够及早给予有效治疗,显著降低机械通气的要求和MODS进展,从而降低移植相关死亡率。
[1]Gyorgy B,Satoshi N,Arfa K,et al.Bleomycin-induced fibrosis in pigs:evaluation with CT[J].Radiology,1994,191:269-272.
[2]Afessa B,Tefferi A,Litzow MR,et al.Outcome of diffuse alveolar hemorrhage in hematopoietic stem cell transplant recipients[J].Am J Respir Crit Care Med,2002,166:1364-1368.
[3]Afessa B,Peters SG.Noninfectious pneumonitis after blood and marrow transplant[J].Curr Opin Oncol,2008,20:227-233.
[4]Nurnberger W,Willers R,Burdach S,et al.Risk factors for capillary leakage syndrome after bone marrow transplantation[J].Ann Hematol 1997,74:221 -224.
[5]Spitzer TR.Engraftment syndrome following hematopoietic stem cell transplantation[J].Bone Marrow Transplant,2001,27:893 -898.
[6]Edenfield W,Moores LK,Goodwin G,et al.An engraftment syndrome in auto logous stem cell transplantation related to mononuclear cell dose[J].Bone Marrow Transplant,2000,25:405-409.
[7]Madero L,Vicent MG,Sevilla J,et al.Engraftment syndrome in children undergoing autologous peripheral blood progenitor celltransplantation[J].Bone Marrow Transplant,2002,30:355-358.
[8]Cahill R,Spitaer TR,M azumder A.Marrow engraftment and clinical manifestations of capillary leak syndrome[J].Bone Marrow Transplant,1996,18:177 - 184.
[9]Dispenzieri A,Lacy MQ,Hayman SR,et al.Peripheral blood stem cell transplant for POEMS syndrome isassociated with high rates of engraftment syndrome[J].Eur J Haematol.2008,80:397 -406.
[10]Mossad S,Kalaycio M,Sobecks R,et al.Steroids prevent engraftment syndrome after autologous hematopoietic stem cell transplantation without increasing the risk of infection[J].Bone Marrow Transplant,2005,35:375 -381.

