神经肽类似物DOTA-Substance P的177Lu标记及其生物分布
梁积新,李洪玉,向学琴,罗洪义,胡连生,邓新荣,陈 阳,庄 玲,罗志福
(1.中国原子能科学研究院 同位素研究所,北京 102413;2.原子高科股份有限公司,北京 102413;3.核工业北京401医院 核医学科,北京 102413)
Substance P(P物质,以下简称SP)是一种含有11个氨基酸的神经肽,其氨基酸序列为:Arg-Pro-Lys-Pro-Gln-Gln-Phe-Phe-Gly-Leu-Met-NH2。SP主要分布于中枢神经系统和消化道内,心血管中亦有广泛分布。当神经受刺激后,SP可在中枢端和外周端末梢释放,与神经激肽-1(NK-1)受体结合发挥生理作用。它对多种生理活动有促进作用,除作为神经递质、神经调节和内分泌或旁分泌因子起作用外,还可能参与其他生理过程[1]。
177Lu是一种核性质较为理想,可用于肿瘤放射性治疗的放射性核素。177Lu的半衰期为6.7d,发射的β-粒子的平均能量为133keV,在组织中平均射程为670μm,适合杀死肿瘤组织,除β-射线外,还发射能量为113keV和208keV的γ射线,可用于显像监测和指导治疗过程,起到“一药两用”的作用[2-3]。
胰腺癌属于神经内分泌瘤,是致死率高的一类肿瘤,其五年存活期仅为3%~5%。石欣等[4]研究发现,胰腺癌组织中NK-1受体蛋白有过度表达。利用SP与NK-1的亲和性,将放射性核素引入SP分子中,利用SPECT技术可以对胰腺肿瘤进行显像,获取肿瘤定位、大小等信息,对肿瘤治疗方案的制定提供参考[5]。
Pujatti等[6]对177Lu-DOTA-SP 在 胰 腺 癌AR42J模型裸鼠中的生物行为进行了初探,发现该药物在AR42J胰腺癌细胞中有一定的摄取。
本研究旨在建立177Lu标记神经肽类似物DOTA-SP的方法以及177Lu-DOTA-SP的质控分析方法,并进行标记物在正常小鼠与PANC-1模型裸鼠体内的生物学行为研究,探讨177Lu-DOTA-SP用于人胰腺癌PANC-1的肿瘤显像及放射性治疗的可能性。
1 实验材料
1.1 实验试剂与仪器
DOTA-SP:IAEA 提供,纯度大于95%;177LuCl3溶液:以富集176Lu2O3(丰度为82.8%)为靶材,在中国原子能科学研究院49-2反应堆内辐照,经化学处理后得到,放射性比活度88.8~111.0TBq/g(2.4~3.0Ci/mg);乙腈:色谱纯,比利时Acros公司产品;三氟乙酸(TFA):生化级,比利时Acros公司产品;ITLCSG:Gelman Sciences公司产品。其他试剂均为国产分析纯,实验用水为MilliQ水。
HPLC系统:美国Varian公司;HPLC放射性检测器:德国Raytest公司;BS124S电子天平:德国Sartorius公司;N2-522E.CAM 双探头SPECT:德国西门子公司;FH463A自动定标器、FT-603 型闪烁探头:北京核仪器厂;CRC15R放射性活度计:美国Capintec公司;Mili-Q超纯水系统:美国Millipore公司。
1.2 实验动物
昆明种小白鼠:雌性,28只,20±2g,清洁级,购于中国医学科学院实验动物研究所。
PANC-1人胰腺癌裸鼠:12只,购于协和医科大学动物中心。采用瘤块接种方式,将PANC-1人胰腺癌肿瘤组织移植到Balb/c-nu裸鼠的右前腿皮下,将种植了肿瘤的裸鼠正常饲养两周,肿瘤直径长至约1cm时用于模型裸鼠的体内分布和SPECT显像实验。
2 实验方法
2.1 DOTA-SP的177Lu标记
取0.1mL DOTA-SP水溶液 (含 DOTASP 20~30μg)加入干净Eppendorf管中,再加入0.1mL 0.4mol/L醋酸钠-龙胆酸缓冲溶液和0.1mL177LuCl3溶液(放射性活度约为185MBq)。用1mol/L NaOH 溶液调 pH 约4.5,摇匀,于90℃下反应30min。
2.2 177Lu-DOTA-SP的质控分析
177Lu-DOTA-SP的标记率和放化纯度采用快速薄层层析法(ITLC)和高效液相分析法(HPLC)进行分析。ITLC的分析条件为:ITLC-SG为支持体,0.1mol/L柠檬酸钠溶液为展开剂。HPLC色谱条件为:C18色谱柱(Hypersil ODS2,φ4.6mm×250mm);紫外检测器,波长220nm;流速为1mL/min;溶剂 A为0.1%TFA的水溶液,溶剂B为0.1%TFA的乙腈溶液。采用梯度洗脱:0~3min 0%溶剂B,3~25min 0~90% 溶剂B,25~30min 90%溶剂B,30~35min 90%~0溶剂B。
2.3 标记物的纯化
采用Sep-Pak固相萃取法纯化标记产物:将反应液加载到分别用甲醇和水预活化过的C18 Sep-Pak柱上,先用10mL水将游离的177LuCl3洗脱,再用3~5mL甲醇将177Lu-DOTA-SP洗脱下来并收集,用N2吹干,用适量体积的生理盐水溶解,备用。
2.4 177Lu-DOTA-SP的体外稳定性研究
2.4.1 生理盐水中的稳定性 将2.3节所得177Lu-DOTA-SP的生理盐水溶液于室温下放置,并于不同时间间隔取样,用ITLC层析法和HPLC色谱法确定其放化纯度,分析条件与2.2节相同。
2.4.2 小牛血清中的稳定性 取0.1mL2.3节所得177Lu-DOTA-SP溶液,加入0.9mL 5%或10%小牛血清中,混匀,于37℃下温育。分别于30min,1、2、3、4h取0.1mL混合液,加0.1mL乙腈溶液,涡旋混匀,离心,取上清液,用ITLC层析法和HPLC色谱法确定其放化纯度,分析条件与2.2节相同。
2.5 177Lu-DOTA-SP 在正常小鼠体内的生物分布
取28只昆明种雌性小白鼠,随机分为7组,每组4只,经尾静脉注射0.1mL纯化后的177Lu-DOTA-SP(0.37MBq),分别于给药后15、30min,1、2、4、24、48h断头处死,取血、心、肝、脾、肾、肺、胃等脏器称重,并测定放射性计数,计算每克组织的放射性摄取率(%ID/g)。
2.6 177Lu-DOTA-SP在人胰腺癌 PANC-1模型裸鼠体内的生物分布及SPECT显像
PANC-1人胰腺癌模型裸鼠9只,随机分为3组,每组3只,经尾静脉注射0.1mL177Lu-DOTA-SP(0.26MBq)溶液,于给药后1、2、4h断头处死,取肿瘤、血、心、肝、脾、肾、肺、胃以及其他感兴趣脏器称重,测定放射性计数,计算每克组织的放射性摄取率(%ID/g)。
用于SPECT显像的模型动物裸鼠3只,每只 尾 静 脉 注 射 0.1mL177Lu-DOTA-SP(1.11MBq),分别在给药后30、60、90、120min进行显像。
显像时,177Lu能窗采用113keV,显像数据在计算机系统256×256矩阵中进行记录与分析。放大倍数为1,每只动物采集放射性计数为35 000。
3 实验结果与讨论
3.1 177Lu-DOTA-SP的制备
以DOTA为双功能螯合剂,实现了放射性治疗核素177Lu对神经肽类似物小分子肽SP的标记。在优化条件下(DOTA-SP用量为20~30μg,pH=4.5,90 ℃ 下反应30min),DOTA-SP的177Lu标记率>90%。SP为具有生物活性的小分子肽,其标记通常需要高比活度放射性核素[7],为了避免在标记过程带入其他金属的污染,在操作过程中,一定小心避免引入金属杂质。通常说来,DOTA是一种络合能力很强的双功能螯合剂。然而,标记率仅为90%,可能的原因是177Lu放射性比活度不够高,大量载体176Lu 与 DOTA-SP 竞 争 结 合,从 而 影 响DOTA-SP的177Lu标记率。
在上述ITLC 分析体系中,177Lu-DOTA-SP停留在原点,其Rf为0.0~0.1,177LuCl3则随溶剂移到前沿,其Rf为0.9~1.0。
177Lu-DOTA-SP的HPLC分析图谱示于图1。由图1可以看出,177Lu-DOTA-SP的保留时间为(17.6±0.1)min,而游离177LuCl3的保留时间为(4.6±0.1)min。
经 Sep-Pak 柱 固 相 萃 取 纯 化 后,177Lu-DOTA-SP的放化纯度>98%。
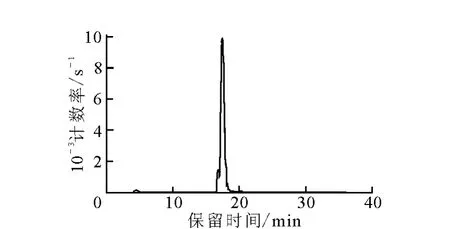
图1 177Lu-DOTA-SP的HPLC图谱
3.2 177Lu-DOTA-SP的体外稳定性
177Lu-DOTA-SP的体外稳定性分别示于图2和图3。图2结果显示,177Lu-DOTA-SP在生理盐水中有良好的稳定性,于室温下放置9d,标记物放化纯度仍大于95%。图3结果显示,177Lu-DOTA-SP在5%小牛血清中有较好的稳定性,温育2h后,其放化纯度仍尚大于95%,温育4h后,下降到92.3%;177Lu-DOTA-SP与浓度较高的血清(10%)竞争反应时,其降解稍快,温育4h后,放化纯度下降到84.9%。
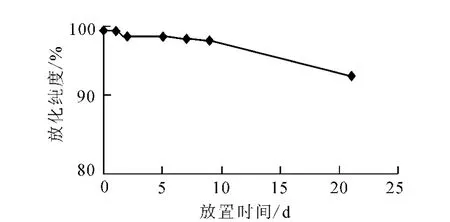
图2 177Lu-DOTA-SP在生理盐水中的稳定性
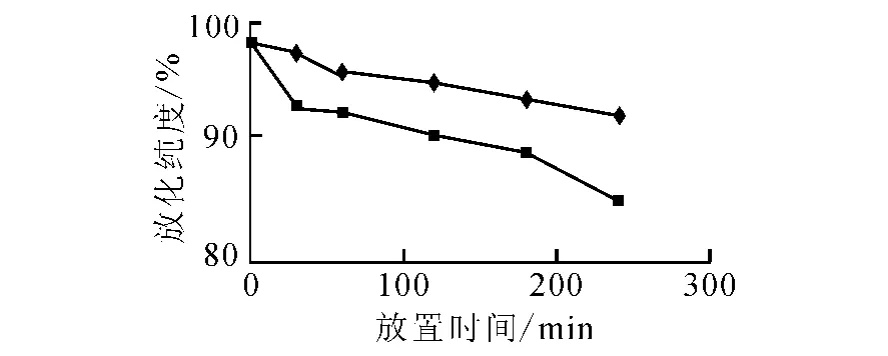
图3 177Lu-DOTA-SP在小牛血清中的稳定性◆——5%血清;■——10%血清
3.3 177Lu-DOTA-SP的体内生物分布
177Lu-DOTA-SP在正常小鼠体内的生物分布结果列于表1。由表1可知,177Lu-DOTA-SP在正常小鼠的体内生物分布呈以下特点:标记物血清除快,在给药15min时,血中放射性摄取为(4.63±0.80)%ID/g,而在给药2h时,降为(0.80±0.12)%ID/g;肾放射性摄取高,在给药2h后肾摄取达到峰值,为(37.24±3.73)%ID/g,且滞留时间长,给药48h后,仍高达(15.02±4.97)%ID/g,提示标记物在体内的代谢途径主要是肾脏。标记物在骨骼中有一定放射性摄取,且滞留时间长,这与游离177Lu的亲骨性有关。
表1 177Lu-DOTA-SP在正常小鼠体内的生物分布(±s,n=4)

表1 177Lu-DOTA-SP在正常小鼠体内的生物分布(±s,n=4)
组织或器官放射性摄取率/(%ID·g-1)15min 30min 1h 2h心2.14±0.29 1.78±0.38 1.08±0.05 0.97±0.09肝 2.20±0.13 3.02±0.42 2.99±0.12 2.99±0.47脾 1.64±0.15 2.72±0.63 2.09±0.25 2.45±0.94肺 3.69±0.97 3.51±0.50 2.11±0.30 1.19±0.06肾 20.41±3.03 33.89±4.23 33.95±1.91 37.24±3.73血 4.63±0.80 3.71±0.85 1.39±0.21 0.80±0.12胰腺 1.93±0.31 1.91±0.81 1.11±0.07 0.72±0.08胃 2.64±0.52 2.84±0.84 1.88±0.18 1.36±0.26肠 4.08±0.70 3.34±1.48 2.44±0.93 1.80±0.18股骨 3.17±0.22 3.92±0.76 3.30±0.21 3.13±0.29肌肉 1.30±0.14 1.21±0.28 0.56±0.04 0.49±0.05组织或器官放射性摄取率/(%ID·g-1)4h 24h 48h心0.82±0.06 0.71±0.10 0.66±0.02肝 3.08±0.17 2.21±0.16 1.47±0.65脾 2.40±1.02 1.67±0.18 1.30±0.39肺 1.12±0.37 0.60±0.16 0.56±0.28肾 33.32±2.56 27.83±3.30 15.02±4.97血 0.51±0.05 0.20±0.02 0.18±0.06胰腺 0.79±0.10 0.59±0.05 0.58±0.07胃 1.09±0.18 0.81±0.04 0.70±0.13肠 1.83±0.57 1.34±0.18 0.82±0.39股骨 3.19±0.41 3.08±0.38 2.65±0.54肌肉0.50±0.08 0.34±0.05 0.33±0.06
3.4 177Lu-DOTA-SP 在人胰腺癌 PANC-1模型裸鼠的体内分布
177Lu-DOTA-SP在人胰腺癌 PANC-1模型裸鼠体内的生物分布列于表2。
表2 177Lu-DOTA-SP在人胰腺癌PANC-1模型裸鼠体内的生物分布(±s,n=3)

表2 177Lu-DOTA-SP在人胰腺癌PANC-1模型裸鼠体内的生物分布(±s,n=3)
组织或器官放射性摄取率(%ID·g-1)1h 2h 4h心1.01±0.09 0.77±0.10 0.80±0.03肝 0.66±0.15 0.56±0.01 0.38±0.24脾 1.56±0.61 1.20±0.16 1.14±0.25肺 1.13±0.06 0.63±0.19 0.70±0.18肾 4.89±1.09 4.05±0.15 3.07±1.97胰腺 0.80±0.06 0.58±0.03 0.78±0.21胃壁 1.96±0.09 1.25±0.24 1.03±0.34小肠 5.20±0.89 3.61±0.80 2.14±1.68肌肉 0.66±0.10 0.46±0.12 0.51±0.11股骨 2.18±0.44 1.74±0.16 2.39±0.73血 0.67±0.16 0.28±0.06 0.27±0.11肿瘤3.34±1.67 1.76±0.36 1.35±0.63
由表2可知,给药1h时,177Lu-DOTA-SP在肿瘤中有相当高的放射性摄取,为(3.34±1.67)%ID/g,在给药后4h,肿瘤中仍有一定放射性摄取,为(1.35±0.63)%ID/g。人胰腺癌PANC-1中放射性摄取在给药后不同时间点均高于正常胰腺细胞中的放射性摄取,提示在PANC-1肿瘤细胞中存在NK-1受体。
177Lu-DOTA-SP在人胰腺癌模型裸鼠中的SPECT图像采集选取了4个不同时间点(0.5、1、1.5、2h)。其中0.5和1h时的SPECT图像示于图4。由图4可以看出,177Lu-DOTA-SP在PANC-1人胰腺癌中并没有明显浓集。可能的原因是,对于放射性金属核素标记的多肽类药物来说,放射性核素的比活度是影响药物体内代谢性质的重要因素[8]。由于本实验中用于177Lu-DOTA-SP制备的177Lu 的比活度不够 高,载体176Lu的大量存在影响到177Lu-DOTA-SP 的体内性质,从而也影响肿瘤对药物的摄取[7]。

图4 177Lu-DOTA-SP在PANC-1人胰腺癌模型裸鼠中的SPECT显像
4 结 论
采用177Lu标记神经肽类似物DOTA-SP的标记方法简单,标记物177Lu-DOTA-SP显示了良好的体外稳定性。177Lu-DOTA-SP 在血液中清除快;肾中放射性摄取高,提示标记物在体内的排泄途径主要是泌尿系统。体外稳定性和体内生物学分布特点显示了177Lu-DOTA-SP良好的 药 物 性 质。177Lu-DOTA-SP 在 人 胰 腺 癌PANC-1模型小鼠体内的生物分布结果显示,肿瘤对标记物有一定摄取,然而,SPECT显像结果显示,177Lu-DOTA-SP 在 PANC-1人胰腺癌肿瘤中无明 显 浓 集。177Lu-DOTA-SP 能 否 应 用于胰腺癌肿瘤显像与治疗尚需进一步研究。
致谢:对郑德强和孙桂全同志在实验中提供的帮助表示衷心感谢!
[1] Datar P,Srivastava S,Coutinho E,et al.Substance P:Structure,function and therapeutics[J].Current Topics in Medicinal Chemistry,2004,4:1 075-1 103.
[2] Dvorakova Z,Henkemann R,Lin X,et al.Production of177Lu at the new research reactor FRM-Ⅱ:Irradiation yield of176Lu(n,γ)177Lu[J].Ap-plied Radiation and Isotope,2008,66:147-151.
[3] Pillai MRA,Chakraborty S,Das T,et al.Production logistics of177Lu for radionuclide therapy[J].Applied Radiation and Isotopes,2003,59:109-118.
[4] 石欣,裴斐,高乃荣,等.P物质及其受体在胰腺癌细胞中的表达[J].中华实验外科杂志,2003,20:166-167.
[5] Breeman WAP,Hagen MP,Visser-Wisselaar HA,et al.In vitro and in vivo studies of substance P receptor expression in rats with the new analog[Indium-111-DTPA-Arg1]Substance P[J].The Journal of Nuclear Medicine,1996,37:108-117.
[6] Pujatti PB,Barrio O,Caldeira J,et al.Radiola-beling of substance P with177Lu and in vivo evaluation of tumor cell uptake in nude mice:Preliminary results[J].The Journal of Nuclear Medicine,2008,49(Suppl 1):437.
[7] Okarvi S.Peptide-based radiopharmaceuticals and cytotoxic conjugates:Potential tools against cancer[J].Cancer Treatment Reviews,2008,34:13-26.
[8] Breeman WAP,Jong M,Visser TJ,et al.Optimising conditions for radiolabeling of DOTA-peptides with90Y,111In and177Lu at high specific activities[J].European Journal of Nuclear Medicine and Molecular Imaging,2003,30:917-920.

