糖尿病神经病变在1型与2型糖尿病中有区别吗?
卡拉汉 等
2011年由美国疾病控制中心发布的糖尿病情况说明书(Diabetes Fact Sheet)证实了现在人尽皆知的事实:美国正在经历糖尿病大流行。两千五百万美国人,也就是超过8%的美国人口患有糖尿病,2010年新诊断的糖尿病人数达一百九十万。在这些患者中,5%为1型糖尿病(T1DM),一种高发于儿童及年轻成人、以胰岛β细胞自身免疫性破坏和胰岛素绝对缺乏为特征的糖尿病亚型。其余95%的患者都为2型糖尿病(T2DM)。T2DM是一种以高内源性胰岛素分泌为特征的代谢性疾病,发生在胰岛素抵抗的情况下,患者的肌肉、脂肪和肝脏细胞都对胰岛素不够敏感。在胰岛素抵抗的角度上,还有一类人呈现出糖耐量减低(IGT),这些人被称为处于糖尿病前期。IGT个体的血糖代谢异常,但还没有达到诊断糖尿病的程度。疾病控制中心估计,有七千九百万美国人有糖耐量受损。总而言之,超过一千万的美国人处于糖尿病前期或糖尿病,并且这个数字还在继续攀升,尤其是在少数民族。
本文总结了现有关于T1DM和T2DM血糖控制的干预试验,得出血糖情况对T1DM多发性神经病变的影响甚于T2DM。我们还发现,近期的数据表明,肥胖、高血压、血脂异常、炎症和胰岛素抵抗这些因素,对T2DM多发性神经病变的影响能力,即便不甚于,也至少是与血糖相当。最新的转录组学研究数据将进一步深化该观点,这些数据发现脂代谢和炎症通路是调节人类神经损伤的重要因素。我们总结出,T1DM和T2DM多发性神经病变发生的机制不同,其治疗不单要早期干预,还应该针对不同糖尿病类型进行特异性治疗。
糖尿病的负担
文献报道的IGT神经病变(IGTN)发生率为8%~30%,这些文章的结论有所矛盾并需要进一步探讨。然而IGT和糖尿病神经病变,都是外周神经纤维因由远端到近端的神经纤维脱髓鞘而发生功能障碍的疾患。IGT和新发糖尿病患者的多发性神经病变呈现出远端足部疼痛和温度异常的表现,预示着有髓及无髓神经纤维的早期病变。由T2DM前期到T2DM的过程中,以及T1DM和T2DM发病后,患者都经历着持续的代谢损伤,小的有髓和无髓神经纤维都在逐步丧失。神经纤维丧失后,足部疼痛变为足部麻木,进而因较粗直径的神经纤维受损而丧失本体感觉。最终神经节点处的神经受损后便进展为无感觉足。终末期糖尿病多发性神经病变的患者,容易跌倒,发生溃疡甚至截肢,生活质量降低。因此,糖尿病多发性神经病变的社会学消耗极高,2007年估计约500亿美元,占当年T1DM和T2DM直接与间接经济支出总和的25%。
临床试验中多发性神经病变的识别
糖尿病多发神经病非常常见,可致残,且医疗花费高昂,但是相关领域的研究却仍因缺乏统一诊断标准而受阻碍。神经学专家和糖尿病专家于25年前共同制定了一套糖尿病多发神经病的诊断标准,但该标准对于临床试验而言过于费时耗财,于是各试验都使用不同的标准。现行的各种诊断标准都具有足够的相似性,可在一定程度上进行合理的荟萃分析,然而更理想的比较分析仍需要齐同的事件判断临床参数。
为了改变此种状况,另一组专家,即多伦多糖尿病多发性神经病变专家组,在2011年撰写并发表了新的标准。该标准较经典标准简单,并提供了一个新的易于广泛接受且适用于长远研究的诊断框架。这一诊断标准的要点见表1:
T1DM和糖尿病多发性神经病变
糖尿病控制和并发症试验(DCCT)是迄今为止最大规模的T1DM干预试验,以研究强化血糖控制能否改变T1DM患者微血管并发症的发生发展为目的。一级预防组(病程小于5年)和二级预防组(病程小于15年)的患者随机分为强化和普通治疗组,平均6.5年的随访中,两组患者糖化血红蛋白(HbA1c)均值分别7.2%和9%。DCCT试验根据病史、仔细的神经学查体和神经传导试验(与表1中标准相同)对糖尿病多发性神经病变进行诊断。强化组患者多发性神经病变的整体发生率降低了60%,一级预防和二级预防组的发病率分别降低了69%和57%。
在DCCT试验结束后,原来1,425名患者中有1,375名进入后续的糖尿病干预和并发症流行病学研究(EDIC)。EDIC使用密歇根神经病变筛查系统(MNSI)每年为患者进行多发性神经病变评估。尽管后续随访中EDIC中原强化和普通治疗两组患者的平均糖化血红蛋白均为8%,然而最初强化治疗的益处保持了8年。早期强化治疗患者发生糖尿病多发性神经病变的风险明显低于对照组患者,且这一结果在16年后用更为严格的DCCT原始评价标准重复验证,结论仍然一致。

表1 多伦多专家组糖尿病多发性神经病变临床分级
在1型糖尿病患者中进行的至少纳入40名患者的另外四项研究均发现,强化血糖控制可改善神经并发症的发生发展。这些研究纳入的患者例数小于DCCT/EDIC研究,也探索了不同的糖尿病多发性神经病变的诊断标准。所有的研究都得出一致的结论:改善血糖控制,能够保护神经功能和/或延迟糖尿病多发性神经病变的发生。有关T1DM多发性神经病变的相关研究总结见表2。
T2DM和糖尿病多发性神经病变
至今有五项大规模,最低涉及对象150名,关注了T2DM神经病变的临床试验(表2)。在英国前瞻性糖尿病研究(UKPDS)中,3,867名新诊断的T2DM患者随机分为使用一种口服降糖药物或胰岛素的强化治疗组,和常规饮食治疗组。十年之后,强化治疗组比常规组患者的糖化血红蛋白平均低近1%,但两组之间神经病变的发生率并无差异,并且这两组患者的血脂和血压亦无差异。这个队列研究在随访第15年时才出现糖尿病神经病变发病率的统计差异。这个结果,与DCCT结果相比不符预期,但却受到另一个样本量较小的T2DM研究——VA合作研究的支持。后者在对153名男性T2DM患者为期2年的研究显示,强化控糖组与普通控糖组的神经并发症发生率无差异。另一项纳入1,791名退伍军人的研究发现,显著改善血糖控制5年(强化控糖和对照控制组的平均糖化血红蛋白分别为6.9%和8.4%)不能改变神经并发症的发生率。2003年,一项纳入160名T2DM患者的Steno-2研究也报道了类似的结果。最新的ACCORD研究纳入了多达10,251名T2DM患者,随机分配5,128名至强化血糖控制组(目标糖化血红蛋白<6.0%),其余5,123名患者为标准治疗组(目标糖化血红蛋白7.0%~7.9%)。强化治疗组由于过高的死亡率而被迫提前终止,恢复为标准治疗。该研究采用密歇根神经病变筛查系统来诊断糖尿病多发性神经病变,仅发现强化组患者神经病变的年发生率降低0.7%,3.7年的随访后相对风险率降低仅5%,且这些数据均未达到统计学差异。上述五项临床试验中,四项都报道强化组的神经病变发生率较对照组有降低的趋势,但仅有UKPDS的数据达到了统计学差异。这五项研究都提示,在血糖控制之外,还存在其它的独立因素是糖尿病多发性神经病变发生的关键因素。
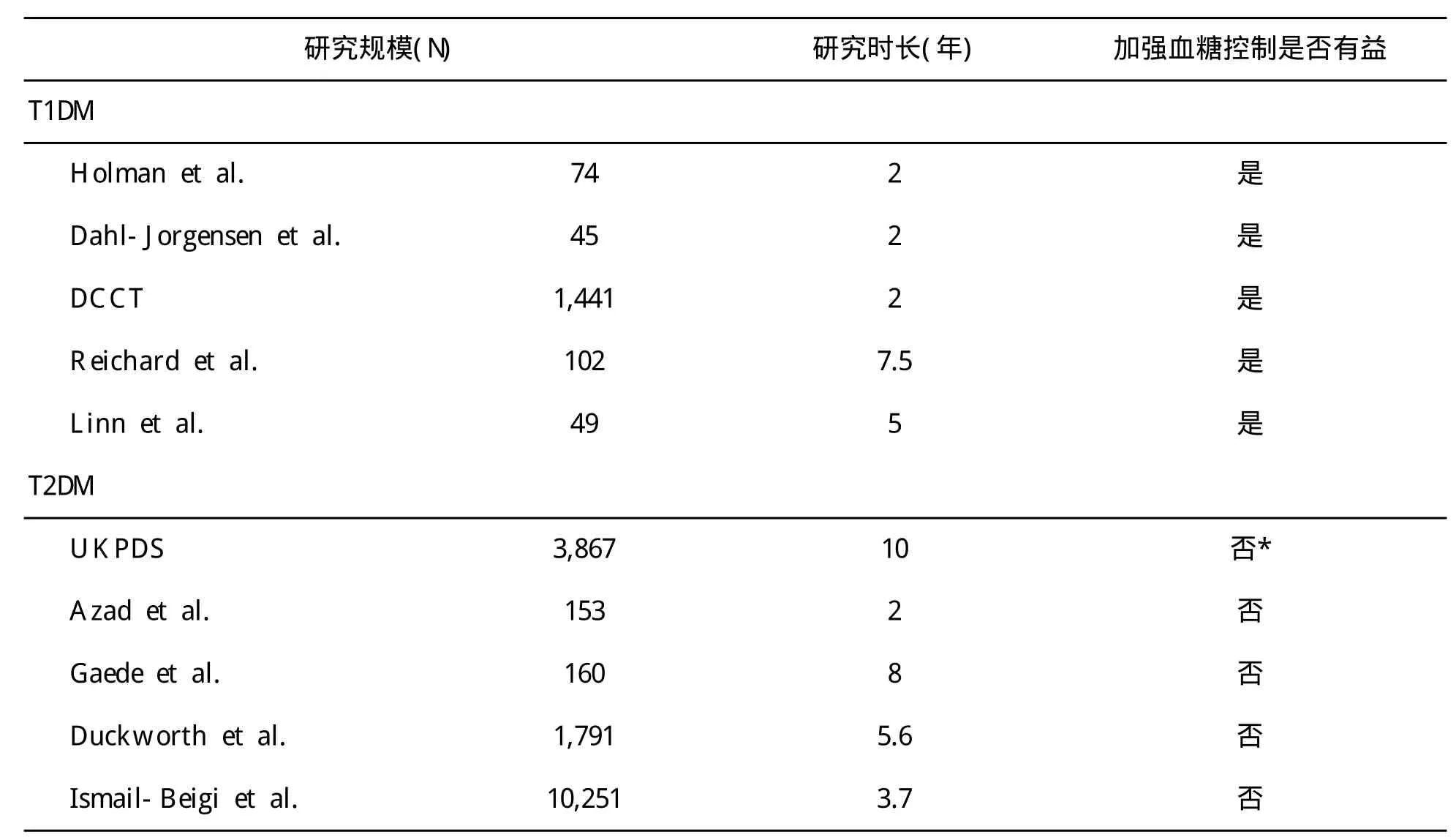
表2 血糖干预对T1DM和T2DM糖尿病多发性神经病变不同影响效果
T2DM常合并冠心病的其他危险因素,包括肥胖、高血压和血脂异常,同时罹患多种上述危险因素的患者诊断为代谢综合征。由于T2DM患者常合并代谢综合征中的其他组分,因而有学者开始研究代谢综合征中的其他组分对神经病变的影响。Costa等以及Metascreen研究小组都采用交叉设计来研究代谢综合征和神经病变间的联系。Smith等发现特发性神经病变的患者,有IGT和无IGT者代谢综合征组成成分的发生率相同,提示代谢综合征中的其他组分,而非IGT,可能在神经病变中起重要作用。其他的研究小组发现肥胖、高血压、低密度脂蛋白、高密度脂蛋白和/或高甘油三酯血症与神经病变独立相关。这些研究都指向其他因素,而非血糖控制,在T2DM患者神经病变的发生中起着重要作用。
血脂、炎症、胰岛素抵抗和糖尿病多发性神经病变
在90年代中期,许多研究糖尿病多发性神经病变的试验以表面神经活检结果作为主要事件终点。遗憾的是,没有任何干预能够成功终止或逆转糖尿病多发性神经病变的进程。我们实验室也有一批这样的表面神经标本,以及相应的血液因子和临床资料数据库。我们选择每隔1年进行连续表面神经活检的病例,进行相关因素与表面神经组织有髓神经纤维密度(MFD)丢失情况之间的分析。同时使用高通量微阵列技术测量组织中不同mRNA的含量,来研究这些患者在糖尿病多发性神经病变病程中神经基因调节的情况。定义MFD年丢失量大于500有髓纤维/mm2为急进性多发性神经病变,小于100有髓纤维/mm2为非急进性多发性神经病变,在这两组中选出完成试验患者的末次标本共36例行mRNA测定。生物信息学分析发现两组标本间有532个表达不同的基因,且这些功能上调的基因与脂代谢和炎症反应通路相关。对差异表达基因采用由文献衍生的分析网络进行分析,这些基因网络的中心集中在载脂蛋白E和PPARγ上,再一次提示脂类在糖尿病多发性神经病变进程中的重要作用。这些在人类进行的试验近期在T2DM动物模型上进行了模拟,发现糖尿病可使T2DM神经病变小鼠坐骨神经中脂代谢及免疫反应相关基因表达调节高度异常,这和人类受影响的基因相类似。
正如前述,T2DM患者具有胰岛素抵抗的特征。胰岛素抵抗定义为组织,诸如肌肉、脂肪、肝脏等,对正常循环水平胰岛素的反应能力下降的状态。这些组织对葡萄糖的摄取依赖于胰岛素。而在神经元中,胰岛素是重要的生长因子,在神经发育和生存中起重要作用。新兴的观点认为,神经元和其他组织一样,可以发生胰岛素抵抗。介于胰岛素有促神经生成的重要作用,胰岛素抵抗引起的下游信号途径改变可最终导致神经损伤,成为糖尿病神经并发症发生的病理机制。我们最近阐明,胰岛素抵抗引起的下游信号途径变化使得神经元抵抗不良代谢变化的能力减弱,可能促进糖尿病多发性神经病变的发生。上述现象可由糖尿病状态下,神经元细胞发生胞内重要锚定蛋白,即胰岛素受体亚组,反应性的变化而引起。
结论
在汇总分析相关文献后,现有的证据强烈支持以下观点:单一严格血糖控制不足以延缓T2DM多发性神经病变的发生和发展。随着全球IGT人口的增长和T2DM的流行,对新型糖尿病多发性神经病变预防策略的需求迫在眉睫。今后还需要更多的研究来探讨神经损伤的新机制,包括脂毒性、炎症和神经胰岛素抵抗等,对疾病机制的无知是导致目前缺乏有效干预的原因之一。在等待现行和未来研究结果之时,我们建议在遵从ADA强化治疗T2DM指南之外,需同时强化对代谢综合征中其他组成部分(如肥胖、高血压和血脂紊乱等)的治疗。而在T1DM中,多发性神经病变与血糖的关系尤为密切,我们认为密切关注这些患者的血糖情况即能持久获益。

