竞争性抑制酶联反应在量热式农残生物传感器中的试验研究
Ng u y e nVa n-l u c,于劲松,徐 斐,华泽钊
(上海理工大学食品安全研究所,上海 200093)
作为广谱高效的有机磷杀虫剂,甲胺磷(Methamidophos,MTD)曾广泛用于世界各地。由于其对哺乳动物的高毒性以及其长期残留性,近年来各国家对于甲胺磷的使用有严格的限制,甚至禁止使用于蔬菜及水果。但是由于违禁使用甲胺磷而导致的食品安全事件仍时有发生,因此有必要建立适用于现场检测的快速、便捷的检测方法[1]。目前,农药残留快速检测主要基于酶抑制或免疫分析原理,结合光度法,以吸光度值作为指标,通过测定固定于载体上的残余酶活性或标记在抗体上的酶活性来间接衡量农药的残留量[2]。这类光学检测易受电化学物质和光学物质(如样品颜色)的干扰,造成检测结果的误差[3]。量热方法可克服光学方法的不足且有通用性强优点。但酶抑制法中酶与底物的反应放热量很小,测量困难[4-5];而免疫分析法中的氧化还原酶类的放热量虽大,但制备单克隆抗体的成本较高[6-7]。因此,可参考以上两种方法,基于酯酶-农药抑制剂之间的结合和免疫学中的抗体-抗原结合都是特异性原理,将酯酶做抗体,将农药作抗原,利用葡萄糖氧化酶(Glucose oxidase,GOx)等氧化还原酶来标记农药,制得酶标农药,并使酶标农药与待测农药竞争性地与酯酶发生抑制结合反应(见图1),从而获得较大的反应热,便于采用量热方法来快速检测农药残留。
1 材料与方法
1.1 试剂与仪器
甲胺磷(Methamidophos,MTD)99.0%,分析纯(购自于上海市农药研究所);丁二酸酐(99%)、葡萄糖氧化酶(EC 1.1.3.4,GOx)(购自于Sigma-Aldric公司);树脂(150S)(购自于英国Purlite);鸡肝新鲜(购自于上海沔青食品厂);透析膜(购自于上海绿鸟科技发展有限公司)。
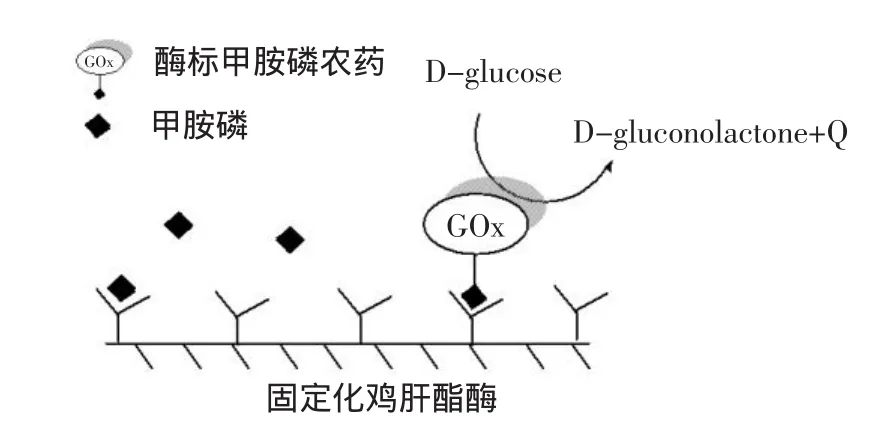
图1 量热式农药残留生物传感器的检测原理Fig.1 Detection principle of thermal pesticide biosensor
UV1700紫外分光光度计(日本岛津公司);THD-4006低温恒温循环器(宁波天恒仪器厂);微量热计Micro DSCII(法国SETARAM);组织捣碎机(DS-1型)(上海标本模型厂);离心机(90-1型)(北京通用离心机厂);pHSJ-3F型精密酸度计(上海雷磁仪器厂)。
1.2 方法
1.2.1 酶标甲胺磷农药的制备
酶标农药采用碳二亚胺(EDC)法进行偶联制备。具体方法是:将甲胺磷衍生物(9.65 mg,由甲胺磷与丁二酸酐合成得到)和NHS(10.74 mg),用0.4 mL N,N-二甲基甲酰胺溶解。在磁力搅拌的同时向上述溶液中缓慢加入EDC(15.34 mg),室温搅拌反应2 h。之后将葡萄糖氧化酶(320.27 mg)溶解于0.1 M碳酸钠缓冲溶液中,pH 9.5,溶解之后在搅拌状态下将GOx缓慢加入到上述反应液中。然后将反应液室温搅拌反应2 h,4℃冰箱搅拌16 h。最后将产物溶液转入透析袋,4℃条件下用pH 7.4的PBS溶液透析72h,透析液贮于-20℃下备用。
酶标物用TNBS比色法测定酶标偶联结合比[8-9];酶标的酶活力测定方法是用分光光度法测定[10]。
1.2.2 鸡肝酯酶的提取与固定化
将1.0 g新鲜鸡肝与3.0 mL柠檬酸-柠檬酸钠(0.025 M,pH 6.4)混合。用组织捣碎机(DS-1型,上海标本模型厂)将上述混合物打成匀浆,所得匀浆在离心机(90-1型,北京通用离心机厂)上以5 000 r·min-1的转速离心10 min后,上清液即为鸡肝酯酶。
树脂(C150S阴离子交换树脂)经酸碱处理好以后,按4 mL·g-1的比例,将鸡肝酯酶液与树脂混合,在摇床上摇晃一定时间后,将固定化酶树脂与酶液分开。按树脂∶液体=1∶10(g·mL-1)的比例,用去离子水对以上固定化酶进行洗涤。最后将固定化酶浸在蒸馏水中,于4℃条件贮存备用。
固定化鸡肝酯酶的酶活力测定方法参见文献[11]。固定化鸡肝酯酶的酶活力单位为9.0±0.012 OD/g。
1.2.3 量热法测量原理
酶促反应总是伴随着或多或少的热焓变化,焓值的变化范围大部分为-5~-100 kJ·mol-1[12]。在绝热条件下,酶反应产生的热量变化正比于底物的摩尔焓变。存在:

式中,Q为全部的热量变化,np为反应底物的摩尔数,ΔH为反应底物的摩尔焓变,Cp为系统的比热,ΔT为由热量变化产生的温度变化。联立两式:

量热传感器可以采用热敏电阻、热电偶、热电堆等。其中,热电堆具有较小的噪声和较高的灵敏度,它是多个热电偶的串联组合,输出信号可以被放大几倍到几百倍。当其两端存在温差ΔT时,有:

式中,ΔV为输出的电动势信号,n为热电堆的级数,ε是热电系数。联立式(3)、(4):

可以看到输出的电动势信号正比于反应底物的摩尔数和焓变,即正比于反应底物的浓度及其反应热。
1.2.4 竞争性抑制酶联反应法的量热测试系统设计
测热时用到的试剂:缓冲液(0.025 M柠檬酸-柠檬酸钠缓冲液,pH 5.7);底物(90 mmol·L-1的D-葡萄糖);样液(用缓冲液溶解酶标农药或者酶标和甲胺磷到一定浓度)。试验中用到的自主设计开发竞争性抑制酶联反应法的量热测试系统见图2。
对照图2,系统的测试过程如下:
①将固定化鸡肝酯酶(0.1 g)放在DSC中,泵入缓冲液等待温度和焓变稳定(20~30 min);②预冲样液(蒸馏水或酶标农药,或酶标-甲胺磷的溶液)5 min;③静置5 min,使固定化酶得到充分抑制;④泵入缓冲液5 min;⑤预冲底物:1 min;⑥进底物开始反应:3 min。
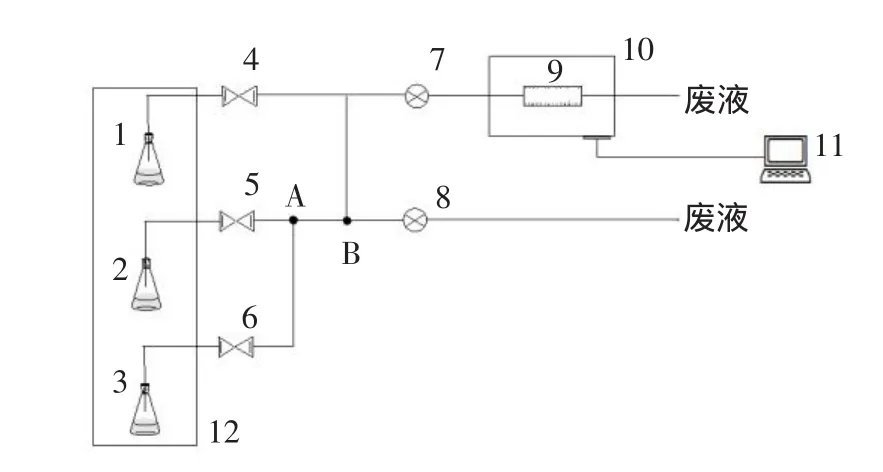
图2 竞争性抑制酶联反应法的量热测试系统Fig.2 Calorimetric test system of competitive inhibition of enzyme reaction
试验中获得的热流曲线如图3所示,对图3中曲线求导,选取积分起始点和终点,进行积分,扣除空白对照的热量,即得催化反应热。
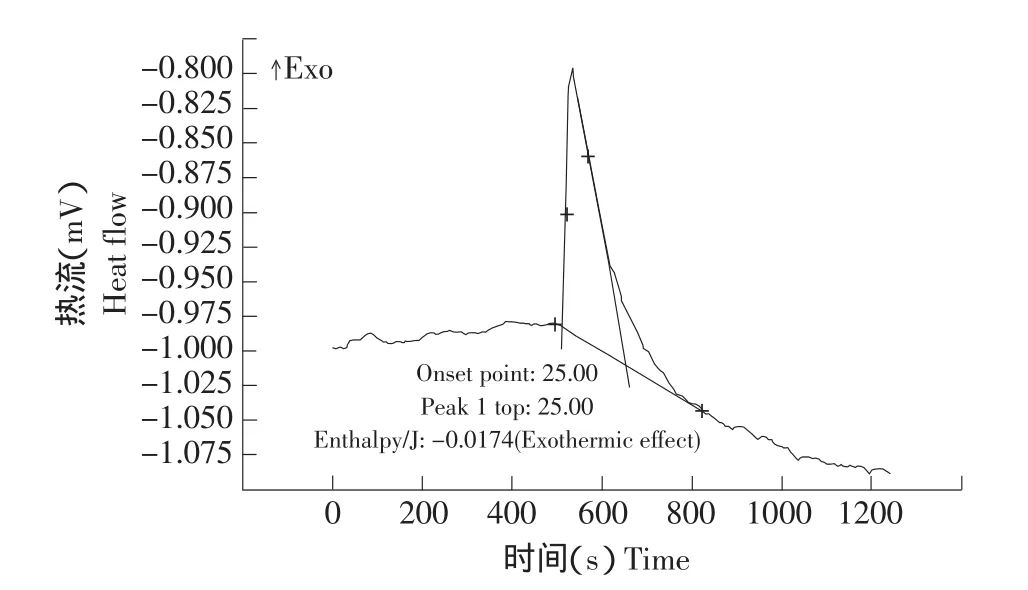
图3 热流-时间曲线Fig.3 Heat-time curve
2 结果与分析
2.1 酶标农药的酶活力及偶联率测定
按照1.2.1中所述的方法制得了酶标农药,在进行量热研究之前,首先需要考察制得的酶标农药的酶活力以及偶联率,试验结果如表1所示。
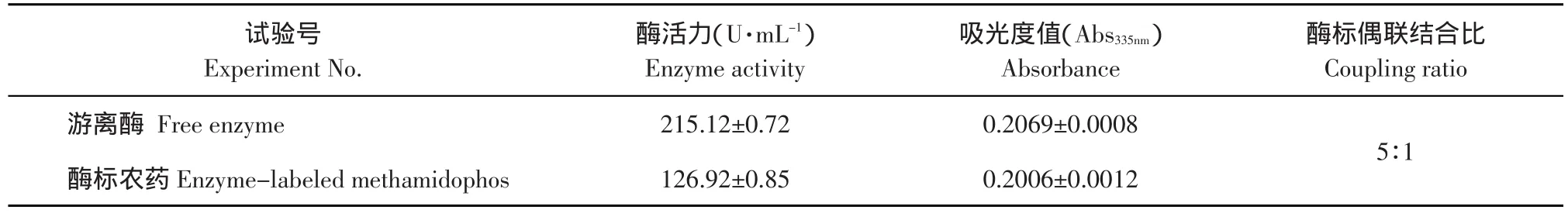
表1 酶标农药的偶联率及酶标农药中的酶活力结果Table 1 Coupling ratio and enzyme activity determination of enzyme-labeled methamidophos
由表1可以看出,酶标农药的酶活力是游离酶(葡萄糖氧化酶)的59%。葡萄糖氧化酶经过偶联甲胺磷小分子后,葡萄糖氧化酶活力略有下降。
2.2 固定化鸡肝酯酶量热试验分析
研究了固定化鸡肝酯酶与其底物的反应放热情况,以便对两种方法的放热量作对比分析。试验流路见图2,将0.1 g固定化鸡肝酯酶加入DSC样品池。样液用蒸馏水代替,底物为一定浓度的α-乙酸萘酯,缓冲液为0.025 mol·L-1柠檬酸-柠檬酸钠缓冲液(pH 5.7)。测试过程与1.2.4所述相同。最终测得样品池中固定化鸡肝酯酶的放热为0.0095 J。
2.3 酶标农药的放热试验
酶标农药的底物(D-葡萄糖)浓度为90 mmol·L-1[13-14]。不同酶标农药浓度催化反应热的结果如图4、5。从图中可见,随着酶标浓度的增加,放热量亦增加。在酶标农药浓度为0~20 μg·mL-1和0~10 μg·mL-1范围内,酶标浓度与放热量之间的回归曲线为分别为y=-0.0065+0.0002,R2=0.9763; y=-0.0067x+0.0019,R2=0.9960。二者相比,0~10 μg·mL-1范围内的线性关系较好,初步选择酶-标浓度10 μg·mL-1进行下一步研究。
2.4 竞争性抑制酶联反应的量热试验及对比分析
获得了不同浓度酶标农药的放热曲线之后,进行了酶标甲胺磷与甲胺磷竞争性抑制酶联反应的量热研究。将不同浓度甲胺磷溶解于10 μg·mL-1酶标液中,二者的混合液作为样液,进行量热研究。试验结果如图6所示。
由图6可知,在甲胺磷浓度为0~0.004 mg·kg-1范围内,竞争性抑制酶联反应测得的催化反应热的回归方程为:y=5.6057x-0.0322;R2=0.9985。
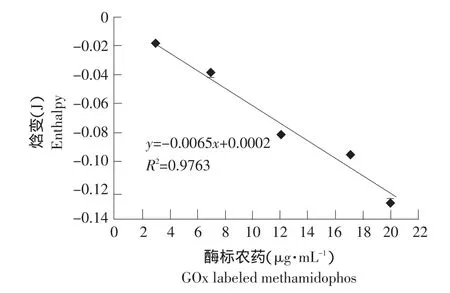
图4 不同浓度酶标农药放热曲线Fig.4 Exotherm of enzyme-labeled pesticides
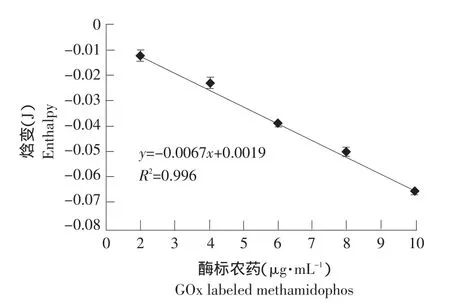
图5 不同浓度酶标农药放热曲线Fig.5 Exotherm of enzyme-labeled pesticides
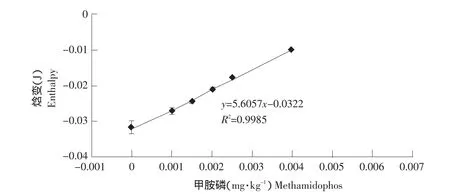
图6 竞争性抑制酶联反应催化反应热的曲线Fig.6 Exotherm of competitive inhibition of enzyme reactions
在甲胺磷浓度为0 mg·kg-1时,焓变为-0.0316±0.0018 J,即放热量为0.0316 J,与2.1中测得的固定化鸡肝酯酶的放热量0.0095 J相比,用竞争性抑制酶联反应法测得的放热量是固定化鸡肝酯酶体系的3.33倍,该方法法可以有效放大反应热量,便于进行量热测定。根据回归方程计算得到最低检测限为0.0011 mg·kg-1。王华等用直接竞争ELISA试剂盒检测甲胺磷残留,最低检测限为0.01 mg·kg-1[15];Hans用GC方法测定甲胺磷残留,最低检测限为0.001mg·kg-1[16]。可见,本方法具有较低的检测限,满足实际测试需要。
3 讨论
借鉴直接竞争性酶联免疫吸附分析方法,建立“竞争性抑制酶联反应分析方法”;并通过分析酶标农药的偶联率、酶标农药浓度与待测农药浓度以及固定化酯酶酶活之间的配比等因素对相关热量放大的影响,初步验证了采用该法在相关热量放大和减少非特异性热方面的效果。由于量热式酶传感器,不易受电化学活性物质或光学物质的干扰,且具有通用性强、适合于大多数生化反应等优点,正成为快速检测食品中危害残留的新兴有效技术。但是由于相关酶反应热量微弱以及微热量快速测量困难等原因,量热式酶传感器的研究和实际应用受到限制。通过对“竞争性抑制酶联反应分析法”在有效放大相关反应热和消除非特异性产热方面可能性的探索,得出了一些适用于抑制型量热式酶生物传感器的反应热放大的一般规律。
本文为量热式酶传感器的研究提供了新方法和技术,虽然研究中采用的高精度微量热计(DSC)已能较好地满足微热量测量要求,但其价格昂贵且体积庞大,无法用于现场的快速检测。因此研究小型化的,价格适当的能满足现场的快速检测需要的量热式酶传感器将成为该研究的实施方向。
4 结论
以量热式农残生物传感器为研究对象,借鉴免疫分析方法,进行竞争性抑制酶联反应在量热式农残生物传感器中的初步应用研究。结果表明,采用竞争性抑制酶联反应法可以有效放大反应热量,放热量是固定化鸡肝酯酶体系的3.33倍;在甲胺磷浓度为0~0.004 mg·kg-1范围内,甲胺磷含量和放热量的线性较好;竞争性抑制酶联反应分析法测农药残留的最低检测限为0.0011 mg·kg-1,与文献中的数据相比,该方法可以有效放大反应热量,且具有较低的检测限,能够满足实际的测试需要;此外,扣除开机时的系统稳定时间,每次测定时间(从预冲样液到一次测试结束)约为20 min,测定时间较短。
[1]Du X F,Dong Q.Synthesis and identification of methamidophos artificial antigen[J].Sience and Technology of Food Industry 2010,31(1):201-202.
[2]王芳芳.生物传感器中固定化酶的优化及量热学实验[D]上海:上海理工大学,2004.
[3]郑艺华.流动注射量热式酶生物传感器关键技术研究[D].上海:上海理工大学,2004.
[4]Sturtevant J M.The enthalpy of hydrolysis of acetylcholine[J].J of Biological and Chemistry,1972,247:9-14.
[5]Gime J K.The determination of serum of cholinesterase activity by kinetic direct injection enthalpimetry[J].Anal Chim Acta,1979,109:393-397.
[6]孟凡立,崔兆丰,王志坤,等.高效液相色谱法检测福美双在蔬菜及土壤中的残留[J].东北农业大学学报,2010,41(6):28-31.
[7]张欣艳,赵达,王乐新,等.基于XPS的苹果表皮残留农药界面层的氩刻分析[J].东北农业大学学报,2010,41(5):131-134.
[8]虞维静,胥义,徐斐.流动与非流动测热方式对酶催化反应放热测量的影响[J].化学工业与工程技术,2007,5(28):1-5.
[9]Dzantiev B B,et al.Determination of the herbicide chlorsulfuron by amperometric sensor based on separation-free bienzyme immunoassay[J].Sensors and Actuators B,2004,98:254-261.
[10]Habeeb A F S A.Determination of free amino goups in proteins by trinitrobenzenesulfonic acid[J].Anal Biochem,1966,14:328-336.
[11]Sashidhar R B,Capoor A K,Ramana D.Quantitation of ε-amino goup using amino acids as reference standards by trinitrobenzene sulfonic acid,a simple spectrophotometric method for the estimation of hapten to carrier protein ratio[J].Journal of Immunological Methods,1993.167:121-127.
[12]Bergmeyer H U,Gawehn K,Gassl M.Methods of enzymatic analysis[M].2 ed.Academic Press Inc,New York,NY,1974:457-458.
[13]Zheng Y H,Hua T C,Sun D W,et al.Detection of dichlorvos residue by flow injection calorimetric biosensorbased on immobilized chicken liver esterase[J].Jouranl of Food Engineering,2006,74:24-29.
[14]李学辉.酶偶联体系量热法快速检测农药残留的试验研究[D].上海:上海理工大学,2010.
[15]王华,熊汉国,张丁联,等.甲胺磷残留检测直接竞争ELISA试剂盒的研制[J].食品研究和开发,2007,28(3):122-126.
[16]Hans G J.MOL,Ruud C J,VAN DAM,ODILE M.STEIJGER.Determination of polar organophosphorus pesticides in vegetables and fruits using liquid chromatogaphy with tandem mass spectrometry:selection of extraction solvent[J].Journal of Chromatogaphy A,2003,1015:119-127.

