亚砷酸钠对胰岛β细胞的Nrf2及其调控的抗氧化酶表达的影响
杨 蓓 丁金兰 陈 雪
(中国医科大学基础医学院组织与胚胎学教研室,沈阳 110001)
Ⅱ型糖尿病(T2D)是由于在胰岛素抵抗背景下进行性的胰岛素分泌缺陷所造成的,此型占全部糖尿病类型的90-95%;多种因素可以引发II型糖尿病,如遗传、不良生活方式、肥胖等,近年流行病学调查研究显示,环境砷暴露也可以导致2型糖尿病的高发[1,2]。实验研究也表明砷可以通过氧化应激来损伤胰岛β细胞功能[3]和诱发胰岛素抵抗而导致2型糖尿病发病[4]。核转录因子Nrf2是细胞内抑制氧化损伤及对抗外来化合物毒性最重要的核转录因子。因此本实验考察了亚砷酸钠对小鼠胰岛β细胞的Nrf2和其调控的抗氧化酶的诱导作用,希望为II型糖尿病发病及治疗提供一个新思路。
材料和方法
1.细胞培养与染毒
小鼠胰岛β细胞MIN6由哈佛大学赠送。培养时应用含有15%胎牛血清、5ul/Lβ-巯基乙醇、50umits/ml青霉素和50μg/ml链霉素的高糖DMEM培养基,于37℃、5%CO2,95%大气条件下培养。每2天更换一次培养基。应用2、4、6、8、10μmol/L的亚砷酸钠对MIN6细胞进行染毒6h,同时设立不加亚砷酸钠的培养液作为阴性对照。
2.Western Blot
收集细胞,裂解液裂解,超声处理,低温离心5 min,取上清液,应用BCA方法测定蛋白浓度。选择4-12%Tris-Glycine凝胶进行电泳,转膜并采用特异性抗体进行western blot分析,一抗:Nrf2(购于Santa Cruz公司)、β-actin(购于Sigma公司)。二抗:碱性磷酸酶标记的抗兔、抗小鼠均购自Sigma公司。加入ECF底物进行荧光显色,使用Typhoon 9410扫描免疫条带。应用Image J分析软件分析上述结果,以目的条带与内参β-actin的平均灰度值的比值表示蛋白水平,进行半定量分析。
3.mRNA提取与Real-time PCR分析
应用TRIzol法进行细胞总mRNA提取。逆转录反应:总mRNA经MuLV逆转录酶、OligodT和dNTP逆转录为cDNA。逆转录反应条件为:25℃10min;48℃60min;95℃ 5min。Real-time PCR反应:上述逆转录产物使用SYBR Green试剂盒(Applied Biosystem公司)和7900HT实时定量PCR仪进行基因转录水平分析。本实验中引物设计应用Primer Express软件(美国Applied Biosystem公司),并由 MWG-BIOTECH公司合成。所用引物为:18S 上游引物:5’CGAACGTCTGCCCTATCAACTT 3’下游引物:5’CCGGAATCGAACCCTGATT 3’;Srx 上 游 引 物:5’GCTTCCTCTCGGGAGTCCTT3’下游引物:5’CAGCAACAGCGACTACGAAGTAA 3’;Gclc上游引物:5’TGGCCACTATCTGCCCAATT 3’下游引物:5’GTCTGACACGTAGCCTCGGTAA 3’。不同组之间基因表达的相对差异应用循环数(Ct)表示。本实验中检测的相关引物Ct值均小于30。每个样品的Ct值用1 8s进行校正,mRNA表达量用Ct值与对照组Ct值比较所得的倍数表示。
4.统计与分析
应用统计软件Graphpad Prism 5进行数据处理与分析。所有数据表示为平均值±标准误。多组间单个变量比较应用单因素方差分析(ANOVA),当P<0.05时认为具有统计学差异。
结 果
1.急性亚砷酸钠暴露对MIN6细胞Nrf2基因和蛋白表达的影响
应用2、4、6、8、10μmol/L的亚砷酸钠对 MIN6细胞进行染 毒6h,Real-time RT-PCR 结 果 显 示:MIN6细胞内的Nrf2mRNA表达水平在不同剂量急性亚砷酸钠暴露6h后均未见显著变化(图1)。
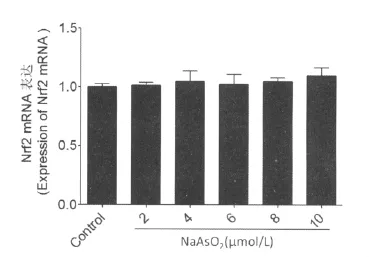
图1 2.4.6.8.10μmol/L亚砷酸钠暴露6hMIN6细胞Nrf2mRNA(Ct值为21)Fig.1 Nrf2gene expressions of MIN6lells exposed to 2.4.6.8.10μmol/L NaAsO26h(Ct:21)
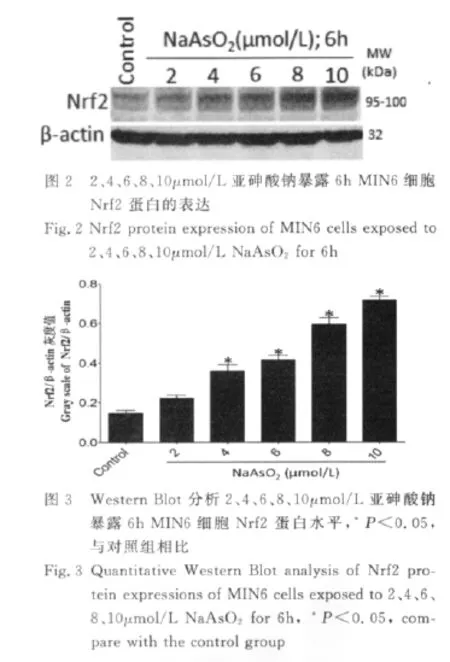
应用2、4、6、8、10μmol/L的亚砷酸钠对 MIN6细胞进行染毒6h,Western Blot结果显示:2μmol/L亚砷酸钠暴露6h,MIN6细胞内Nrf2蛋白表达水平略有升高,4μmol/L亚砷酸钠则呈现明显增高(P<0.05),之后随亚砷酸钠剂量的增加而Nrf2蛋白表达逐渐增高,Nrf2蛋白表达存在显著地剂量依赖性(图2、3)。
2.急性亚砷酸钠暴露对MIN6细胞抗氧化酶Srx和Gclc基因表达的影响
应用2、4、6、8、10μmol/L的亚砷酸钠对 MIN6细胞进行染 毒6h,Real-time RT-PCR 结 果 显 示:2μmol/L亚砷酸钠暴露6h,就能够显著提高抗氧化酶Srx和Gclc的基因表达,之后随着亚砷酸钠染毒剂量的增加,Srx和Gclc的基因表达也随之增高,呈现了显著的剂量-效应关系(P<0.05)(图4、5)。
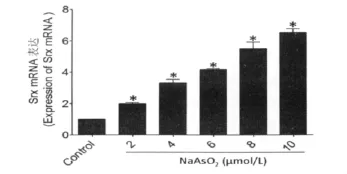
图4 2、4、6、8、10μmol/L亚砷酸钠暴露6hMIN6细胞Srx mRNA的表达(Ct值为18).*P<0.05,与对照组相比Fig.4 Srx gene expression of MIN6cells exposed to 2、4、6、8、10μmol/L NaAsO2for 6h(Ct:18).*P<0.05,compare with the control group
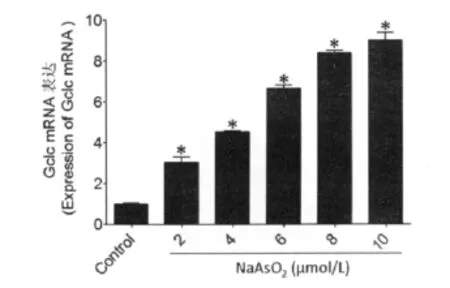
图5 2、4、6、8、10μmol/L亚砷酸钠暴露6hMIN6细胞Gclc mRNA的表达(Ct值为20).*P<0.05,与对照组相比,Fig.5 Gclc gene expression of MIN6cells exposed to 2、4、6、8、10μmol/L NaAsO2for 6h(Ct:20).*P<0.05,compare with the control group
讨 论
胰岛又称朗格罕岛(islet of Langerhans),分散在于胰腺外分泌部之间,由内分泌细胞组成的球形细胞团。胰岛主要包含有α、β、δ和PP四种内分泌细胞,其中β细胞的主要功能就是合成和分泌胰岛素,而胰岛素是体内唯一的一种降血糖的激素,因此胰岛β细胞损伤造成胰岛素合成或分泌功能障碍是导致糖尿病发生的重要因素之一。氧化应激(Oxidative stress)被认为是砷发挥毒性的最重要的机制之一[5]。砷可以在体内外诱导氧化应激,产生大量的活性氧自由基(Reactive oxygen species,ROS),如超氧阴离子、羟自由基和过氧化氢等。通常,抗氧化酶在胰岛β细胞中呈现低水平表达,这就将导致β细胞对氧化应激刺激的防御能力比一般细胞低,所以砷可以通过氧化应激反应而损伤β细胞的功能,引发II型糖尿病的发生。
核转录因子Nrf2属于碱性亮氨酸(bZip)转录因子CNC家族,是细胞内抑制氧化损伤及对抗外来化合物毒性最重要的核转录因子,许多化学物能激活Nrf2、启动对靶基因的调控表达。当受到来源于活性氧或亲核剂的信号攻击后,Nrf与其胞浆抑制蛋白Keap1解离,并转位进入细胞核,与抗氧化反应元件ARE(Antioxidant Response Element)结合,并介导抗氧化酶,如Srx和Gclc和Ⅱ相解毒酶,如Nqo1、Hmox-1等基因的转录活性,从而发挥细胞抗氧化作用[6,7]。
Jingbo Pi[8]在人类HaCaT细胞中首次证明了砷暴露能够活化Nrf2信号通路。此外,在培养的小鼠3T3L1细胞[4],Chang 肝细胞[9]等研究中亦表明亚砷酸钠能够活化细胞中的Nrf2信号通路,但在胰岛β细胞中尚未见相关报道。本实验采用来源于转基因小鼠C57BL/6胰岛素瘤的细胞系MIN6,应用了2、4、6、8、10μM 的亚砷酸钠急性作用 MIN6细胞6h后,结果显示细胞内Nrf2的mRNA表达并未见显著改变,而Nrf2蛋白表达则出现了明显的剂量依赖性;抗氧化酶Srx和Gclc基因表达亦随亚砷酸钠剂量的增加而表达增强。综上所述,亚砷酸钠能够在蛋白水平诱导胰岛β细胞的核转录因子Nrf2蛋白表达,进而促进其下游的抗氧化酶Srx和Gclc基因的转录活性,并对亚砷酸钠存在显著的剂量依赖性。这些结果表明,亚砷酸钠能诱发小鼠胰岛β细胞内Nrf2/ARE信号通路的激活,来对抗的亚砷酸钠对细胞造成的氧化应激损伤,而Nrf2/ARE信号通路在急性亚砷酸钠诱导的小鼠胰岛β细胞的毒性损伤中的作用及意义还有待进一步研究。
[1]Steinmaus C,Yuan Y,Liaw J,et al.Low-level Population Exposure to Inorganic Arsenic in the United States and Diabetes Mellitus:A Reanalysis.Epidemiology,2009,20(6):807-815
[2]Longnecker MP.On Confounded Fishy Results Regarding Arsenic and Diabetes.Epidemiology,2009,20(6):821-823
[3]Díaz-Villaseor A,Burns AL,Salazar AM,et al.Arsenite reduces insulin secretion in rat pancreatic beta-cells by decreasing the calcium-dependent calpain-10proteolysis of SNAP-25.Toxicol Appl Pharmacol,2008,231(3):291-299
[4]Xue P,Hou Y,Zhang Q,et al.Prolonged inorganic arsenite exposure suppresses insulin-stimulated AKT S473 phosphorylation and glucose uptake in 3T3-L1adipocytes:involvement of the adaptive antioxidant response.Biochem Biophys Res Commun,2011,407(2):360-365
[5]Shi H,Shi X,Liu KJ.Oxidative mechanism of arsenic toxicity and carcinogenesis.Molecular and Cellular Biochemistry.2004,255(1-2):67-78
[6]Itoh K,Wakabayashi N,Katoh Y,et al.Keap1regulates both cytoplasmic-nuclear shuttling and degradation of Nrf2 in response to electrophiles.Genes Cells,2003,8(4):379-391
[7]Taguchi K,Motohashi H,Yamamoto M.Molecular mechanisms of the Keap1-Nrf2pathway in stress response and cancer evolution.Genes Cells,2011,16(2):123-140
[8]Jingbo Pi,Wei Qu,Jeffrey M Reece,et al.Transcription factor Nrf2activation by inorganic arsenic in cultured keratinocytes:involvement of hydrogen peroxide.Exp Cell Res,2003,290(2):234-245
[9]李冰,刘洁,李昕等.亚砷酸钠对核转录因子Nrf2和血红素单加氧酶-1表达的影响.环境与健康杂志,2009,26(12):1058-1060

