超能聚焦超声栓塞兔VX2肿瘤血管的实验研究
苏 静,刘丽萍,陈文直
(解放军第152中心医院,河南 平顶山 467000)
实体瘤生长至直径达1~2 mm时即开始血管化,随后肿瘤增生和转移加快,可见,血管在肿瘤的发生、侵袭和转移的多步骤过程中,均发挥重要作用,阻断肿瘤血管使肿瘤生长延缓甚至消失[1-2]。抑制肿瘤血管再生,破坏肿瘤血管已成为肿瘤治疗研究的一个热点。超能聚焦超声(HIFU)作为一种非侵入性肿瘤治疗的新方法,随着其在临床各种良、恶性实体瘤治疗中的广泛应用,发现其使肿瘤凝固性坏死的同时也破坏肿瘤内的微血管、小血管[3]。本实验从彩色多普勒血流成像(CDFI)、数字减影血管造影(DSA)等方面定性探讨HIFU栓塞肿瘤血管的可行性及安全性。
1 材料与方法
1.1 实验动物 纯种健康新西兰大白兔56只,雌雄不限,2~3 月龄,体质量 1.5 ~2.0 kg(重庆医科大学实验动物中心)。荷瘤种兔2只(重庆医科大学医学超声工程研究所)。
1.2 实验用药品及设备 速眠新、苏醒灵-Ⅲ号(解放军农牧大学兽医研究所);质量分数8%硫化钠(上海化学试剂总厂);JC型聚焦超声肿瘤治疗系统(重庆医科大学医学超声工程研究所),治疗头频率0.4 MHz;Volu-son730 Expert超声诊断仪(德国GE公司)。
1.3 实验方法 采用隧道组织块包埋法[4]将兔VX2肿瘤组织块接种于兔大腿股外侧肌肉内,建立兔VX2肌肉肿瘤模型,接种后2周将56只肿瘤模型兔按随机数字表法分为对照组(A组)、实验组(B组、C组、D组)4组,每组14只,分别给予HIFU假照和声强分别为1194、1592、1990 W·cm-2的 HIFU 辐照。HIFU辐照采用3D分层点辐照,完全覆盖肿瘤,假照组与实验组不同之处在于未开启功率源。
1.4 观察指标
1.4.1 CDFI检查 每组分别于HIFU辐照前及辐照后第3、7天行CDFI检查,每次选择血流显示最多的切面记录,仪器各项设置参数均相同,且该操作由专业超声科医生完成。对切面血管数目(点状、条状、长条状均按1条血管计算)做半定量分析。分级标准为:0级,瘤体内无血流信号;1级,瘤体内血管少于3条;2级,瘤体内血管 3~5条;3级,瘤体内血管超过5 条[5]。
1.4.2 DSA检查 每组分别于 HIFU辐照后第3、7天行DSA检查,DSA检查过程:于检查前将兔腹部用质量分数10%硫化钠脱毛、备皮,麻醉后仰卧固定于操作台,消毒,依次切开腹部皮肤、肌肉、腹膜,以纱布覆盖膀胱、肠管,暴露腹膜下方的兔腹主动脉,在髂总动脉分叉处钝性分离出动脉后用丝线牵引其近心端,以头皮静脉针向离心方向穿刺进入HIFU辐照侧后肢股动脉,成功后固定针头于股动脉内,随行DSA摄影检查,所用造影剂为质量分数30%泛影葡胺,用量为3~4 mL,以1.0 ~ 1.2 mL·s-1的速度推完造影剂[6]。整个摄片过程请有丰富经验的SA专家指导进行。曝光条件自动调节,分段曝光采像,图像质量按重点部位显像情况满足诊断要求程度和有无人工伪影等综合诊断。
1.4.3 病理学检查 HIFU辐照后第3、7天每组各取2只于肿瘤边缘和正中取材,用体积分数10%中性甲醛固定后常规石蜡包埋切片、HE染色,光镜观察,以全面评价肿瘤血管分布情况及HIFU对肿瘤血管和周围组织的损伤情况。
1.4.4 超微结构观察 HIFU辐照后各组取材的同时,先迅速切取1 mm×1 mm×1 mm大小的组织标本放入4℃下保存的体积分数2.5%戊二醛固定液,用固定液冲洗组织表面的血液成分后,再用40倍于标本体积的量加入新鲜固定液,4℃保存2 h;完成前固定的标本再用 0.1 mol·L-1的磷酸盐缓冲液(pH 7.2 ~7.4)于4℃下冲洗3次。经过质量分数1%饿酸后固定2 h,乙醇和丙酮梯度脱水,环氧树脂浸透、包埋、修块和制刀,CQR-1型超薄切片机制备成半薄切片。醋酸双氧铀和硝酸铅染色后,在H-600透射电镜下观察并摄片、定性分析、观察肿瘤血管以及周围肿瘤实质超微结构的改变。
2 结果
2.1 CDFI检查结果 各组HIFU辐照前,CDFI示肿瘤周边半环状或短棒状血流信号,内部零星状血流信号,瘤体内血管3级,肿瘤有丰富的血供。辐照后第3天,A组、B组和 C组较辐照前无明显变化,D组(8/14)肿瘤周边短线状或星点状血流信号,内部无血流信号,瘤体内血管2级,较辐照前血流信号减少。辐照后第7天,A组显示肿瘤周边血流半环状或短棒状血流信号,血流丰富,D组偶见点状或无血流信号,瘤体内血管0级。见图1。
2.2 DSA检查结果 DSA连续动态显像可完整显示动脉期、静脉期、毛细血管期的形态表现,能较清楚显示兔大腿肌肉肿瘤供血血管的分布和肿瘤染色。HIFU辐照后第3天,A组、B组、C组DSA显示动脉期可见肿瘤滋养血管源自股动脉,增粗、扭曲、移位,进入肿瘤后,发出多条细小分支,肿瘤血管丛的形态不规则,毛细血管期肿瘤典型浓染,而D组显示以上征象减少,肿瘤边缘染色浅;HIFU辐照后第7天,C组毛细血管期肿瘤边缘染色稍浅,D组肿瘤染色征象几乎完全消失。见图2。


2.3 病理学检查结果 HIFU辐照后第3天,A组、B组、C组病理学表现相似,HE染色光镜下未见变化;D组可见间质肿瘤血管内皮细胞脱落、血栓形成,部分闭塞血管,肿瘤细胞轻度坏死。HIFU辐照后第7天,A组、B组肿瘤周边取材,光镜下见肿瘤细胞及血管无改变,中心取材光镜下见肿瘤细胞核固缩、核碎裂核核溶解等坏死,呈不规则小片状红染;C组可见瘤体内肿瘤血管内皮细胞明显肿胀,管腔内有较多红细胞聚集,血管周围肿瘤细胞水样变性;D组光镜下可见肿瘤血管内皮细胞溶解、血栓形成,完全闭塞血管,血管周围肿瘤细胞呈核碎裂、核溶解坏死。见图3。

图3 D组病理学检查结果
2.4 超微结构观察 HIFU辐照后第3天,A组、B组、C组透射电镜下超微结构示:肿瘤血管管壁完整,偶见内皮细胞及周细胞,肿瘤细胞及内皮细胞均无明显改变,D组肿瘤血管内皮细胞肿胀,核局部轻度溶解,肿瘤细胞的细胞器肿胀、裂解,核异染色质边集,胞质内可见大小不等的空化泡。辐照后第7天,D组肿瘤血管轮廓尚存,而内皮细胞断裂、脱落、溶解,肿瘤细胞核碎裂。见图4。
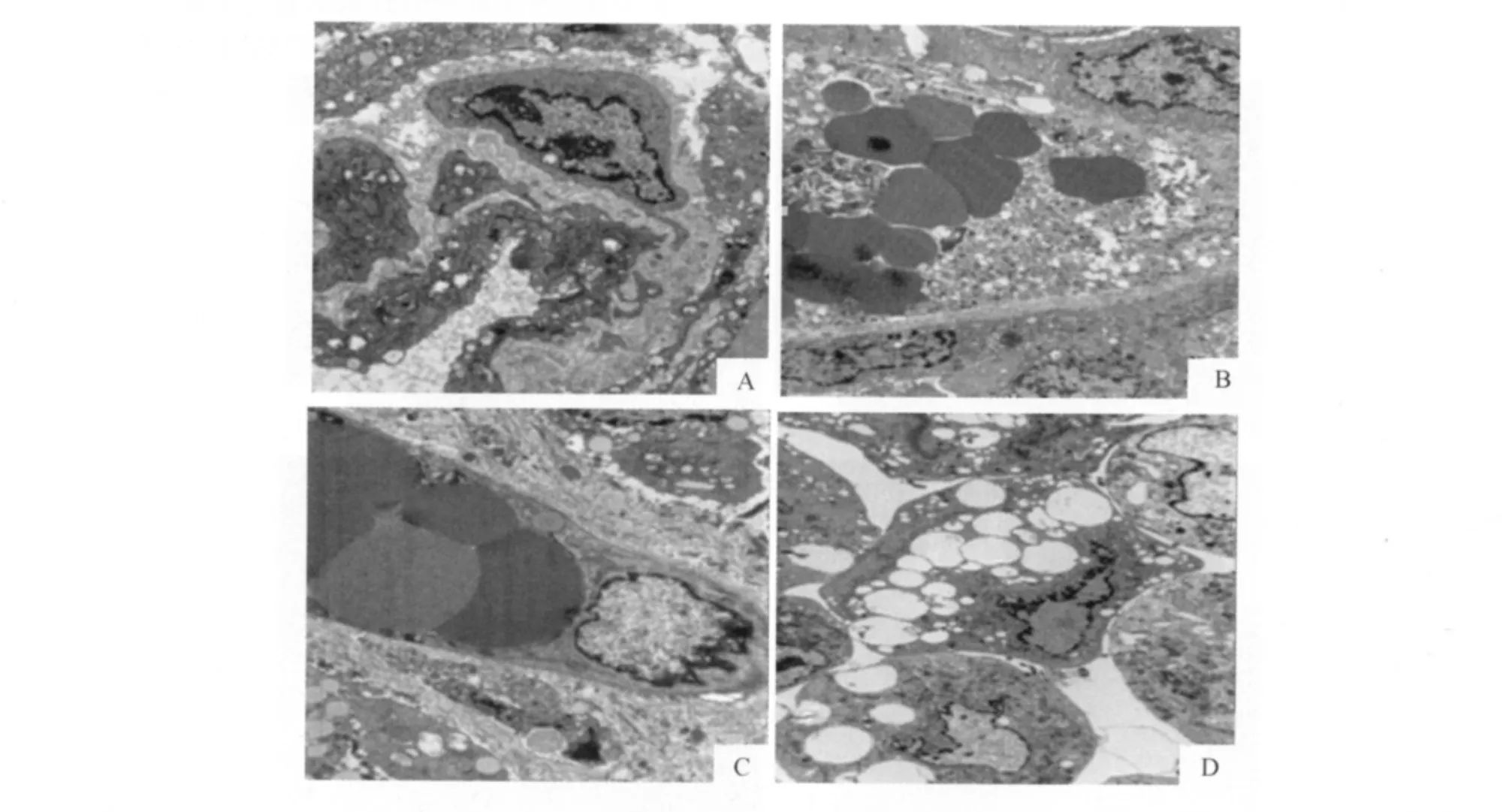
图4 各组辐照后肿瘤血管细胞超微结构的变化
3 讨论
肿瘤血管是肿瘤快速生长、转移的必要条件,阻断或破坏肿瘤血管可能抑制肿瘤的增生、转移。抗血管生成和血管靶向治疗在临床治疗肿瘤中取得一定的效果,但是疗效待进一步证实,采用阻断血供的方法,可抑制肿瘤细胞的增殖,导致肿瘤的消退,但远期效果不理想。经导管栓塞化疗是目前应用较多的一种阻断血供的方法,但此方法会给患者带来较严重的创伤,且栓塞剂会随血流运行或时间的延长造成异位栓塞或减低疗效。
Hynynen等[7]认为HIFU对血管的作用及作用机制与血管管径、血流速度和超声特性(频率、声强、辐照时间)有关。Ishikawa等[8]和Denbow 等[9]分别采用频率为3.2 MHz、1.7 MHz的 HIFU 辐照鼠股动脉,使动脉内血栓形成,血流完全阻断,但血管周围组织出现坏死,安全性不好。而采用频率为0.4 MHz,焦域声强为1990 W·cm-2HIFU辐照能使兔股动脉栓塞,而血管周围组织无坏死,该治疗参数有效且安全。分析血栓形成的原因是HIFU辐照后,血管内皮细胞受损,内皮下细胞外基质裸露,血小板与内皮下细胞外基质接触黏附,同时裸露的胶原纤维激活Ⅷ因子以及损伤的内皮细胞释放出组织因子,启动外源性和内源性凝血途径,从而导致血栓形成,而在兔股动脉附近接种肿瘤建立动物肿瘤模型,其肿瘤间质血管是在周围正常血管的基础上延伸扩展形成的,是供给肿瘤营养的血管的终末分支,其与股动脉相比具有如下特点:1)血管扭曲扩张,不规则分支,血管管径小于股动脉,其血管内血流速度较低,血流形态不一;2)血管仅有一层内皮细胞构成,无平滑肌和神经末梢,血管收缩功能差,血管基底膜不完整,通透性增高,血管外周间隙增大,从理论上可以推测该参数的HIFU可以栓塞肿瘤血管,我们最终的研究结果也证实了这一点。
本研究结果表明,频率 0.4 MHz,焦域声强为1990 W·cm-2HIFU可诱导肿瘤血管栓塞,阻断肿瘤血供,使肿瘤生长明显减缓,且肿瘤周围正常组织无坏死,安全性高,为临床寻求一种新的非侵入性栓塞肿瘤血管无创治疗或综合治疗良、恶性肿瘤提供有价值的实验依据。
[1]Folkman J,Shing Y.Angiogenesis[J].J Biol Chem,1992,267(16):10931 -10934.
[2]Leenders WP,Küsters B,de Waal RM.Vessel co-option:how tumors obtain blood supply in the absence of sprouting angiogenesis[J].Endothelium,2002,9(2):83 -87.
[3]Wu F,Chen WZ,Bai J,et al.Tumor vessel destruction resulting from high-intensity focused ultrasound in patients with solid malignancies[J].Ultrasound Med Biol,2002,28(4):535 -542.
[4]陈文直,王智彪,白晋,等.VX2兔恶性骨肿瘤模型的建立及其生物学特性观察[J].重庆医科大学学报,2002,27(3):286-288.
[5]王翔,杜文华,杨未晓,等.造影多普勒超声显像检测兔肝VX2肿瘤血液供给与肿瘤血管生成相关性的实验研究[J].中国超声医学杂志,2005,21(5):332 -335.
[6]王翔,杜文华,杨未晓,等.多普勒声学造影与DSA检查对照观察兔肌肉VX2肿瘤血管的实验研究[J].临床超声医学杂志,2004,6(6):324 -327.
[7]Hynynen K,Colucci V,Chung A,et al.Noninvasive arterial occlusion using MRI-guided focused ultrasound[J].Ultrasound Med Biol,1996,22(8):1071 -1077.
[8]Ishikawa T,Okai T,Sasaki K,et al.Functional and histological changes in rat femoral arteries by HIFU exposure[J].Ultrasound Med Biol,2003,29(10):1471 -1477.
[9]Denbow ML,Rivens IH,Rowland IJ,et al.Preclinical development of noninvasive vascular occlusion with focused ultrasonic surgery for fetal therapy[J].Am J Obstet Gynecol,2000,182(2):387 - 392.

