复合益生菌芽孢杆菌发酵培养基及条件的优化
张媛媛 赵 敏 张 宁
(东北林业大学,哈尔滨,150040)
社会呼唤绿色、安全的食品,而饲料安全更是食品安全的前提。有理由相信,动物饲料中大量使用益生菌制剂的时代已经来临[1]。芽孢杆菌制剂是一种常用高效益生菌添加剂。枯草芽孢杆菌作为芽孢杆菌属的模式种具有很多优点,包括耐酸、耐盐、耐高温(100℃)及耐挤压等特性,因而在饲料的加工、贮藏以及通过动物胃肠道酸性环境等的过程中具有较高的稳定性[2]。此外它还具有很强的蛋白酶、脂肪酶、淀粉酶的活性,对植物性碳水化合物具有较强的降解能力,可促进机体对食物的消化吸收[3]。而凝结芽孢杆菌更是一种具有广阔发展前景的益生菌,它不但具有芽孢杆菌的优点,更兼具乳酸菌的特性,有效地添补了乳酸菌制剂和双歧杆菌制剂耐性差、培养及储存条件苛刻等方面的缺陷[4-5]。Adami and Cavazzoni[6]发现,凝结芽孢杆菌对仔猪粪中的微生物区系有明显的影响,且这种益生菌有利于改善动物的生产性能。因此,本研究选取二者进行联合培养,充分考虑到二者的共性和特性,培养基配方也采用了成本低廉且适用于工业生产的发酵原料,以期在动物饲养中获得更显著的效果并带来更可观的经济效益。
1 材料
菌种 枯草芽孢杆菌(Bacillus subtili)1.892,购自中国普通微生物菌种保藏管理中心;凝结芽孢杆菌(Bacillus coagulans)1.200 9,购自中国普通微生物菌种保藏管理中心。
培养基 种子培养基:蛋白胨10 g/L,酵母浸出物5 g/L,NaCl 10 g/L,pH=7.2 ~7.5,121 ℃灭菌20 min。
发酵培养基:葡萄糖20 g/L,蛋白胨10 g/L,NaCl 4 g/L,pH=7.2 ~7.5,121 ℃灭菌20 min;计数培养基:LB琼脂培养基。
主要试剂 工业用废糖蜜(哈尔滨英瑞斯饲料有限公司提供,含糖量为570 g/L),玉米粉(市售,GB/T 8885—2008),豆粕粉(哈尔滨英瑞斯饲料有限公司提供,含氮量为76.3 g/L),玉米浆(哈尔滨英瑞斯饲料有限公司提供,含氮量35.8 g/L),琼脂(生物试剂,北京索来宝科技有限公司);葡萄糖、可溶性淀粉、蔗糖、麦芽糖、乳糖、尿素、NH4Cl、OXOID酵母浸粉(生物试剂,北京鸿润宝顺科技有限公司)、蛋白胨、MgSO47H2O、KH2PO4、K2HPO4、NaCl、CaCO3、氯化钙(均为分析纯,天津市北方天医化学试剂厂)。
仪器设备 FLC—3CLEAN BENCH超净工作台(哈尔滨市东联公司),DGX—9243B—1电热鼓风干燥箱(上海福玛实验设备有限公司),HZQ—F160型振荡培养箱(哈尔滨市东联电子技术开发有限公司),MLS—3020高压灭菌锅(SANYO Electric Co.Ltd.),HAIER BCD—237F电冰箱(青岛海尔电冰箱股份有限公司),HZQ—F160A型恒温培养箱(上海一恒科学仪器有限公司),PHS—3S精密PH计(上海精密科学仪器有限公司)。
2 试验方法
2.1 培养方法
①菌种活化:将保存于斜面的两株菌种分别转接到新鲜的LB斜面培养基上,37℃培养18 h,置于冰箱中4℃保存,备用。
②种子液的制备:取20 mL种子培养基于100 mL三角瓶中,灭菌后各接入一环活化的菌种,37℃、150 r/min条件下培养18 h。
③摇瓶发酵培养:取100 mL发酵培养基于250 mL三角瓶中,灭菌后接入两种芽孢杆菌各1.5 mL(总接种量为3%)。将三角瓶置37℃、150 r/min振荡培养24 h。
2.2 培养基成分的单因子试验
碳源:分别用20 g/L的废糖蜜、玉米粉、可溶性淀粉、蔗糖、麦芽糖、乳糖、废糖蜜+玉米粉(m(废糖蜜)∶m(玉米粉)=1∶1)等量替代基础发酵培养基中的葡萄糖,制成培养基进行发酵培养。24 h后检测活菌数,确定最佳碳源。
氮源:分别用10 g/L的尿素、豆粕粉、NH4Cl、酵母浸粉、豆粕粉+NH4Cl(m(豆粕粉)∶m(NH4Cl)=1∶1)、玉米浆、(NH4)2SO4等量替代基础发酵培养基中的蛋白胨,制成培养基进行发酵培养。24 h后检测活菌数,确定最佳氮源。
无机盐:分别用4 g/L的硫酸镁、磷酸二氢钾(2 g/L)+磷酸氢二钾(2 g/L)、氯化钙、硫酸亚铁、碳酸钙等量替代基础发酵培养基中的氯化钠,制成培养基进行发酵培养。24 h后检测活菌数,确定最佳无机盐。
最佳碳源质量浓度:在确定最佳氮源和最佳无机盐的含量不变的条件下,分别取质量浓度为10、20、30、40、50、60 g/L 的碳源进行摇瓶发酵培养,24 h后检测活菌数,以确定最佳碳源的质量浓度。
最佳氮源质量浓度:在确定最佳碳源和最佳无机盐的含量不变的条件下,分别取质量浓度为10、20、30、40、50、60 g/L 的氮源进行摇瓶发酵培养,24 h后检测活菌数,以确定最佳氮源的质量浓度。
最佳无机盐质量浓度:在确定最佳碳源和最佳氮源的含量不变的条件下,分别取质量浓度为2、4、6、8、10、12 g/L 的无机盐进行摇瓶发酵培养,24 h 后检测活菌数,以确定最佳无机盐的质量浓度。
上述各试验均作3次重复,结果取平均值。
2.3 正交试验
将单因子试验筛选出的最佳碳源、氮源、无机盐,按照L9(3)4正交表设计正交试验进一步优化,每试验进行3次重复。正交试验因素及其水平见表1。

表1 L9(34)正交设计因素表 g·L-1
2.4 发酵条件的优化
采用正交试验优化出的培养基配方,在保证发酵过程中其他发酵条件不变的情况下,对最佳培养时间、温度、初始pH值、转速、接种量、装液量进行逐一优化。每一试验进行3次重复,结果取平均值。
采用平板稀释涂布法[7]进行活菌计数。
采用正交设计助手II对数据进行处理。
3 结果与分析
3.1 发酵培养基成分的优化
3.1.1 不同碳源对复合益生菌芽孢杆菌生长的影响
以m(废糖蜜)∶m(玉米粉)=1∶1的比例混合发酵时,复合益生菌芽孢杆菌的活菌数最高,达到7.71×109CFU/mL;其次是废糖蜜,活菌数达 6.43×109CFU/mL,二者均高于基础碳源葡萄糖的活菌数为6.04×109CFU/mL;而其余碳源的活菌数均低于基础碳源葡萄糖(表2)。废糖蜜、玉米粉作为碳源不但活菌数高且价格低廉,发酵成本低,适用于规模化生产。
3.1.2 不同氮源对复合益生菌芽孢杆菌生长的影响
豆粕粉作为氮源时,复合益生菌芽孢杆菌的活菌数最高,达到6.06×109CFU/mL;其次是基础氮源蛋白胨,活菌数达5.74×109CFU/mL(表2)。其中,无机氮源的活菌数均明显低于有机氮源,可见芽孢杆菌对有机氮源的利用率更高,更适合其生长。选择复合芽孢杆菌生长的最佳氮源为豆粕粉。
3.1.3 不同无机盐对复合益生菌芽孢杆菌生长的影响
分别以m(磷酸氢二钾)∶m(磷酸二氢钾)=1∶1和氯化钙作为无机盐发酵时,活菌数均高于基础无机盐氯化钠,前两者活菌数分别为5.63×109CFU/mL和 5.02×109CFU/mL,而氯化钠为 4.96×109CFU/mL(表2)。其他无机盐活菌数均小于氯化钠。故选择m(磷酸氢二钾)∶m(磷酸二氢钾)=1∶1和氯化钙作为最佳无机盐。

表2 不同培养基成分对复合益生菌芽孢杆菌生长的优化结果
3.1.4 最佳碳源的不同质量浓度对复合益生菌芽孢杆菌生长的影响
最佳碳源的不同质量浓度对复合芽孢杆菌的生长存在一定的影响,选择质量浓度低的碳源时,随着质量浓度的逐渐增加,活菌数也不断提高,当质量浓度达到3%时,活菌数最高,为5.66×109CFU/mL。其后随着最佳碳源不同质量浓度的进一步提高,活菌数逐步缓慢下降并趋于平稳(表3)。故选择3%时的碳源为最佳碳源含量。
3.1.5 最佳氮源的质量浓度对复合益生菌芽孢杆菌生长的影响
当氮源的质量浓度较低时,对复合芽孢杆菌活菌数的影响并不明显,但随着氮源质量浓度的不断提升,当氮源的质量浓度达到4%时,芽孢杆菌活菌数提高到1.02×1010CFU/mL之后缓慢递减(表3)。故选择4%时的氮源为最佳氮源含量。
3.1.6 最佳无机盐的质量浓度对复合益生菌芽孢杆菌生长的影响
最佳无机盐所选取的6种不同的质量浓度对复合芽孢杆菌活菌数的影响并不显著,均能达到6.0×109CFU/mL左右。随着最佳无机盐质量浓度的逐渐增大,活菌数基本保持平稳,变化幅度不大(表3),故选取最低的质量浓度为0.2%的最佳无机盐便可以满足芽孢杆菌正常的生长代谢。
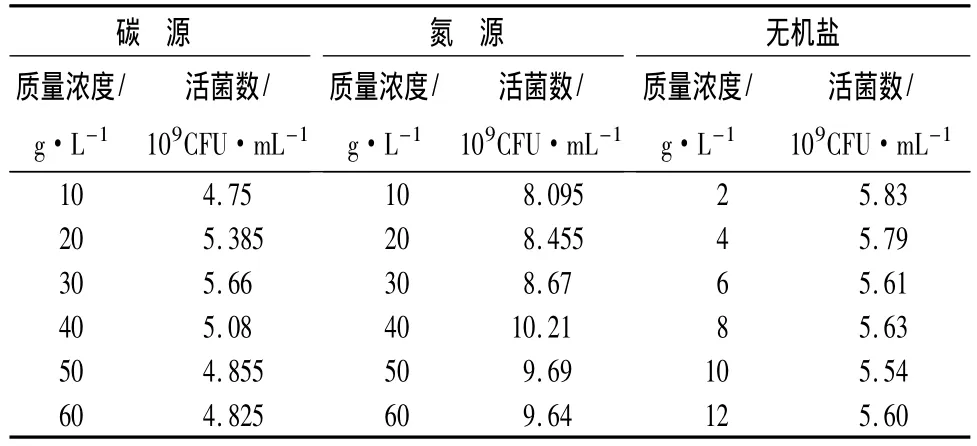
表3 最佳碳源、氮源、无机盐的不同质量浓度对复合益生菌芽孢杆菌生长的优化结果
3.1.7 正交试验
对单因子试验优化出来的各营养成分做进一步优化,采用L9(3)4正交表进行正交试验,以期找到培养基成分中碳源、氮源、无机盐之间的最佳配比,结果见表4。

表4 培养基优化正交试验表
正交试验优化出的最佳组合为A2B2C1D2,由于该组合并不在以上正交试验所列的9次试验范围内,故对正交试验得出的最优组合进行了验证性试验,试验结果显示:对A2B2C1D2组合的3次试验结果取平均值,活菌数达6.370×1010CFU/mL,高于9次试验中的最高活菌数5.931×1010CFU/mL。故复合芽孢杆菌的最佳培养基配方为废糖蜜15 g/L、玉米粉 15 g/L、豆粕粉 40 g/L、KH2PO41 g/L、K2HPO41 g/L、氯化钙2 g/L。极差分析得 RA>RB>RC>RD,可知各因素对复合芽孢杆菌活菌数的影响大小依次为:废糖蜜>豆粕粉>磷酸盐>氯化钙。对正交试验的方差分析表明(表5),废糖蜜、豆粕粉为显著影响因子,无机盐为不显著影响因子,故选取较低质量浓度的无机盐方可满足益生菌生长的需求。
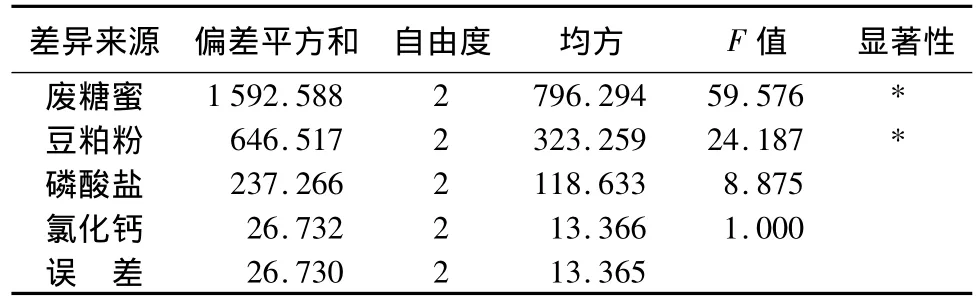
表5 正交试验方差分析结果
3.2 发酵条件的优化
3.2.1 生长曲线的测定
按试验确定的最佳培养基配方对种子进行摇瓶发酵培养,培养时间为32 h。自接种后每2 h取样1次测定菌液的OD600nm,未接种的培养基作为空白对照,结果见图1。由图1可知,种子液接入发酵培养基后,0~6 h为生长的延滞期;6~16 h为对数期,菌体数量急剧增多;18 h以后为芽孢杆菌的相对稳定期。可见复合芽孢杆菌的最佳培养时间应选在18~26 h之间。

图1 复合益生菌芽孢杆菌的生长曲线
3.2.2 初始温度对复合益生菌芽孢杆菌生长的影响
温度主要通过改变酶反应速率来影响菌体的生长。随着培养基温度的升高,酶促反应的速率也随之增大,代谢水平加快。但温度过高会引起酶类失活,表现为菌体迅速衰老,导致活菌数大幅度降低,影响产量。试验选取25、30、35、40、45、50 ℃作为摇床温度,摇瓶发酵培养24 h,运用平板稀释涂布法进行活菌计数,确定不同温度对复合芽孢杆菌生长的影响。试验结果表明,温度为35~40℃时,活菌数较高,且以37℃时为最高,活菌数可达3.73×1010CFU/mL(表6)。
3.2.3 初始pH值对复合益生菌芽孢杆菌生长的影响
pH值主要通过影响菌体细胞膜电荷、膜渗透性以及营养物质离子化的程度,从而影响菌体对养分的吸收。由于摇瓶过程中的pH值难以控制,只能控制发酵液的初始pH值。因此本试验将最佳培养基配方的初始 pH 分别调至 4.5、5.5、6.5、7.5、8.5、9.5,摇瓶发酵培养24 h后测其活菌数。复合芽孢杆菌在初始pH值为7.0~8.0范围内的活菌数较高,且以pH=7.5时为最高,活菌数可达5.69×1010CFU/mL(表6)。
3.2.4 接种量对复合益生菌芽孢杆菌生长的影响
接种量的多少与菌株生长周期的长短有关,不同接种量对复合芽孢杆菌活菌数影响较大,接种量过高或过低均会影响活菌数的水平。接种量低,延滞期过长,造成培养周期延长,耗费大量时间;接种量高,细菌对营养成分的竞争力过大,造成菌体因营养供应不足而提前死亡,同样会抑制活菌数的提高,故试验选取2%、4%、6%、8%、10%、15%的接种量进行接种,摇瓶发酵培养24 h后测其活菌数。接种量为8%时,复合芽孢杆菌的活菌数达最高,为3.42×1010CFU/mL(表6)。可见复合芽孢杆菌的最佳接种量为8%。

表6 不同发酵条件对复合芽孢杆菌生长的优化结果
3.2.5 装液量对复合芽孢杆菌生长的影响
装液量的大小主要反映摇瓶内溶氧量的多少,装液量越小,瓶内溶氧则越多。在250 mL三角瓶中分别装入最佳培养基,使得装液量分别为30%、35%、40%、45%、50%、55%,摇床发酵培养24 h后测其活菌数。采用40%的装液量时活菌数最高,为3.84×1010CFU/mL,但随着装液量的增大,活菌数不断下降(表6)。可见溶氧水平越高,则越适合需氧的复合芽孢杆菌生长。在实际生产中,可以根据实际情况,酌情掌握装液量的大小,尽可能使溶氧量增加。
3.2.6 摇床转速对复合芽孢杆菌生长的影响
不同摇床转速对复合芽孢杆菌发酵的活菌数存在一定的影响。随着摇床转速的增大,活菌数得到显著提高,当转速达到160 r/min时,活菌数达到最高,为 4.53×1010CFU/mL(表6),但进一步提高摇床转速,活菌数则开始逐渐下降,可能由于转速过高会加快细菌菌体的裂解所致。故选定160 r/min为复合芽孢杆菌发酵培养的摇床转速。
4 结论
采用单因子试验及正交试验,在摇瓶中对复合芽孢杆菌的培养基成分进行优化,通过平板稀释涂布法测定培养24 h后的活菌数,以活菌数的高低作为评价指标,得到最优培养基配比为:废糖蜜15 g/L、玉米粉 15 g/L、豆粕粉 40 g/L、KH2PO41 g/L、K2HPO41 g/L、氯化钙2 g/L。通过单因子试验确定了最佳培养条件[8]为:起始 pH=7.5、温度 37 ℃、接种量8%、装液量40%、摇床转速160 r/min。通过对复合芽孢杆菌培养基及培养条件的优化后,活菌数得到显著提高,达到6.62×1010CFU/mL。明显高于崔东良等[9]对单株凝结芽孢杆菌工业化发酵培养基初步研究所得的活菌数9.3×109CFU/mL,且成本低廉,更适合于工业化生产。
本试验仅是在实验室摇床培养条件下进行的优化,还需在生产用发酵罐中做进一步验证。对于实际生产中各项发酵参数的设定,也需要做更详尽的研究。
[1]郭兴华.益生菌基础与应用[M].北京:北京科学技术出版社,2002.
[2]邓露芳,王加启,卜登攀,等.纳豆芽孢杆菌作为益生菌饲用的研究现状[J].中国畜牧兽医,2007,34(10):5-8.
[3]Schallmey M,Singh A,Ward O P.Developments in the use of Bacillus species for Industrial production[J].Canadian Journal of Microbiology,2004,50(1):1-17.
[4]Lacroix C,Yildirim S.Fermentation technologies for the production of probiotics with high vability and functionality[J].Current Opinion in Biotechnology,2007,18(2):176-183.
[5]季奎文,吕学敏,刘东田.动物益生素凝结芽孢杆菌的开发与应用[J].兽药与饲料添加剂,2006,11(6):17-18.
[6]Adami A,Cavazzoni V.Occurrence of selected bacterial groups in the faeces of piglets fed with Bacillus coagulans as probiotic[J].J Basic Microbiol,1999,39(1):3-9.
[7]方中达.植病研究方法[M].3版.北京:中国农业出版社,1999:189-192.
[8]周芳,牟海津,江晓路,等.芽孢杆菌M-21产β-甘露聚糖酶发酵条件研究[J].食品与发酵工业,2007,33(2):10-14.
[9]崔东良,佟建明,王云山,等.凝结芽孢杆菌工业化发酵培养基初步研究[J].食品与发酵工业,2007,33(12):73-75.

