高通量筛选法在测定腈水解酶活性中的应用
张淑蓉,刘建萍,梁国娟
(1.重庆医科大学药学院,重庆400016;2.重庆市万州区环境监测站,重庆404020)
腈是一类重要的化合物,它的水解反应被广泛应用于氨基酸、酰胺、羧酸及其衍生物的合成[1-2],在有机合成中占有极其重要的地位。腈水解的方法主要有化学水解法和生物转化法。腈的化学水解因其需要强酸或强碱、高温、高压等反应条件,而且副产物多、产量低、环境污染严重,而大大限制了它在工业上的应用。相反,生物转化法具有条件温和、环境污染小,并能实现化学选择性、区域选择性和对映选择性等优点。生物转化法涉及的酶系主要有腈水合酶、酰胺酶和腈水解酶。腈水解酶可催化腈经一步水解反应生成相应的羧酸[3-6]。目前报道的腈水解酶大都来自微生物[7-9],虽然微生物种类繁多,但仍然不能满足日益增长的工业需求,有许多具有高催化活性的腈水解酶没有被发掘,因此筛选高活性的腈水解酶具有十分重要的现实意义。烟酸,又名尼克酸,俗称维生素B5,是人体中不可缺少的营养成分[10]。烟酸具有增强细胞新陈代谢、扩张血管、促进人体和动物生长发育的功能[11],还可作为药物中间体,合成多种有重要用途的酰胺类和酯类衍生物药品[12]。据估计,世界每年对烟酸及其衍生物的需求量大约是22 000t[13]。由于腈化学水解法的局限,近些年来,用生物转化法生产烟酸逐渐引起了人们的兴趣。本文通过高通量筛选法筛选出了具有高活性的腈水解酶131,并将其用于催化3-氰基吡啶水解来制备烟酸。
1 实验部分
1.1 实验材料
腈水解酶,尚科生物医药上海有限公司;3-氰基吡啶(AR),美国 ACROS公司;乙腈(AR)、丙烯腈(AR)、磷酸钠(AR)、磷酸氢钠(AR),上海试一化学试剂有限公司。
1.2 实验仪器
高效液相色谱仪(HPLC-2010A)和质谱仪(LCMS-2010),日本Shimadzu公司;核磁共振仪(400 MHz,d6-DMSO为溶剂),美国Varian公司。
1.3 实验步骤
1.3.1 腈水解酶的高通量筛选 酶的筛选采用尚科生物医药(上海)有限公司自制的高通量筛选预制板[14],腈水解酶筛选板中通常采用100μL的反应体系,其中每孔中的最终反应条件为:10mg/mL底物,10mg/mL酶,10%有机助溶剂(如果底物不溶于水),pH=8.0。
酶筛选板各孔中加入90μL去离子水,以防止辅酶变质,将10mg底物3-氰基吡啶溶于1mL去离子水中制备成底物母液,再将10μL底物母液和pH 8.0磷酸钠-磷酸氢钠缓冲溶液分别加入到酶筛选96孔板各孔中,然后将酶筛选板放置于30oC和速度为160r/min的摇床中反应24h。反应结束后,在酶筛选板各孔中加入0.1mL乙腈灭活,震荡5~10min,离心10min(4 000r/min),将乙腈水溶液取出放入新的96孔板,直接用高效液相色谱仪和质谱仪(LC-MS)分析。
1.3.2 酶活测定方法 反应体系终组成:1g/L粗酶液,酶的用量可根据实际情况调整,使反应的转化率达到10% 即可;0.5mL,10mmol/L,pH 8.0的磷酸钠-磷酸氢钠缓冲溶液;50mmol/L丙烯腈。反应条件:30℃、每分钟160转条件下反应0.5h,加入等体积的乙腈,进样量为2μL。产物标准曲线为y=0.061 9x,y为浓度(mmol/L);x为峰面积(×104)。
酶活定义:在上述反应条件下,每小时生成1μmol产物所需的酶量为一个酶活单位(U)。
1.3.3 酶催化反应的条件 酶催化反应的模型:

酶水解反应体系包括:0.02g/L腈水解酶粗酶,1g/L的底物3-氰基吡啶,0.5mL,10mmol/L,pH 8.0的磷酸钠-磷酸氢钠缓冲溶液。在30℃、磁力搅拌条件下,反应一定时间后,加入等体积的乙腈,离心后用高效液相色谱(HPLC)测定反应生成的烟酸。
1.3.4 分析方法 反应液中反应物3-氰基吡啶和产物烟酸的量通过高效液相色谱法(HPLC)来检测,色谱柱为C18柱 (4.6mm×150mm,5μm),流动相为A相(含0.1%TFA纯净水)和B相(含0.1%TFA乙腈),梯度洗脱程序为0min(90∶10),3.5min(10∶90),4min (10∶90),流速为1.0mL/min,在254nm波长处紫外检测。底物出峰时间为2.9min,产物出峰时间为2.1min。色谱图见图1。

图1 高效液相色谱图
2 结果与讨论
2.1 腈水解酶131的高通量筛选
运用高通量筛选法,对比研究了尚科生物医药(上海)有限公司自制的30种腈水解酶。其酶活测定数据见表1。结果表明,有少量的腈水解酶可以催化3-氰基吡啶直接水解生成烟酸,但反应效率不同,其中腈水解酶131的酶活17.6U/mL,比酶活35.2U/mg,转化率最高。因此,选用腈水解酶131进行下一步研究。

表1 腈水解酶测活
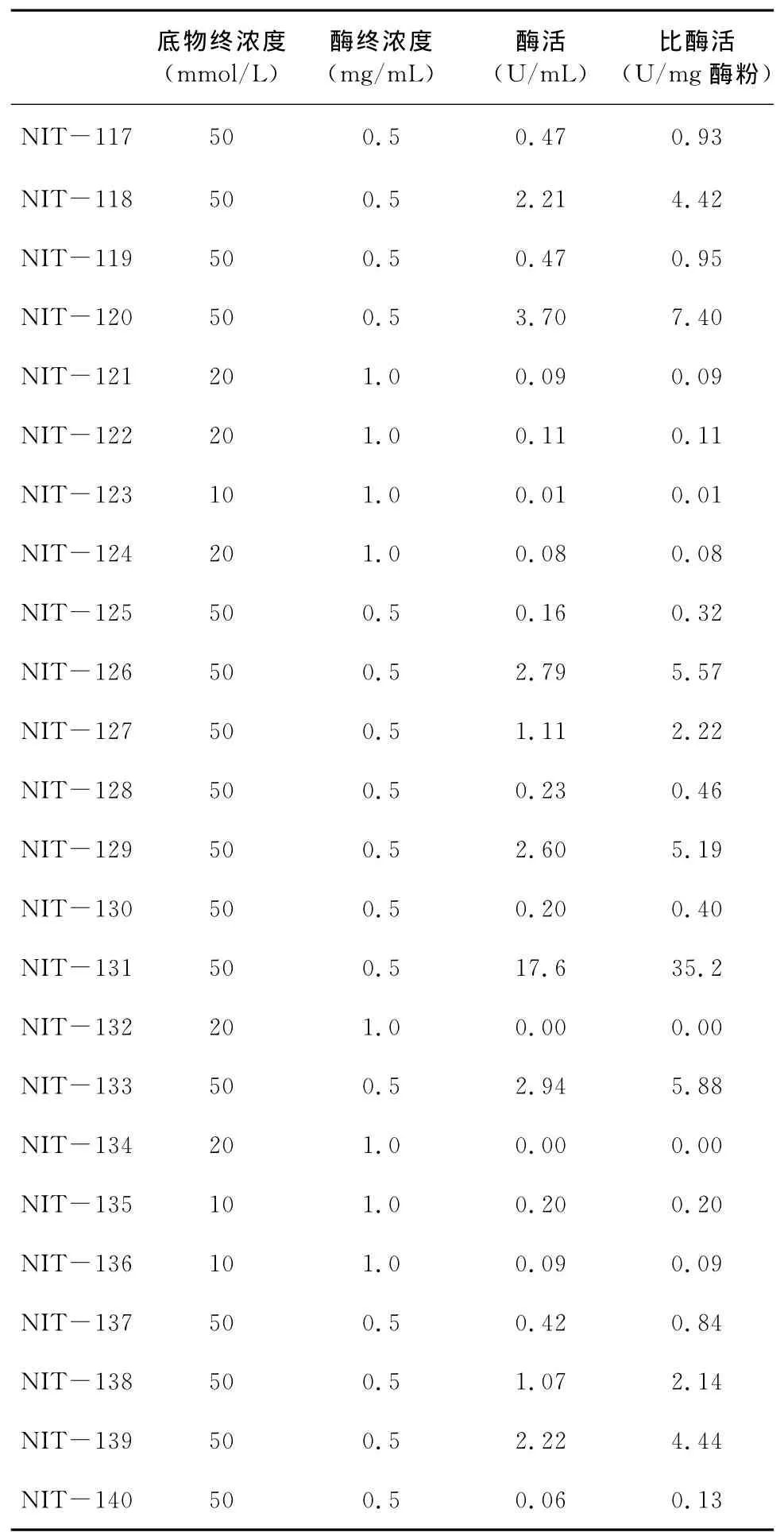
底物终浓度(mmol/L)酶终浓度(mg/mL)酶活(U/mL)比酶活(U/mg酶粉)NIT-117 50 0.5 0.47 0.93 NIT-118 50 0.5 2.21 4.42 NIT-119 50 0.5 0.47 0.95 NIT-120 50 0.5 3.70 7.40 NIT-121 20 1.0 0.09 0.09 NIT-122 20 1.0 0.11 0.11 NIT-123 10 1.0 0.01 0.01 NIT-124 20 1.0 0.08 0.08 NIT-125 50 0.5 0.16 0.32 NIT-126 50 0.5 2.79 5.57 NIT-127 50 0.5 1.11 2.22 NIT-128 50 0.5 0.23 0.46 NIT-129 50 0.5 2.60 5.19 NIT-130 50 0.5 0.20 0.40 NIT-131 50 0.5 17.6 35.2 NIT-132 20 1.0 0.00 0.00 NIT-133 50 0.5 2.94 5.88 NIT-134 20 1.0 0.00 0.00 NIT-135 10 1.0 0.20 0.20 NIT-136 10 1.0 0.09 0.09 NIT-137 50 0.5 0.42 0.84 NIT-138 50 0.5 1.07 2.14 NIT-139 50 0.5 2.22 4.44 NIT-140 50 0.5 0.06 0.13
2.2 底物浓度对反应速率的影响
主要考察不同的底物浓度对腈水解酶131催化3-氰基吡啶水解反应速率的影响。图2表明,当底物质量浓度小于8g/L时,反应速率随底物质量浓度的增加而加快,当底物质量浓度为8~10g/L时,反应速率达到最大,再增大底物浓度,则反应速率变小,可见底物3-氰基吡啶对腈水解酶131有一定的抑制作用。
2.3 产物的分离
反应结束后蒸干反应液中的水,加入乙醇,加热回流,然后热过滤。合并滤液,蒸干溶剂后,即得到粗品。加入少量水加热溶解粗品,然后低温重结晶,过滤回收晶体,即为产物纯品,收率约为85%。

图2 底物浓度对腈水解酶131催化3-氰基吡啶水解反应的影响
2.4 产物的鉴定
分别用质谱和核磁验证产物的正确性,分析数据为:ESI-MS m/z:124[M + H]+给出分子量为123;1HNMRδ/10-6:7.5(s,1H,Ar—H)、8.2(s,1H,Ar—H)、8.7(s,1H,Ar—H)、9.0(s,1H,Ar—H)、13.2(s,1H,COO—H)。
3 结论
应用高通量筛选法筛选出的腈水解酶131的酶活为17.6U/mL,比酶活为35.2U/mg,转化率最高。在30℃,pH 8.0,底物质量浓度为8~10g/L时,腈水解酶131能直接催化3-氰基吡啶水解生成烟酸,没有副产物烟酰胺生成,收率约为85%。并用质谱和核磁验证产物烟酸结构的正确性。反应中使用的酶易于低成本制备,不需要昂贵的设备,也无环境污染问题,反应及后处理过程简单,易于放大。虽然这只是初步研究结果,转化过程还有待进一步优化,但足以证明生物催化技术应用于烟酸制备中的可行性,为烟酸绿色工艺的发展提供了新的思路。
[1]Prasad S,Mistra A.A Propionitrile-induced Nitrilase of Rhodococcus SP NDB1165and its Application in Nicotinic Acid Synthesis[J].World J Microbiol Biotechnol,2007,23:345-353.
[2]Kumar S,Babu BV.Process Intensification of Nicotinic Acid Production via Enzymatic Conversion using Reactive Extraction[J].Chemical and Biochemical Engineering Quarterly,2009,23:367-376.
[3]娄文勇,宗敏华,李 宁,等.微生物腈水合酶的研究进展[J].分子催化,2001,15:394-399.
[4]刘 铭,焦 鹏,曹竹安.微生物法生产丙烯酰胺的生物催化剂-腈水合酶研究进展[J].化工学报,2001,52(10):847-851.
[5]Pradip K,Mascharak.Structural and functional model of nitrile hydratese[J].Coorination Chemistry Reviews,2001,225:210-214.
[6]Michihiko KS,Sakayu SZ.Nitrile hydrotases[J].Current Qpinion in Chemical Biology,2000,4:95-102.
[7]Chen J,Zheng YG,Shen YC.Biosynthesis of p-methozyphenylacetic acid from p-methoxyphenylacetonitrile by immobilized Bacillus subtillis ZJB-063[J].Process Biochemistry,2008,43:978-983.
[8]Sharma Nitya Nand,Sharma Monica,Kumar Harish,et al.Nocardia globerula NHB-2:Bench scale production of nicotinic acid[J].Process Biochemistry,2006,41:2078-2081.
[9]He YC,Xu JH,Xu Y,et al.Biocatalytic synthesis of(R)-(-)-mandelic acid from racemic mandelonitrile by a newly iso-lated nitrilase-producer Alcaligenes sp.ECU0401[J].Chinese Chemical Letters,2007,18,677-680.
[10]徐克勋.精细有机化工原料及中间体册[M].北京:化学工业出版社,1998:1822-1823.
[11]李艳云,尹振晏,宫彩虹,等.烟酸的研究进展[J].北京石油化工学院学报,2006,14(1):59-64.
[12]熊晓云,邹 永,孙 楠,等.系列烟酸前体药物的合成[J].中国药物化学杂志,2002,12(2):86-91.
[13]Nitya NS,Monica S,Harish K,et al.Nocardia Globerula NHB-2:Bench Scale Production of Nicotinic Acid[J].Process Biochemistry,2006,41:2078-2081.
[14]邱贵森,苏金环.酶的混合物、高通量酶筛选板及其应用[P].CN102154231.

